Вид фагоцитоза при туберкулезе
Обновлено: 25.04.2024
Сведения об иммунной системе, межклеточных взаимодействиях в организме, накопленные за последние десятилетия, позволяют по-новому подойти к разработке патогенеза туберкулеза. Формирование полирезистентных штаммов микобактерий туберкулеза как один из итогов полувековой истории противотуберкулезной терапии и заметное увеличение числа больных с иммунодефицитами различной природы создают новые проблемы перед фтизиатрами всего мира. В настоящее время имеется насущная необходимость изучения патогенеза туберкулеза как в преморбидном периоде, так и при его прогрессирующем течении, а также изучения морфологических изменений в пораженных органах. Без продолжения таких исследований трудно понять причины современного патоморфоза туберкулеза, повышения уровня заболеваемости, терапевтических неудач и смертельных исходов.
The data on immunity and intercellular decades, allow one to have a further insight into the pathogenesis of tuberculosis. Formation of multiresistant strains of Mycobacterium tuberculosis as one of the results of semicentennial history of antituberculous therapy and a noticeable rise in the number of patients with immunodeficiencies of different etiology make phthisiologists in the world to be faced with new problems. There is now a vital need for studying the pathogenesis of tuberculosis both in its premorbidity and progression and for examining morphological changes in the affected organs. If these studies are not under way, it is difficult to understand the causes of the present-day pathomorphism of tuberculosis and higher rates of morbidity, mortality, and therapeutical failures.
А.Г. Хоменко — Центральный НИИ туберкулеза РАМН, Москва
A.H. Khomenko — Central Research Institute of Tuberculosis, Russian Academy of Medical Sciences, Moscow
Т уберкулез чаще всего развивается в результате заражения микобактериями человеческого вида, выделяемыми больным человеком. В ряде районов, неблагополучных по туберкулезу крупного рогатого скота, происходит заражение от животных, заболевание вызывается M. Bovis. Наиболее частый путь заражения – аэрогенный, но возможен алиментарный и весьма редко контактный, через поврежденную кожу или слизистые оболочки. Определенную защитную роль при аэрогенном заражении играет система мукоцилиарного клиренса, позволяющая частично вывести попавшие в бронхи частицы пыли, капельки слизи, слюны, мокроты, содержащие микроорганизмы. При энтеральном заражении может иметь значение всасывающая функция кишечника.
После проникновения микобактерий в организм человека, не зараженного ранее туберкулезом, в качестве первой защитной реакции развивается фагоцитоз. Эффективность этой защитной реакции зависит от многих факторов: возраста, пола, различных индивидуальных факторов риска, наследственной резистентности или предрасположенности к туберкулезу. Течение туберкулезной инфекции определяет в основном состояние иммунитета, как врожденного, так и приобретенного.
Процесс взаимодействия легочных макрофагов с микобактериями туберкулеза очень сложен и до конца не изучен. Результат этого взаимодействия определяется рядом механизмов, в том числе определяющих переваривающую способность макрофагов.
При недостаточной переваривающей способности макрофагов микобактерии туберкулеза могут сохраняться в них и даже размножаться, приводя к разрушению макрофагов и выходу из них микобактерий.
Макрофаги, фагоцитировавшие микобактерии, выделяют во внеклеточное пространство фрагменты разрушенных микобактерий, протеолитические ферменты, а также медиаторы (в том числе интерлейкин-1), которые взаимодействуют с Т-лимфоцитами, в частности Т-хелперами. Происходит активация Т-хелперов и выделение лимфокинов, в том числе интерлейкина-2, g-интерферона и других лимфокинов. Макрофаги устремляются к месту нахождения микобактерий, так как подавляется фактор угнетения миграции, выделяющийся b-лимфоцитами, под влиянием фактора активации макрофагов (этот фактор отождествляют с интерлейкином-2) возрастает ферментативная активность макрофагов. Активированные макрофаги выделяют также кожно-реактивный фактор, который обусловливает воспалительную реакцию, повышение сосудистой проницаемости. С этим фактором связывают появление повышенной чувствительности замедленного типа (ПЧЗТ) и положительной туберкулиновой реакции [1]. Кроме Т-хелперов значительное влияние на состояние иммунитета оказывают Т-супрессоры и супрессорные моноциты, которые угнетают иммунный ответ. Таким образом, процесс фагоцитоза и лизиса микобактерий регулируется Т-лимфоцитами. Их количественные изменения и функциональная активность в настоящее время хорошо изучены у больных туберкулезом, в том числе на субпопуляционном уровне [2, 3]. Кроме того, в инфекционном процессе активное участие принимают вещества, освобождающиеся при разрушении микобактерий. Удалось доказать, что корд-фактор (фактор вирулентности) микобактерий туберкулеза, обусловливающий их рост на плотной питательной среде в виде кос, провоцирует острый воспалительный процесс, а сульфатиды повышают токсичность корд-фактора и, главное, подавляют процесс образования фаголизосом в макрофагах, что предохраняет от разрушения расположенные внутриклеточно микобактерии. При интенсивном размножении микобактерий в организме человека вследствие малоэффективного фагоцитоза выделяется большое число токсичных веществ, индуцируется ПЧЗТ, которая способствует выраженному экссудативному компоненту воспаления с развитием казеозного некроза. В процессе разжижения казеозных масс микобактерии получают возможность для бурного внеклеточного размножения. Увеличивается число Т-супрессоров, происходит угнетение ПЧЗТ, снижение количества Т-хелперов, что приводит к анергии, обусловливающей прогрессирование туберкулезного процесса.
При сравнительно небольшой бактериальной популяции в условиях более эффективного фагоцитоза отмечается другая тканевая реакция – образование туберкулезной гранулемы и формирование туберкулезных очагов. Поскольку величина бактериальной популяции, а также характер течения иммунных реакций на разных этапах туберкулезной инфекции меняются, морфологические проявления у заболевших туберкулезом характеризуются чрезвычайно большим разнообразием.
Клинико-морфологические проявления первичного заражения микобактериями туберкулеза принято называть первичным туберкулезом. В настоящее время хорошо известно, что первичный туберкулез может проявляться не только в виде первичного туберкулезного комплекса, как это было принято считать ранее, возможно развитие туберкулеза внутригрудных лимфатических узлов, плеврита, различных изменений в легких – туберкулем, очагов и др. Первичный туберкулез в результате первичного заражения развивается лишь у 7 – 10% инфицированных, а остальные переносят первичную туберкулезную инфекцию без клинических проявлений, заражение проявляется лишь виражем туберкулиновых реакций. Отсутствие клинико-морфологических проявлений первичной туберкулезной инфекции может объясняться высоким уровнем естественной резистентности к туберкулезу, а также быть следствием иммунитета, приобретенного в результате противотуберкулезной вакцинации БЦЖ.
Первичный туберкулез может протекать с развитием распространенных или множественных изменений или ограниченных воспалительных. Прогрессирующее течение первичного туберкулеза проявляется преимущественно в виде милиарного туберкулеза и менингита, а также в виде первичной казеозной пневмонии с образованием каверны в легком. Такое течение первичной туберкулезной инфекции наблюдается редко и характерно для невакцинированных детей. В настоящее время реже, чем в прежние годы, отмечается хроническое течение первичной туберкулезной инфекции, протекающей у некоторых больных с наличием разнообразных параспецифических проявлений, так называемых масок туберкулеза [4, 5].
Заживление первичного туберкулеза может завершаться с выраженными или малыми остаточными изменениями. В настоящее время, как правило, первичный туберкулез излечивается с небольшими остаточными изменениями. У таких лиц развивается приобретенный иммунитет. Сохранение в остаточных очагах персистирующих микобактерий не только поддерживает приобретенный иммунитет, но и одновременно таит в себе риск эндогенной реактивации туберкулезного процесса вследствие реверсии измененных форм возбудителя туберкулеза в бактериальную форму и размножения бактериальной популяции.
В основе реактивации лежит прогрессирующее размножение микобактерий, находившихся в персистирующем состоянии. Установлено, что реактивация туберкулеза и развитие различных клинических форм вторичного туберкулеза чаще наблюдаются у лиц с остаточными изменениями при наличии факторов, ослабляющих иммунитет.
Возможен и другой путь развития вторичного туберкулеза – экзогенный, связанный с новым, повторным заражением микобактериями туберкулеза (суперинфекцией). Для развития вторичного туберкулеза помимо массивной повторной суперинфекции необходима совокупность ряда факторов, снижающих иммунитет. Вторичный туберкулез характеризуется большим разнообразием клинических форм.
Особо выделяют формы туберкулеза, возникшие вследствие бактериемии при проникновении микобактерий туберкулеза в кровяное русло и развития специфического васкулита. Заболевание может развиваться в виде острого или подострого диссеминированного туберкулеза с поражением многих органов – легких, плевры, печени, селезенки, гортани и др.
Различные сочетания морфологических реакций туберкулезного воспаления создают предпосылки для чрезвычайно большого разнообразия изменений в пораженных органах, особенно при хроническом течении болезни со сменой периодов обострения и затихания процесса. К этому следует добавить, что из сформировавшихся зон поражения микобактерии могут распространяться током лимфы или крови в непораженные участки и различные органы человеческого организма. Исход болезни зависит от течения болезни (прогрессирующего или регрессирующего), эффективности лечения и обратимости изменений, сформировавшихся в течение болезни. Доказано, что в условиях голодания и даже при недостаточном питании, особенно при недостаточном содержании в рационе белков и витаминов, нередко возникает реактивация туберкулеза. К факторам, способствующим реактивации, относятся также различные заболевания: сахарный диабет, лимфогранулематоз, силикоз, язвенная болезнь желудка и двенадцатиперстной кишки, состояние после резекции желудка, хронические воспалительные заболевания легких, психические заболевания, протекающие с депрессивным синдромом, алкоголизм, наркомания, стрессовые ситуации, синдром приобретенного иммунодефицита (СПИД), длительный прием глюкокортикоидов, цитостатиков. В настоящее время течение и исходы туберкулеза следует рассматривать только в условиях проводящейся противотуберкулезной химиотерапии. В процессе химиотерапии уменьшается микобактериальная популяция и создаются более благоприятные условия для репаративных процессов.
Отмечается разное течение инволютивного туберкулезного процесса: регрессия с последующим заживлением, стабилизация туберкулезного процесса без клинического излечения с сохранением каверны, туберкулемы или других изменений; временное затихание воспалительного процесса с последующим возникновением обострения. При неэффективном лечении могут иметь место хронизация или прогрессирование заболевания.
Заживление туберкулезного процесса и последующее излечение зависят не только от уменьшения бактериальной популяции, но и от способности микроорганизма обеспечить регрессию туберкулезного процесса.
При развитии хронического туберкулезного процесса с образованием каверн и появлением лекарственной резистентности микобактерий наступает прогрессирование заболевания, так как химиотерапия малоэффективна, подавления бактериальной популяции не происходит, наоборот, количество микобактерий увеличивается, поражаются все новые участки легких и другие органы. Такой прогрессирующий туберкулезный процесс может быть причиной смертельного исхода, особенно если у больного развивается казеозная пневмония или генерализованный туберкулез с поражением различных внутренних органов. Смертельные исходы заболевания туберкулезом обусловлены не только прогрессирующим течением хронических форм, но и нередким развитием в настоящее время изначально остро прогрессирующих форм туберкулеза, в прошлом названных скоротечной чахоткой. У взрослых это, как правило, казеозная пневмония с быстрым образованием множественных или гигантских каверн. Более чем у половины больных эта форма туберкулеза вызвана полирезистентными к противотуберкулезным препаратам микобактериями, а также осложнено неспецифической микрофлорой, повторяющимися легочными кровотечениями, дыхательной недостаточностью и выраженной интоксикацией.
Развитие остро прогрессирующих форм туберкулеза связывают с быстрым размножением микобактерий и образованием огромной бактериальной популяции, уничтожение или уменьшение которой с помощью противотуберкулезных препаратов невозможно вследствие имеющейся к ним полирезистентности микобактерий. Эта точка зрения подтверждается данными о внутригоспитальных эндемических вспышках туберкулеза со смертельными исходами в больницах Нью-Йорка в США. Следует также обратить внимание на подавление функционального состояния иммунокомпетентных систем организма, в частности моноцитарно-макрофагальной, которые в условиях иммунодефицитного состояния не могут осуществить защитную функцию. Роль иммунодефицита в развитии прогрессирующего туберкулеза и его смертельного исхода четко прослеживается у ВИЧ-инфицированных больных. Смертельные исходы наблюдаются также при сочетании прогрессирующего туберкулеза и рака, лейкоза, лимфогранулематоза.
Таким образом, если в недалеком прошлом изучение патогенеза туберкулеза проводилось в основном с точки зрения развития заболевания и его саногенеза, т.е. процессов заживления, в настоящее время имеется насущная необходимость изучения патогенеза туберкулеза как в преморбидном периоде, так и при его прогрессирующем течении, а также изучения морфологических изменений в пораженных органах. Без продолжения таких исследований трудно понять причины современного патоморфоза туберкулеза, повышения уровня заболеваемости, терапевтических неудач и смертельных исходов.
1. Медуницын Н.В., Литвинов В. И., Мороз А.М. Медиаторы клеточного иммунитета и межклеточного взаимодействия. – М., 1980.
2. Авербах М.М., Гергерт В.Я., Литвинов В.И. Повышенная чувствительность замедленного типа и инфекционный процесс. – М.,1974.
3. Туберкулез. Руководство для врачей // Под ред. А.Г.Хоменко. – М., 1996.
4. Иванова М.Г., Хмельницкий Б.Я. // Руководство по туберкулезу. – М., 1959. – Т. 2. – С. 241–77.
5. Струков А.И. Формы легочного туберкулеза в морфологическом освещении. – М., 1948.
Завершенный и незавершенный фагоцитоз:
Эволюция научила их реализовывать особые защитные механизмы. Например, гонококки выделяют вещества, которые нейтрализуют действие ферментов, предназначенных для их уничтожения. Таким образом, у возбудителя гонореи есть своеобразный антидот к яду, которым организм человека пытается его отравить.
Аналогичная защита имеется у многих других микробов, среди которых по иронии судьбы оказались главным образом самые неприятные: возбудители заболеваний, передающихся половым путем, а также некоторых тяжелых и смертельных болезней.
Фагоцитоз в крови и тканях:
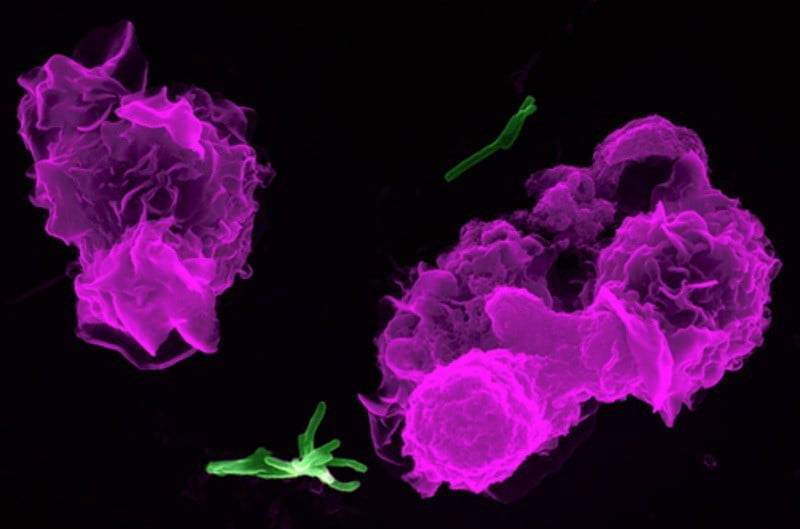
Когда Мечников только открыл явление фагоцитоза, вначале он полагал, что фагоциты содержатся только в тканях, и лишь позже заметил, что они встречаются по всему организму, в том числе и в крови.
Впрочем, такое разделение на виды фагоцитоза весьма условно. Причин тому две. Во-первых, кровеносными сосудами пронизаны все органы, так что при попадании вредоносного объекта в организм практически всегда задействованы фагоциты всех возможных разновидностей. Во-вторых, некоторые фагоциты, например, нейтрофилы, могут из крови переходить в ткани, что они и делают при первых признаках присутствия чужеродных частиц в организме.
В качестве основной роли фагоцитов теория фагоцитоза описывает функцию защиты организма от различных агрессоров. Это действительно так, недаром явление фагоцитоза изучается разделом патологической физиологии человека.
Однако защита нужна не только от факторов, действующих на нас извне, но и от внутренних угроз. Образование вредных продуктов обмена веществ, процесс естественной гибели старых клеток – все это есть и в условиях абсолютной нормы, так что даже организму, который не был заражен бактериями и вирусами, очень нужен и важен фагоцитоз. В этом случае его можно условно назвать физиологическим.
На протяжении жизни каждый из нас встречается с ограниченным количеством вредоносных объектов. Стандартные распространенные заболевания – вот и все, с чем знаком наш иммунитет. Чтобы расширить представления иммунной системы о возможных агрессорах и научить ее правильно на них реагировать уже при первой встрече, нужно принимать препарат Трансфер Фактор.
Он создан на основе факторов передачи, полученных из молозива коров и яичных желтков. Это информационные молекулы, схожие с теми, которые образуют и передают лимфоцитам фагоциты. Прием средства позволяет добиться стабильного улучшения функции иммунитета, исправления уже возникших при его работе ошибок, пополнения банка иммунной памяти, повышения устойчивости организма и укрепления здоровья.

Сологуб Т. В., Романцова М. Г., Кремень Н. В., Александрова Л. М., Аникина О. В., Суханов Д. С., Коваленко А. Л., Петров А. Ю., Ледванов М. Ю., Стукова Н. Ю., Чеснокова Н. П., Бизенкова М. Н., Понукалина Е. В., Невважай Т. А.,
3.5. Общая характеристика и механизмы развития сосудистых реакций в очаге острого воспаления
Как известно, острое воспаление характеризуется определенной последовательностью сосудистых изменений, проявляющихся развитием спазма сосудов, артериальной, венозной гиперемии и стаза.
Спазм сосудов - реакция кратковременная. Спазм может длиться от нескольких секунд (при легком повреждении ткани) до нескольких минут (при тяжелом повреждении). Такая реакция сосудов в очаге воспаления не является строго обязательной и не проявляется в ряде случаев при повреждении паренхиматозных органов. Возникновение спазма сосудов в зоне воспаления обусловлено сокращением гладкомышечных элементов сосудов в ответ на их повреждение, а также возбуждением вазоконстрикторов под влиянием сильного, быстродействующего альтерирующего фактора. Кратковременность этой стадии определяется быстрой инактивацией вазоконстрикторных медиаторов - норадреналина, адреналина под влиянием моноаминоксидазы. Возможно, что в механизмах спазма сосудов в зоне воспаления принимает участие серотонин, освобождающийся в большом количестве при повреждении тканей из тромбоцитов и лаброцитов. Внешним проявлением спазма сосудов является побледнение участка ткани, где развивается воспалительный процесс.
Стадия артериальной гиперемии характеризуется умеренным расширением мелких артерий, артериол, капилляров, венул, а также функционированием резервных капилляров (феномен новообразования капилляров). Расширение сосудов вызывает увеличение кровенаполнения ткани, усиление лимфообразования и лимфооттока. Приток крови может несколько превышать ее отток, что способствует возрастанию гидродинамического давления в сосудах, увеличению линейной и объемной скорости движения крови, снижению артериовенозной разницы по кислороду. На этой стадии формируются такие внешние признаки воспаления, как покраснение и повышение температуры. Усиление оксигенации ткани активирует обмен веществ в клетках, способствует появлению активных форм кислорода, которые, с одной стороны, могут оказывать повреждающее действие на интактные клетки и соединительную ткань, а с другой - становятся факторами защиты организма от инфекционных патогенных агентов, а в дальнейшем оказывают стимулирующее влияние на процессы пролиферации в зоне воспаления. По мере развития артериальной гиперемии к очагу воспаления усиливается приток гуморальных факторов защиты - комплемента, пропердина, фибронектина, интерферона, церулоплазмина и др. Интенсивный кровоток обеспечивает вымывание токсических продуктов обмена, факторов патогенности, продуцируемых микроорганизмами, биологически активных веществ. В ряде случаев, при снижении реактивности организма, за счет интенсивного кровотока могут произойти диссеминация инфекции и развитие септического состояния. Артериальная гиперемия может продолжаться в течение нескольких часов и суток, она наиболее выражена по периферии зоны альтерации. В основе развития артериальной гиперемии лежат несколько механизмов [50, 53]:
1. Нейрогенный - за счет активации аксонрефлекса, усиления холинергических и гистаминергических нервных влияний на сосудистую стенку, а также повреждения сенсорных пептидергических нервных волокон, участвующих в ноцицепции и выделении сенсорных нейропептидов - субстанции Р, пептида гена, родственного кальцитонину, пептида протеинового гена. Указанные нейропептиды обладают выраженным сосудорасширяющим действием.
2. Нейропаралитический - за счет пареза симпатических вазоконстрикторов и снижения чувствительности адренорецепторов сосудов.
3. Миопаралитический - за счет снижения базального тонуса сосудов под влиянием умеренных концентраций вазоактивных соединений (гистамин, кинины, лейкотриены и др.), а также за счет Н+- и К+-гиперионии. По мере нарастания воспалительного процесса артериальная гиперемия сменяется венозной.
Венозная гиперемия характеризуется дальнейшим расширением сосудов, снижением скорости кровотока, полнокровием ткани, феноменом краевого стояния лейкоцитов и их эмиграцией, нарушением реологических свойств крови, усилением процессов экссудации.
Факторы, влияющие на переход артериальной гиперемии в венозную, можно разделить на две группы: внутрисосудистые и внесосудистые [50].
К внутрисосудистым факторам, вызывающим развитие венозной гиперемии, относятся набухание эндотелиальных клеток, краевое стояние лейкоцитов, активация системы гемостаза, сладжирование эритроцитов, сгущение крови, повышение ее вязкости, образование микротромбов.
Из внесосудистых факторов наибольшее значение имеют отек ткани и сдавление венул, мелких вен, лимфатических сосудов экссудатом. Усиливают венозную гиперемию избыточное накопление в очаге воспаления медиаторов с сосудорасширяющим действием, ферментов лизосом и ионов водорода, а также нарушение околокапиллярного соединительнотканного скелета и десмосом в зоне первичной и вторичной альтерации.
Внешними проявлениями венозной гиперемии являются отек ткани, цианоз, снижение обменных процессов и как следствие - снижение температуры в очаге воспаления. Усиление гипоксии и ацидоза стимулирует развитие соединительнотканных элементов по периферии очага воспаления и тем самым обеспечивает формирование барьера, отделяющего воспалительный очаг от здоровой ткани. В образовании барьера принимают участие также нейтрофилы и мононуклеары.
Ограничение кровотока в участке венозной гиперемии и образование барьеров способствуют уменьшению резорбции из очага воспаления продуктов распада, токсических факторов, а также снижают риск распространения инфекционных агентов. Однако при развитии воспаления в паренхиматозных органах длительная венозная гиперемия может привести к снижению их специализированных функций и развитию склерозирования клеток [7, 8].
Исходом венозной гиперемии является стаз - полная остановка кровотока в сосудах. Распространенный стаз характерен для острого, быстроразвивающегося воспаления (гиперергического). Продолжительность и исход стаза могут быть различны. Стаз может длиться от нескольких часов до нескольких дней; он может быть обратимым и необратимым [71].
Механизмы эмиграции лейкоцитов. Роль лейкоцитов в очаге воспаления
Как уже было отмечено, важнейшим признаком венозной гиперемии является эмиграция лейкоцитов из сосудов в воспаленную ткань. Последовательность выхода лейкоцитов получила название закона Мечникова, согласно которому спустя несколько часов (1, 5-2 часа) с момента действия альтерирующего фактора интенсивно эмигрируют нейтрофилы и другие сегментоядерные лейкоциты, а затем моноциты и лимфоциты.
В настоящее время известно несколько классов молекул клеточной адгезии:
1. Селектины - лектиновые молекулы клеточной адгезии, опосредующие самую раннюю стадию взаимодействия лейкоцитов и сосудистой стенки. Селектины экспрессируются рано и не обеспечивают прочного прикрепления лейкоцитов к эндотелию сосудов. Выделяют три вида селектинов: L-селектины синтезируются всеми лейкоцитами,
Е-селектины синтезируются эндотелиоцитами. Указанные селектины обеспечивают феномен краевого стояния лейкоцитов. Источником
P-селектинов являются тромбоциты и эндотелий сосудов, помимо участия в процессах маргинации лейкоцитов, они способствуют адгезии тромбоцитов.
2. Интегрины - это гетеродимерные белки, экспрессируемые различными лейкоцитами и клетками гемопоэтического ряда. Эндотелий экспрессирует лишь некоторые интегрины. В настоящее время идентифицировано пять видов интегринов. Наиболее важными для миграционного и фагоцитарного процесса являются три гетеродимера. Указанные интегрины ответственны за поздние стадии взаимодействия лейкоцитов, тромбоцитов и эндотелия сосудов.
3. Адгезивные молекулы суперсемейства иммуноглобулинов (ICAM) - трансмембранные протеины с пятью внеклеточными доменами, экспрессируемые преимущественно эндотелием. Некоторые из этих молекул синтезируются неактивированными клетками и определяют интенсивность физиологической миграции лейкоцитов. В зоне воспаления под влиянием ИЛ-1, ФНО, гамма-интерферона активируются синтез и экспрессия молекул ICAM, что обеспечивает отсроченную фазу адгезии и эмиграции лейкоцитов. В группу белков, подобных иммуноглобулинам, включены лимфоцитарные рецепторы - СD2, СD58 (LFA-3). Они экспрессируются на Т-лимфоцитах и антигенпредставляющих клетках, участвуют в презентации антигена и контакте цитотоксических лимфоцитов с клетками-мишенями.
4. Адрессины - белки эндотелиальных клеток венул лимфоидных органов. Имеют большое значение в миграции лимфоцитов в очаги хронического и аутоиммунного воспаления. При остром воспалении адрессины менее значимы.
5. Хрящевые соединительные белки. Экспрессируются всеми видами лейкоцитов, распознают гиалуроновую кислоту, что обеспечивает перемещение лейкоцитов в основном веществе соединительной ткани [16, 18].
При недостаточном образовании селектинов и интегринов или выработке антител к мембранным рецепторам снижаются адгезивные свойства лейкоцитов, нарушается их способность к эмиграции, накоплению в очаге воспаления и фагоцитозу, что может способствовать частым гнойным инфекциям и развитию сепсиса.
Важная роль в процессах адгезии и эмиграции принадлежит устранению отрицательного заряда эндотелиальных клеток и лейкоцитов за счет накопления в очаге воспаления одновалентных и двухвалентных ионов (Н, К, Са, Mn, Mg) , а также катионных белков, выделяемых лейкоцитами. Факторами инициации адгезии лейкоцитов к стенке сосуда являются комплемент (С5а), лейкотриены, фибронектин, иммуноглобулины (Fc-фрагмент IgG), гистамин.
После адгезии происходят перемещение лейкоцита по поверхности эндотелиоцита к межэндотелиальной щели, которая в очаге воспаления значительно расширена, а затем и образование ложноножки и передвижение лейкоцита через межэндотелиальную щель в подэндотелиальное пространство и базальную мембрану сосуда. Таким образом лейкоциты оказываются за пределами сосуда.
В большинстве случаев острого воспаления внутрисосудистые перемещения лейкоцитов и их эмиграция занимают несколько часов. Как правило, первыми в очаг воспаления выходят нейтрофилы, они обнаруживаются в воспаленной ткани уже через 6-24 часа. Несколько позднее эмигрируют моноциты и лимфоциты (24-48 часов). Такая асинхронность эмиграции клеток обусловлена неодновременным появлением молекул адгезии и хемотаксических факторов, специфичных для разных лейкоцитов.
Нужно отметить, что временные интервалы эмиграции лейкоцитов и последовательность их выхода весьма относительны и определяются типом сосуда, видом воспаления и стадией воспаления.
Так, в зоне воспалительного процесса, инициируемого возбудителями туберкулеза, листериоза, хламидиоза, токсоплазмоза, вирусной инфекцией, первоначально в очаге воспаления доминируют мононуклеары, при аллергических реакциях - эозинофилы.
Направленное движение лейкоцитов обеспечивается хемоаттрактантами, концентрация которых по мере развития вторичной альтерации в очаге воспаления нарастает, а также наличием рецепторов к различным хемоаттрактантам на поверхности лейкоцитов.
При взаимодействии рецепторов и хемоаттрактантов возникает гиперполяризация мембраны лейкоцита, увеличивается ее проницаемость для ионов Са, инициируется синтез функционально активных фосфолипидов и циклических нуклеотидов, растет число внутриклеточных органелл, функционирование которых обеспечивает перемещение лейкоцита и секрецию содержимого гранул. Помимо ориентированного движения лейкоцитов, хемоаттрактанты индуцируют адгезию лейкоцитов к эндотелию, способствуют краевому стоянию лейкоцитов и их агрегации в просвете микрососудов. Хемотаксис опосредуется различными группами веществ:
1. Цитотаксигенами, которые, не являясь хемоаттрактантами, генерируют факторы хемотаксиса.
2. Цитотаксинами, которые оказывают прямое воздействие на лейкоциты. Некоторые цитотаксины специфичны для нейтрофилов (например, экстракт культуры Е.coli) , а другие цитотаксины индуцируют миграцию гранулоцитов и моноцитов [35].
Хемоаттрактанты могут иметь эндогенное и экзогенное происхождение. Экзогенными хемоаттрактантами являются пептиды бактерий, особенно содержащие N-формиловые группы. Свойствами эндогенных хемоаттрактантов обладают компоненты комплемента, иммуноглобулины, иммунные комплексы, лимфокины и монокины, кинины, лейкотриен В4, продукты липоксигеназного пути превращения арахидоновой кислоты, фактор, активирующий тромбоциты, фактор Хагемана, лизосомальные ферменты и другие.
Роль лейкоцитов в очаге воспаления
Эмигрировавшие в зону воспаления нейтрофилы являются активными фагоцитами, которые очищают зону воспаления от инфекционных возбудителей. Адгезия нейтрофилов к объекту фагоцитоза ускоряется благодаря опсонинам - активным белковым молекулам, прикрепляющимся к объекту и облегчающим распознавание объекта фагоцитирующими клетками. Одновременно с процессами направленного движения лейкоцитов и фагоцитозом в них происходит респираторный взрыв - резкое увеличение потребления кислорода для образования бактерицидных свободных кислородных радикалов (синглетный кислород, гидроксильный радикал, перекись водорода, супероксидный анион). Образование активных форм кислорода происходит с участием ферментов миелопероксидазы, супероксиддисмутазы и каталазы. Освобождающиеся в очаге воспаления активные формы кислорода являются высокотоксичными факторами для бактерий, грибов, микоплазм, вирусов, хламидий и других возбудителей, они нарушают структуру и функции мембран микробных клеток, ограничивают их жизнедеятельность или вызывают гибель микроорганизмов. Помимо антимикробной активности, усиление свободнорадикальных процессов вызывает повреждение интактных паренхиматозных клеток, эндотелиальных клеток сосудов и элементов соединительной ткани в очаге воспаления, что способствует дальнейшей альтерации ткани.
Кроме вновь синтезирующихся факторов оксидантной системы, в гранулах нейтрофилов содержатся лизоцим, лактоферрин, катионные белки, щелочная и кислая фосфатазы, рибонуклеаза, дезоксирибонуклеаза, гиалуронидаза, b-глюкуронидаза, эластаза, коллагеназа, ФАТ, кинины, лейкоцитарный пироген, хемотаксические факторы.
Таким образом, накопление нейтрофилов в очаге воспаления и освобождение ими указанных биологически активных веществ вызывают гибель или ограничение жизнедеятельности микроорганизмов, разрушение и лизис омертвевших тканей, очищение зоны повреждения [57]. За счет нейтрофилов вокруг очага воспаления формируется нейтрофильный защитный барьер, который отграничивает зону повреждения (совместно с моноцитарным и фибробластическим) от здоровой ткани и препятствует распространению инфекции и токсических повреждающих факторов.
Высокоактивные медиаторы нейтрофилов участвуют в развитии вторичной альтерации, стимулируют выход биологически активных веществ из других клеток, способствуют расширению сосудов, увеличению их проницаемости, экссудации плазмы и эмиграции лейкоцитов. Поступая в системный кровоток, они вызывают проявление некоторых системных эффектов воспалительного процесса.
Эмигрировавшие в зону воспаления эозинофилы также обладают способностью фагоцитировать бактерии, грибы, иммунные комплексы. Они содержат примерно такой же набор ферментов, как и нейтрофилы (кроме лизоцима). Однако в фагоцитозе участвует меньший процент эозинофилов, и он протекает менее интенсивно, чем у нейтрофилов.
В очаге воспаления эозинофилы выполняют две основные функции: они становятся модуляторами реакций гиперчувствительности и главным механизмом защиты от личиночных стадий паразитарных инфекций.
Основными факторами, стимулирующими процесс дегрануляции эозинофилов, являются иммуноглобулины, иммунные комплексы, комплемент. Продукты секреции эозинофилов ингибируют выделение лаброцитами гистамина и участвуют в его инактивации за счет гистаминазы, эозинофильный катионный протеин связывает и нейтрализует гепарин, высокие концентрации арилсульфатазы инактивируют хемотаксические белки и медленно реагирующую субстанцию анафилаксии, фосфолипазы В и D инактивируют тромбоцитактивирующий фактор. Под влиянием эндотоксинов и в процессе фагоцитоза эозинофилы продуцируют и выделяют эндогенный пироген, обеспечивающий развитие лихорадочной реакции, сопровождающей воспалительный процесс.
Медиаторы эозинофилов, так же как и нейтрофилов, могут участвовать в реакциях повреждения ткани и распространении вторичной альтерации.
Базофильные лейкоциты, как и другие гранулоциты, обладают способностью к фагоцитозу, но их фагоцитарная активность довольно низка. В зоне инфекционного и аллергического воспаления возникает реакция дегрануляции базофилов с выделением медиаторов воспаления - гистамина, гепарина, фактора активации тромбоцитов, лейкотриенов, калликреина, эозинофильного хемотаксического фактора, ферментов.
При наличии этиологического агента в виде бактериального возбудителя моноциты/макрофаги являются антигенпрезентирующими клетками, обеспечивающими запуск иммунного ответа организма. В процессе представления антигена активированные макрофаги секретируют и освобождают такие цитокины, как ФНО, интерлейкины (ИЛ-1, ИЛ-3, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-12, ИЛ-15), компоненты комплемента, хемотаксические факторы [44]. Выделение зрелых форм интерлейкинов из клеток начинается уже через 2 часа после антигенной стимуляции и продолжается в течение 24-48 часов. Моноциты/макрофаги в зоне воспаления являются источником лизосомальных протеаз - коллагеназы, эластазы, ангиотензин конвертазы, активатора плазминогена; адгезивных веществ - фибронектина, тромбоспондина, протеогликанов; факторов роста - колониестимулирующих факторов, фактора роста фибробластов; эндогенных пирогенов.
Под действием пусковых медиаторов макрофагов в очаге воспаления происходит активация различных типов лейкоцитов, клеток соединительной ткани, эндотелия сосудов, паренхиматозных клеток, что приводит к синтезу и секреции биологически активных соединений, оказывающих повреждающие, защитные и системные эффекты.
Интенсивная эмиграция лимфоцитов в зону воспаления в большинстве случаев осуществляется после эмиграции нейтрофилов и моноцитов. Стимулированные лимфоциты выделяют биологически активные вещества - лимфокины, обеспечивающие развитие иммунного ответа, аллергических реакций, процессов пролиферации и репарации.
Все лейкоциты в зоне воспаления довольно быстро подвергаются жировой дегенерации, превращаются в гнойные тельца и удаляются вместе с гноем. В очаге воспаления возможны два пути гибели лейкоцитов.
Первый - грубое повреждение мембраны, нарушение целостности клетки и ее некроз, что возможно в очаге первичной и вторичной альтерации под влиянием самого повреждающего агента и различных цитотоксических медиаторов воспаления.
Второй - более мягкий, запрограммированный путь клеточной гибели, или апоптоз. При апоптозе наблюдаются уменьшение ядра лейкоцита, конденсация ядерного хроматина, фрагментация ДНК, подавление транскрипции, снижение синтеза рибосомной РНК и белков. Стареющие нейтрофилы теряют способность секретировать лизосомальные ферменты, и это исключает дальнейшее повреждение ткани. Макрофаги активно фагоцитируют апоптозные нейтрофилы. Поглощение апоптозных нейтрофилов обеспечивается взаимодействием тромбоспондина, секретируемого макрофагом и рецепторами нейтрофила [62, 67]. Путем апоптоза могут удаляться из очага воспаления не только нейтрофилы, но и эозинофилы и лимфоциты.
Иммунитет (лат. immunitas – освобождение, избавление от чего-либо) – невосприимчивость, сопротивляемость организма к инфекциямиинвазиямчужеродных организмов (в том числе – болезнетворныхмикроорганизмов), а также воздействию чужеродных веществ, обладающихантигеннымисвойствами.
Отличия туберкулезного иммунитета - инфицирование МБТ не всегда сопровождается развитием заболевания, что свидетельствует о наличии естественной стойкости к туберкулёзу. Естественная резистентность основывается на способности организма ликвидировать возбудитель заболевания и предотвратить болезнь. Доказательством наличия естественной резистентности у человека являются секционные данные, которые свидетельствуют о почти 100% инфицированности взрослого населения, но заболевшие составляют всего доли процента. Это свидетельствует о том, что организм человека восприимчивый к туберкулезной инфекции, но в то же время сравнительно устойчив.
Защита организма реализуется, прежде всего, в основных кооперативных механизмах неспецифического звена противоинфекционной и адаптивной реакции иммунной системы. Действие факторов врожденного иммунитета не зависит от антигенной специфичности чужеродного агента и реализуется за счет защитной функции барьерных тканей, активности системы комплемента, фагоцитов, сывороточных протеаз и биологически активных белковых систем (свертывающая, фибринолитическая), естественных киллеров, не обладающих антигеной специфичностью, продукции интерферонов (IFN). В механизме естественной резистентности особая роль отводится фагоцитозу. При первичном попадании МБТ в организм происходит их контакт с макрофагами и МБТ подвергаются фагоцитозу.
Результаты фагоцитоза
Завершенный фагоцитоз - уничтожается макрофагами Антибактериальная активность макрофагов зависит от состояния макроорганизма, вирулентности МБТ.
Симбиоз макрофагов и МБТ (в большинстве случаев).
Корд-фактор МБТ дисфункционирует лизосомы макрофагов, способствуя внутриклеточному расположению МБТ и распространению (диссеминации) их в организме.
Незавершенный фагоцитоз.
МБТ разрушают макрофаги и подвергаются повторному фагоцитированию.
Исход первичного инфицирования зависят от способности организма активировать макрофаги и создавать условия для завершенного фагоцитоза. В активации макрофагов и повышении устойчивости организма к действию МБТ ведущая роль принадлежит приобретенному клеточному иммунитету. В основе приобретенного клеточного иммунитета лежит эффективное взаимодействие макрофагов и лимфоцитов (рис. 7). Особое значение приобретает контакт макрофагов с Т-хелперами (CD4+) и Т-супрессорами (CD8+). Макрофаги, поглотившие МБТ, экспрессируют на своей поверхности антигены микобактериальных клеток в виде пептидов (рис. 1). Они также выделяют в межклеточное пространство медиаторы, в частности интерлейкин-1 (ИЛ-1), которые активируют Т-лимфоциты (CD4+). В этих условиях Т-хелперы (CD4+) взаимодействуют с макрофагами и воспринимают информацию о генетической структуре возбудителя. Сенсибилизированные Т-лимфоциты (CD4+; CD8+) выделяют медиаторы-лимфокины — хематаксины, гамма-интерферон, интерлейкин-2 (ИЛ-2), которые активируют миграцию макрофагов в зону расположения МБТ, повышают ферментативную и общую бактерицидную активность макрофагов. Активированные макрофаги способны усиленно генерировать весьма агрессивные формы кислорода и перекись водорода, что сопровождается так называемым кислородным взрывом, воздействующим на фагоцитируемый возбудитель туберкулеза.
Одновременно с участием L-аргинина и фактора некроза опухоли-альфа (ФНО-а) образуется оксид азота (N0), который также обусловливает выраженный антимикобактериальный эффект. Под влиянием всех этих факторов способность микобактерий препятствовать образованию фаголизосомы значительно ослабевает. Завершающая стадия фагоцитоза, направленная на переваривание возбудителя, протекает благополучно, и МБТ подвергаются разрушающему действию лизосомальных ферментов.
Схема противотуберкулезного иммунитета

Рис. 7 . Примечание: КПЛ – клетка Пирогова–Лангханса, ЭПК – эпителиоидная клетка, ЛФ – лимфоцит, МОН – моноцит, МФ – макрофаг, ФБ – фибробласт, НФ – нейтрофил, IL-интерлейкин, NK – естественный киллеры, IFN – интерферон, TNF- α – фактор некроза опухолей α
При адекватном развитии иммунного ответа каждое последующее поколение макрофагов, вступающее во взаимодействие с туберкулезным возбудителем, становится все более иммунокомпетентным. Высокий бактерицидный потенциал активированных макрофагов обеспечивает возможность разрушения поглощенных МБТ и защиту человека от возбудителя туберкулеза. Выделяемые макрофагами медиаторы активируют и В-лимфоциты, ответственные за синтез иммуноглобулинов. Однако накопление в крови имуноглобулинов практически не повышает устойчивость организма к МБТ. Полезным можно считать лишь образование опсонизирующих антител, которые формируются к полисахаридным компонентам МБТ. Они обволакивают микобактерии и способствуют их склеиванию, облегчая последующий фагоцитоз.
При первичном инфицировании МБТ становление иммунитета происходит одновременно с медленным размножением микобактерий и развитием локальных воспалительных изменений. Повышение ферментативной активности макрофагов и лимфоцитов приводит к дополнительному синтезу веществ, инициирующих повышение сосудистой проницаемости и развитие воспалительной реакции. Такими веществами являются фактор роста, фактор переноса, кожно-реактивный фактор, ФНО-а, оксид азота. С их действием связывают появление у клеток повышенной чувствительности замедленного типа (ПЧЗТ) к антигенам МБТ. В месте локализации туберкулезного возбудителя возникает специфическая клеточная реакция, способная ограничить распространение микобактерий. Под воздействием медиаторов иммунного ответа фагоцитирующие и иммунокомпетентные клетки устремляются к месту локализации микобактерий. Макрофаги трансформируются в эпителиоидные клетки и гигантские многоядерные клетки Пирогова—Лангханса, участвующие в ограничении зоны воспаления. Образуется экссудативно-продуктивная или продуктивная туберкулезная гранулема, которая по сути является морфологическим проявлением иммунной реакции организма на микобактериальную агрессию. Формирование гранулемы свидетельствует о высокой иммунологической активности и способности организма локализовать туберкулезную инфекцию. Компактное расположение клеток гранулемы обеспечивает лучшие условия для взаимодействия фагоцитирующих и иммунокомпетентных клеток. На высоте гранулематозной реакции в гранулемах преобладают Т-лимфоциты, присутствуют и В-лимфоциты. В гранулеме находится множество макрофагов, которые продолжают выполнять фагоцитарную, аффекторную и эффекторную функции в иммунном ответе. Эпителиоидные клетки менее способны к фагоцитозу, они активно осуществляют пиноцитоз и синтез гидролитических ферментов. В центре гранулемы может появиться небольшой участок казеозного некроза, который формируются из тел макрофагов, погибших при контакте с МБТ. Реакция ПЧЗТ появляется через 2—3 недель после инфицирования, а достаточно выраженный клеточный иммунитет формируется через 8 недель.
Иммунитет — специфическая реактивность, способ защиты организма от живых тел и веществ, несущих признаки генетической чужеродности; способность высших организмов распознавать, обезвреживать и элиминировать генетически чужеродные вещества; функция специализированной системы генетического наблюдения организма — иммунной системы (Р. В. Петров).
Иммунитет при туберкулезе существенно отличается от иммунитета при других инфекциях. Инфицирования микобактериями туберкулеза не всегда сопровождается развитием заболевания, свидетельствует о наличии естественной устойчивости к ним (естественный иммунитет). Она основывается на способности организма ликвидировать возбудителя заболевания и предотвратить болезни. Природный противотуберкулезный иммунитет неодинаково выражен у разных видов животных. Среди млекопитающих слабую резистентность имеют морские свинки, кролики, обезьяны; относительно устойчивые белые мыши, человек; всего устойчивые крысы и собаки.
Следствие инфицирования МБТ у животных с относительной естественной устойчивостью зависит от многих факторов: дозы и вирулентности МБТ, пути их проникновения, а главное — от степени резистентности. Доказательством наличия естественной резистентности у человека есть секционные данные, свидетельствующие о почти 100%-ную инфицированность МБТ взрослого населения, но известно, что заболевшие составляют всего доли процента. Это свидетельствует о том, что организм человека восприимчив к туберкулезной инфекции, но, в то же время, сравнительно устойчив. Существует естественная резистентность многих тканей организма человека к туберкулезной инфекции. Это подтверждается тем, что в ранний период инфицирования происходит генерализация МБТ по всему организму, однако первичное туберкулезное очаг развивается преимущественно в легких.

В основе естественной резистентности лежат неиммунологические феномены: защитное действие неповрежденной кожи и слизистых оболочек, физико-химические особенности тканей, антимикробные гуморальные факторы (лизоцим, плазмин, (3-лизин и др.). В механизме естественной резистентности особая роль отводится фагоцитирующим клеткам, особенно макрофагам. Для туберкулеза характерно внутриклеточное паразитирование возбудителя, но взаимодействие МБТ и макрофагов не всегда заканчивается разрушением микроба.
Роль макрофагов
Установлено, что в условиях макроорганизма только около 5% МБТ уничтожаются макрофагами, другие разрушаются частично или распространяются в организме макрофагами. Эта неспособность фагоцитоза способствует привлечению в процессе иммунизации большого количества лимфоидных клеток, но с другой стороны ведет к диссеминации МБТ. Следует отметить и тот факт, что МБТ могут разрушить макрофаги и затем подвергнуться повторному фагоцитированию. Макрофаги, сливаясь друг с другом, образуют гигантские клетки Пирогова-Лангханса, что является проявлением защиты организма против МБТ.
Итак, фагоцитоз является эффективным фактором противотуберкулезной защиты. Фагоцитарная активность неоднозначная у животных с разной природной устойчивостью: у резистентных лиц происходит более выраженное угнетение размножения МБТ, чем у чувствительных видов. Неспецифические по своей сути фагоцитарные клетки осуществляют и специфические функции: захватывают и переносят антиген к иммунокомпетентным клеткам и органам.
В ответ на вторжение МБТ в организме развиваются и специфические иммунологические изменения, определяющие приобретенный противотуберкулезный иммунитет. Доказательством развития иммунитета является эффективность применения вакцины БЦЖ, предложенной Кальмет и Гереном. Исследованиями многочисленных авторов доказано, что массовая вакцинация резко уменьшила заболеваемость туберкулезом. Приобретенный иммунитет возникает не только в результате вакцинации, но и в результате естественного инфицирования. Продолжается поствакцинальный иммунитет 5-6 лет. В механизме приобретенного иммунитета играют роль три основных феномена: повышенная чувствительность замедленного типа (ПЧСТ), антителообразования и фагоцитоз.
Повышенная чувствительность замедленного типа рассматривается большинством исследователей как основное звено в механизме противотуберкулезного иммунитета. ПЧСТ или туберкулиновая аллергия — классический пример инфекционной аллергии. Она заключается в повышенной чувствительности организма к повторному введению МБТ или продуктов их жизнедеятельности (туберкулин). ПЧСТ развивается не сразу после вакцинации или инфицирования, а через определенный период инкубации (аллергический период), продолжительность которого может колебаться от нескольких дней до нескольких месяцев и зависит от вида животных, способа заражения, дозы и вирулентности МБТ. У человека этот период составляет в среднем 2-3 месяца.
Аллергия при туберкулезе
Сущность аллергии при туберкулезе давно интересует исследователей. Еще в 1891 году Р. Кох описал отличие реакций организма на первичное и повторное проникновение микобактерий туберкулеза. Это различие стала основой классического феномена Коха. Сущность феномена: у здоровых морских свинок подкожное введение МБТ вызывает местную воспалительную реакцию, которая сопровождается генерализацией инфекции; у инфицированных животных повторное введение МБТ уже через несколько часов вызывает местное воспаление, быструю язву, заживает через несколько дней. Ткани инфицированного животного создают своеобразный барьер, который защищает организм. Эта барьерно-фиксирующая способность тканей инфицированного организма является проявлением аллергии, защищающий организм от повторного проникновения МБТ.
Следствие реакции зависит от степени повышенной чувствительности, которая определяется как дозой первичного инфекта, так и продолжительностью периода между первичным и повторным инфицированием. Имеет значение и количество МБТ при повторном инфицировании.
ПЧСТ при туберкулезе — тимус зависимый иммунологический феномен, который является специфическим. Главными клетками-эффекторами ПЧСТ являются Т-лимфоциты, кооперируются с В-клетками и макрофагами. Доказательством роли Т-лимфоцитов в реализации устойчивости к МБТ есть возможность пассивного переноса ПЧСТ от сенсибилизированных животных интактным. Считают, что развитие иммунитета при туберкулезе соединенный с функцией Т-хелперов 1-го типа и синтезом определенного профиля цитокинов — интерлейкин-2 (ИЛ), интерферон-у, ИЛ-12. Это определяет главную роль в иммунитете ПЧСТ. Однако нельзя отрицать и роли Т-хелперов 2-го типа, синтезирующих другие цитокины (ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-10, ИЛ-13) и усиливают антителообразования (синтез специфических антител). Эти типы иммунного ответа находятся во взаимной конкуренции, но не исключено их совместное участие в реализации специфического ответа на МБТ.
Выявление ПЧСТ возможно при проведении внутрикожной туберкулиновой пробы Манту. Она и сейчас не утратила своего диагностического значения, особенно для выявления поствакцинальных аллергии и виража, однако в настоящее время появились новые методы выявления ПЧСТ, основанные на определении реакции имунокомпетентных клеток на туберкулин: реакция бластной трансформации лимфоцитов (РБТЛ), ингибирования миграции лейкоцитов (НМЛ), цитотоксический эффект сенсибилизированных лимфоцитов на клетки-мишени (ЦТЛ).
Реакции, отражающие интенсивность ПЧСТ, наиболее выраженные на высоте вакцинного иммунитета как в эксперименте, так и у вакцинированных БЦЖ людей. ПЧСТ может быть подавлена применением препаратов, действующих на Т-лимфоциты. Преднизолон, имуран и другие приводят к резкому угнетению ПЧСТ и в свою очередь к ослаблению противотуберкулезного иммунитета и прогрессирования туберкулезной инфекции.
Гуморальные реакции. Также развиваются в организме человека в результате инфицирования МБТ.
Широкий спектр противотуберкулезных антител обусловлен сложностью антигенной структуры МБТ. При этом следует отметить низкий уровень антител при туберкулезе, несмотря на выраженные антигенные свойства МБТ. Считают, что ПЧСТ индуцируется белковыми компонентами, а антителообразования — как белковыми, так и липополисахаридный фракциями. Это является причиной разнообразия специфических противотуберкулезных антител. До сих пор не определена сущность антителообразования в механизме противотуберкулезной устойчивости. Четко установлено, что антителам не свойственный защитный эффект, то есть предварительное введение их здоровому животному не предотвращает развития туберкулезной инфекции.
Установлено, что специфические противотуберкулезные антитела способны усиливать фагоцитоз. Таким образом, преимущественно клеточный характер противотуберкулезного иммунитета дополняется гуморальным звеном, которая определяет кооперацию Т-, В-лимфоцитов и фагоцитирующих клеток.
Высокий уровень антител, который имеет место при хронических формах туберкулеза, может неблагоприятно влиять на течение туберкулезного процесса. Кроме того, доказано, что антитела участвуют в комплексообразовании, высокий уровень которого нарушает трофику тканей и способствует их некротизуванию. Существует зависимость частоты выявления антител в продолжительности туберкулезного процесса. Антитела определяются чаще всего у больных с фиброзно-кавернозной формой процесса, и значительно реже — у лиц с "малыми" формами. На основании этих данных можно сделать вывод, что антитела при туберкулезе свидетельствуют о продолжительности антигенного воздействия.
Фагоцитоз
В противотуберкулезной защите очень велика роль фагоцитов, особенно макрофагов, тесно взаимодействуют с лимфоцитами. Сенсибилизированные лимфоциты осуществляют специфическое влияние на макрофаги с помощью синтезируемых ими цитокинов, благодаря чему макрофаги и другие фагоцитирные клетки привлекаются в очаг повторного вторжения МБТ, усиливается их способность к перевариванию гиоглиненю МБТ, подавляется рост МБТ в очаге воспаления. Этот эффект лимфоцитов специфический.
В свою очередь контакт фагоцитирующих клеток с МБТ сопровождается синтезом цитокинов (провоспалительного, противовоспалительного действия), которые обеспечивают клеточную взаимодействие при развитии реакций противотуберкулезного иммунитета. В макрофагах резко усиливаются метаболические процессы, ферментативная активность (гидролазы, протеазы, фосфолипазы и др.). Макрофаги неоднородны по своей значимости. Некоторые осуществляют активный фагоцитоз или выполняют синтетическую функцию, обеспечивающую межклеточное взаимодействие. Существенная роль уделяется их способности к выводу иммунных комплексов из организма.
Результат взаимодействия между МБТ и макрофагами зависит от функционального состояния последних, а именно от их способности синтезировать гидролитические ферменты, цитокины, метаболиты кислорода. Угнетение фагоцитарной и секреторной способности макрофагов, еще может иметь место при иммунодефицитных состояниях различного генеза (облучение, интоксикация, иммуносупрессивная терапия и т.д.), способствует персистенции МБТ.
Клетки эндотелия кровеносных сосудов
В развитии иммунного ответа на МБ1 участвуют и клетки эндотелия кровеносных сосудов, выделяют биологически активные вещества: адгезивные молекулы, различные цитокины факторы роста. Они обеспечивают взаимодействие эндотелия с другими клеточными элементами (Т-лимфоциты, макрофаги, нейтрофилоциты, тромбоциты). В последние годы клеткам эндотелия отводится существенная роль как в реализации защитных реакций, так и в иммунопатологических процессах.
Состояние, возникающее после вакцинации БЦЖ или после первичного инфицирования, не определяет абсолютной устойчивости против МБТ. Интенсивность противотуберкулезной защиты зависит как от характера антигенного воздействия (вид возбудителя, вирулентность, массивность) так и от состояния макроорганизма, в первую очередь от состояния иммунной системы (наличия врожденного иммунодефицита), а также факторов, которые могут вызвать вторичную ее дефектность: облучение, употребление имуноденресантов, интоксикация. Играют роль другие факторы: состояние нервной, эндокринной систем, характер обменных процессов и др.
Долгое время считалось, что иммунитет при туберкулезе носит "нестерильный" характер. Это основывалось на том, что для поддержания иммунитета необходимо обязательные наличие в организме МБТ или их субстанций. Однако исследования многих авторов к вели, что для поддержания иммунитета наличие живых микроорганизмов не нужно.
Иммунологическая память
Это сохранение антигенных детерминант на клеточных элементах крови и в сыворотке крови (М. М. Авербах). В механизме поддержки иммунитета этот феномен играет большую роль.
Серьезной проблемой фтизиатрии является широкое инфицирование практически здорового населения; большинство лиц туберкулинпозитивные, что свидетельствует о наличии персистирующей туберкулезной инфекции. Очень важное значение имеет выявление среди них групп риска, в которых возможно развитие заболевания. Нужны критерии определения активации старых очагов, в которых могут храниться МБТ в той или иной форме.
Многие авторы связывают заболевания туберкулезом и реактивации туберкулезной инфекции со снижением естественной сопротивляемости и приобретенного противотуберкулезного иммунитета. В клинике нет возможности оценить состояние иммунной системы к заболеванию, поэтому нельзя с полной достоверностью совместить развитие патологии с начальными нарушениями иммунной системы.
Однако известно, что более высокая заболеваемость туберкулезом встречается у больных диабетом, у переболевших корью, у ВИЧ-инфицированных, то есть у лиц с нарушениями в иммунной системе. Проблема иммунодефицита актуальна также потому, что значительно увеличивается число больных туберкулезом среди лиц, злоупотребляющих наркотиками.
Различная степень естественной устойчивости к туберкулезной инфекции различных видов животных и человека связана с генетическими факторами, определяющими разную склонность к заболеваемости разных людей. Выполнено достаточно много исследований, доказавших ассоциации генов НLА-системы с устойчивостью к туберкулезу. Показано, что неблагоприятное течение туберкулезного процесса чаще встречается у лиц с БК-2 антигенами, благоприятный — с ОК.-3. Гены НLА-комплекса I и II классов являются важными факторами, определяющими патогенез туберкулеза, контролируя устойчивость и восприимчивость к туберкулезной инфекции.
Читайте также:

