Впч тип 18 у женщин при вич
Обновлено: 13.05.2024
ЦНИИ эпидемиологии Роспотребнадзора
Республиканский Центр по борьбе со СПИД, Баку, Республика Азербайджан
Республиканский Центр по борьбе со СПИД, Баку, Республика Азербайджан
Научно-исследовательский институт легочных заболеваний, Баку, Республика Азербайджан
Республиканский центр по профилактике СПИДа, Ереван, Республика Армения
Республиканский центр по профилактике СПИДа, Ереван, Республика Армения
Республиканский центр по профилактике СПИДа, Ереван, Республика Армения
Республиканский центр по профилактике СПИДа, Ереван, Республика Армения
Кафедра патологической анатомии
Республиканский центр по профилактике и борьбе со СПИДом, Душанбе, Республика Таджикистан
Министерство здравоохранения и социальной защиты населения, Душанбе, Республика Таджикистан
Академия медицинских наук при Министерстве здравоохранения и социальной защиты населения, Душанбе, Республика Таджикистан
Вирус папилломы человека высокого канцерогенного риска у ВИЧ-инфицированных женщин в странах Восточной Европы и Центральной Азии
В странах Восточной Европы и Центральной Азии наблюдается рост доли женщин репродуктивного возраста среди пациентов с ВИЧ-инфекцией. Гинекологическое здоровье ВИЧ-инфицированной женщины и сохранение возможности рождения у нее здорового ребенка являются приоритетными направлениями в мероприятиях ВОЗ. ВИЧ-инфицированные женщины имеют более высокий риск папилломавирусой инфекции, чем ВИЧ-негативные, а также более высокий риск персистенции и малигнизации. Нами предпринята попытка изучить распространенность вируса папилломы человека (ВПЧ) среди ВИЧ-инфицированных женщин в странах Восточной Европы и Центральной Азии. Выявлено, что у ВИЧ-инфицированных женщин данного региона высока частота ВПЧ-инфекции и широк спектр выявляемых генотипов ВПЧ высокого онкогенного риска. Структура выявленных генотипов ВПЧ в республиках отличалась. Полученные данные необходимо учитывать при цервикальном скрининге у данной категории пациенток (например, проводить ВПЧ-тест при постановке на учет в центр СПИД всем ВИЧ-инфицированным женщинам вне зависимости от возраста с использованием ВПЧ-теста с определением не менее 14 высокоонкогенных генотипов ВПЧ). Необходимо искать пути решения данной проблемы путем консультирования ВИЧ-инфицированных женщин и их партнеров, образовательных семинаров о необходимости скрининга на ВПЧ как среди ВИЧ-инфицированных женщин, так и в общей популяции.
ЦНИИ эпидемиологии Роспотребнадзора
Республиканский Центр по борьбе со СПИД, Баку, Республика Азербайджан
Республиканский Центр по борьбе со СПИД, Баку, Республика Азербайджан
Научно-исследовательский институт легочных заболеваний, Баку, Республика Азербайджан
Республиканский центр по профилактике СПИДа, Ереван, Республика Армения
Республиканский центр по профилактике СПИДа, Ереван, Республика Армения
Республиканский центр по профилактике СПИДа, Ереван, Республика Армения
Республиканский центр по профилактике СПИДа, Ереван, Республика Армения
Кафедра патологической анатомии
Республиканский центр по профилактике и борьбе со СПИДом, Душанбе, Республика Таджикистан
Министерство здравоохранения и социальной защиты населения, Душанбе, Республика Таджикистан
Академия медицинских наук при Министерстве здравоохранения и социальной защиты населения, Душанбе, Республика Таджикистан
Эпидемия ВИЧ-инфекции в странах Восточной Европы и Центральной Азии продолжает стремительно развиваться. Последнее десятилетие эпидемия характеризуется увеличением числа случаев передачи вируса при гетеросексуальных контактах, что приводит к росту доли женщин среди ВИЧ-позитивных лиц. Наличие инфекций, передаваемых половым путем (ИППП), в частности вируса папилломы человека (ВПЧ), значительно повышает вероятность заражения ВИЧ. Поэтому выявление и лечение ИППП являются приоритетами в снижении распространенности ВИЧ-инфекции. С другой стороны, наличие ВИЧ повышает риск инфицирования урогенитальными инфекциями. Например, женщины с ВИЧ имеют более высокий риск обнаружения папилломавирусной инфекции (ПВИ), персистенции вируса и развития цервикальной патологии, чем ВИЧ-негативные женщины [1—10].
Расширение спектра антиретровирусных препаратов и применение средств комбинированной фармакотерапии привели к существенному увеличению сроков и качества жизни ВИЧ-инфицированных. На фоне значительного снижения частоты ряда оппортунистических инфекций возросла роль рака шейки матки (РШМ), способного повлиять на долгосрочное течение ВИЧ-инфекции у женщин. Это не только представляет серьезную проблему для медицины, но и имеет важное социально-экономическое значение.
Таким образом, имеющиеся в литературе данные свидетельствуют о взаимном влиянии ВИЧ-инфекции и ВПЧ, ухудшающем прогноз и способствующем развитию онкологического процесса.
Цель исследования — изучить распространенность различных генотипов ВПЧ высокого канцерогенного риска (ВПЧ ВКР) у ВИЧ-инфицированных женщин в странах Восточной Европы и Центральной Азии.
Материал и методы
Статистические данные обрабатывали с использованием программного пакета Microsoft Excel (Windows XP) и SPSS16 (допустимая ошибка Е=5%). Были использованы показатели описательной статистики (средняя, медиана, стандартное отклонение, минимум, максимум). Для сравнения количественного показателя применяли t-критерий Стьюдента.
Результаты и обсуждение
Были обследованы 647 женщин с подтвержденной ВИЧ-инфекцией. Средний возраст пациенток составил 37,006±7,699 года (М±SD; минимальный возраст — 18 лет, максимальный — 67 лет), что подчеркивает значимость наносимого этим заболеванием социально-экономического ущерба, поскольку свидетельствует о распространенности инфекции среди женщин репродуктивного и работоспособного возраста.
В результате ВПЧ-тестирования у 265 (41%) из 647 ВИЧ-инфицированных женщин была выявлена ДНК ВПЧ ВКР. Распространенность ВПЧ-инфекции различалась в зависимости от страны происхождения: в Армении этот показатель составлял 39% (95% ДИ 29,4—49,3), в Азербайджане — 43% (95% ДИ 33,1—53,3), в Беларуси — 28% (95% ДИ 19,5—37,9), в Киргизии — 46,5% (95% ДИ 36,4—56,8), в Таджикистане — 37,8% (95% ДИ 28,2—48,1), в России (Самара) — 48% (95% ДИ 39,8—56,3). Аналогичные результаты по распространенности ВПЧ среди ВИЧ-инфицированных женщин были получены в исследовании E. Park и соавт. [6]. По данным анализа биологического материала 60 ВИЧ-позитивных и 1938 ВИЧ-негативных женщин, у ВИЧ-инфицированных чаще обнаруживали высокоонкогенные типы ВПЧ, чем у пациенток без ВИЧ (30 и 4,9% соответственно; р<0,001). В другом исследовании [11] у 32% из 178 ВИЧ-инфицированных женщин был выявлен ВПЧ ВКР. В исследовании на базе ФБУН ЦНИИ эпидемиологии при анализе биологического материала 155 ВИЧ-позитивных и 406 ВИЧ-негативных женщин выявили, что распространенность ВПЧ ВКР в группе ВИЧ-инфицированных женщин статистически выше, чем в группе ВИЧ-негативных (38,7 и 14,8% соответственно; р<0,01) [12].
Распределение по возрасту всех ВИЧ-инфицированных женщин и пациенток с ВИЧ и ВПЧ ВКР, принявших участие в исследовании, не выявило статистически значимых различий (t-критерий Стьюдента составил 1,972; f=910; α=0,05). Полученные данные подтверждают, что скрининг на РШМ у ВИЧ-инфицированных следует продолжать в течение всей жизни женщины [7].

Отличительной чертой ВПЧ-инфекции у ВИЧ-позитивных женщин из стран СНГ является высокая распространенность смешанной инфекции — т. е. инфицирование двумя или несколькими типами ВПЧ одновременно. По данным исследования, в 50% случаев ВПЧ-инфекция была представлена в виде микстинфекции несколькими типами (рис. 2). Рис. 2. Выявление микстов генотипов ВПЧ по результатам ВПЧ-теста.
По данным литературы, распространенность микстинфекции в странах дальнего зарубежья ниже и составляет порядка 10—22%. Так, F. Broccolo и соавт. [3], проанализировав 597 образцов эпителиального соскоба цервикального канала, зарегистрировали микстинфекцию ВПЧ в 22% патологических образцов от женщин с неизвестным ВИЧ-статусом. Микстинфекция высокоонкогенными типами ВПЧ, по данным E. Park и соавт. [6], выявляется в 10% у ВИЧ-инфицированных женщин и в 0,6% у ВИЧ-негативных.
В настоящий момент не представляется возможным объяснить такую высокую долю микст ВПЧ-инфекции у ВИЧ-инфицированных женщин в рамках проекта, но учитывая, что в исследовании на базе ФБУН ЦНИИ эпидемиологии у ВИЧ-инфицированных пациенток сочетание нескольких генотипов ВПЧ было зафиксировано в 48,3% случаев и микст состоял из 2—5 генотипов, можно предположить высокую распространенность микстов на территории России и стран СНГ [12].

Распространенность генотипов ВПЧ ВКР заметно различается в зависимости от страны происхождения (рис. 3). Рис. 3. ВПЧ ВКР у ВИЧ-инфицированных женщин по странам.
Так, в Армении чаще регистрировали генотипы ВПЧ 16 и 68, в Азербайджане — 16, 18, 31 и 56, в Республике Беларусь — 16 и 56, в Республике Киргизия — 16 и 31, в Республике Таджикистан — 16, 31 и 56, в Самаре — 52 и 16. Интересно, что в Азербайджане и Республике Беларусь не встречался 59-й генотип ВПЧ ВКР, а в республике Армения — 35-й. Полученные данные свидетельствуют о необходимости выявления всех 14 генотипов ВПЧ у женщин при постановке на учет после выявления ВИЧ-инфекции.
Выводы
Показана высокая распространенность ВПЧ ВКР среди ВИЧ-инфицированных женщин из разных стран Содружества, при этом соотношение генотипов значительно различается в разных регионах. Полученные данные необходимо учитывать при разработке методов скрининга и ведения женщин с ВИЧ-инфекцией на национальном уровне, в частности рекомендовать ВПЧ-тестирование с широким спектром выявляемых типов ВПЧ ВКР (не менее 14) при постановке на учет в центр СПИД всем ВИЧ-инфицированным женщинам вне зависимости от возраста.
Сведения об авторах
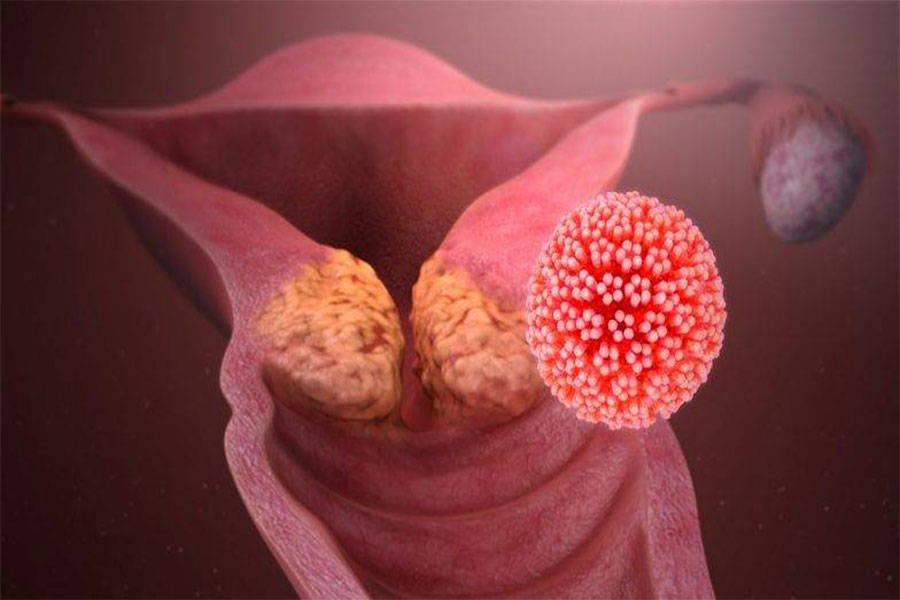
Вирус папилломы человека (ВПЧ) – масштабная по распространению вирусная инфекция.
Насчитывает более сотни типов.
Относится к группе инфекций, передаваемых половым путем (ИППП).
Выделяются 3 группы папилломавирусов:
- неонкогенные
- низкоонкогенные
- высокоонкогенные, из них 16 и 18 типы встречаются в 70%, тип 16 отмечается при онкологии в 41-54% вероятности

Основной способ передачи инфекции – сексуальный контакт.
Это обуславливает распространение среди жителей планеты, достигая цифры в 70%.
В процентном соотношении женское население более подвержено поражению вирусом.
Способы передачи:
- половая близость (вагинальный, оральный, анальный контакт, с проникновением и без)
- контактно-бытовой
- передача инфекции матерью ребенку при родах
Клиника ВПЧ
Поражение организма вирусом происходит на клеточном уровне.
В атакуемой клетке ПВЧ отмечается в двух формах:
- доброкачественная, вирус вне клеточной хромосомы человека
- злокачественная, ДНК вируса в геноме человеческой клетки, меняет его структуру, приводит к перерождению
При доброкачественном варианте человек не замечает болезни, чаще организм сам очищается от чужеродных вирусов.
Активация и переход к клиническим проявлениям наступает у ослабленных, и ВИЧ-инфицированных людей.
Симптомов, как правило, не наблюдается.
К клиническим проявлениям относят:
- Низкоонкогенные аногенитальные бородавки
- Респираторный рецидивирующий папилломатоз (РРП), редкая патология, папилломы локализуются в дыхательных путях (гортань, голосовые связки, носоглотка). Папилломатоз гортани характерен для младшего детского возраста, но бывает и у взрослых
- Онкологические патологии, вызванные папилломавирусом: рак шейки матки (РШМ), вульвы, вагины, ануса, полового члена, протекают долгое время без симптомов. При обнаружении проблемы преобладает симптоматика онкологии
Для РШМ на определенной стадии характерны вагинальные кровотечения между менструациями и после полового контакта. Боли в пояснице, ногах, в тазу, ухудшение состояния, потеря аппетита и веса. Раздражение во влагалище, выделения со специфическим запахом, отек одной ноги. С дальнейшим утяжелением проявлений.
Опасен ли ВПЧ при беременности
ВПЧ при беременности не приговор, инфекция не влияет на плод и течение беременности.
Настороженность вызывают штаммы вирусов, вызывающие рост генитальных бородавок 6, 11, и типы повышенной онкогенности 16 и 18.
Лечение в период беременности требуется не всегда.
Пристальное наблюдение за проблемой (цитология, кольпоскопия), при необходимости применяют иммуномодуляторы для повышения защитных свойств организма.
Хирургическое вмешательство показано крайне редко, при угрозе для здоровья ребенка удаляются онкогенные образования.
Последствия ВПЧ у мужчин
Мужчина бывает вирусоносителем без явных проявлений клиники, или имеет проявления, например остроконечные кондиломы.
Если кондиломы появились у женщины, у ее полового партнера берется соскоб эпителия с головки полового члена, исследуется материал из ануса.
В некоторых странах мужчин на ПВЧ не обследуют в плановом порядке.
Взрослые люди независимо от пола одинаково подвержены возникновению таких патологий, как рак и предрак анальной области с участием ВПЧ.
Эпителий ануса так же атакуется вирусом, как и шейка матки.
Анальный рак отмечается у мужчин в 40% случаев, частота заболеваний растет, в частности в группе риска.
Отслеживается связь анального рака и предрака с ВИЧ-инфицированием по причине снижения иммунитета, анальных половых связей.
ВИЧ-положительные пациенты показывают более высокий процент заболевания.
ВПЧ активируется раньше, инкубационный период меньше, чем у здоровых людей.
ВПЧ для ВИЧ-позитивных пациентов является оппортунистической инфекцией и требует особого внимания.
К ранней диагностике анального рака относят:
Цитологический скрининг у мужчин проводит дерматовенеролог раз в 6 месяцев, если нет клинических проявлений при подтвержденном ВПЧ.
Если есть кондиломы, их удаляют.
Онкология как последствия ВПЧ
Взаимосвязь рака шейки матки с папилломавирусом 16 типа обнаружил Нобелевский лауреат 2008 года Гарольд цур Хаузен.
Научно установлено присутствие онкогенных ПВЧ при РШМ в 100% случаев.
Все больше данных подтверждает присутствие вирусов 16 и 18 типов при диагностике рака ануса, гениталий.
Связь этих заболеваний с ВПЧ имеет оптимистичный характер в плане предотвращения болезни путем первичной профилактики.
Она разработана для сокращения онкологического поражения женщин РШМ.
Рак шейки матки забирает 52% жизней женщин, это высокий показатель смертности.
Из них 85% женщины, из стран с низким и средним уровнем жизни.
Тяжелые последствия ВПЧ
Папилломавирус сопровождает такие заболевания:
- Верруциформная эпидермодисплазия – редкая патология, вызываемая некоторыми штаммами вируса. Проявляется изменением структуры клеток эпидермиса с характерными высыпаниями на пораженных участках в виде плоских бородавочных элементов или пятен, покрытых чешуйками. Имеет генетическую предрасположенность по рецессивному типу. Дисплазия эпидермиса может перейти в рак кожи, чаще всего при участии штаммов вируса 5, 8, 47
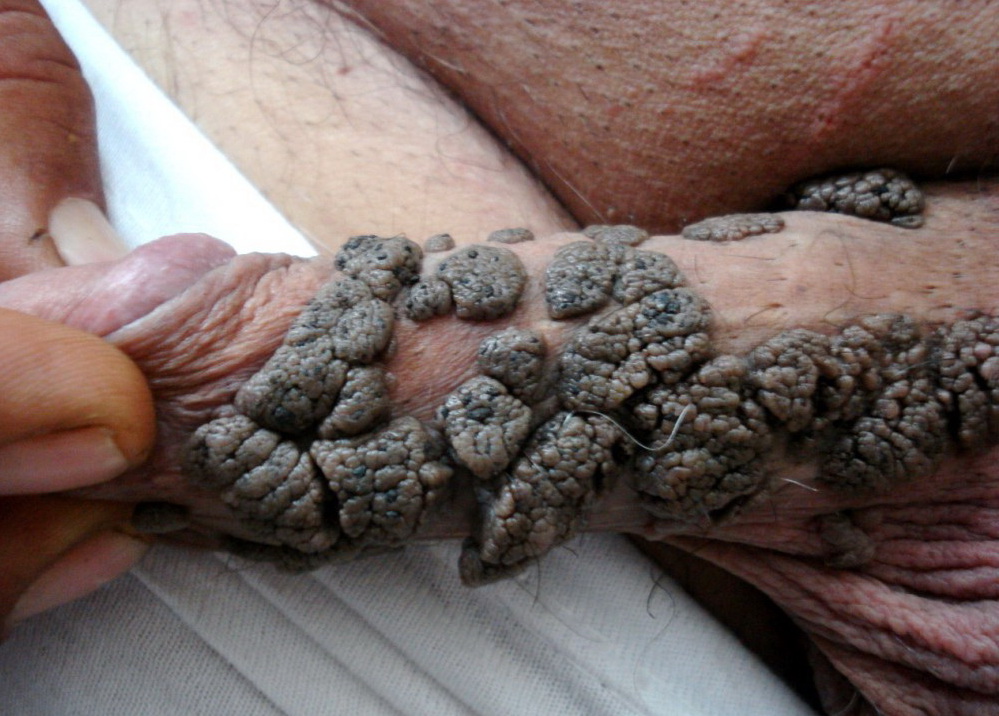
- Бовеноидный папулез (болезнь Боуэна) 16, 34, 35, 55 – редкая патология, протекает при участии 16 типа и сопутствующих типов, проявляется папулезным высыпанием в области мошонки, паха, полового члена, лобка, больших и малых половых губ. Папулы отдельные и слитые в бляшки до 2 см, с неоднородной поверхностью. Течение болезни затяжное, риск перерождения в онкологию 3%
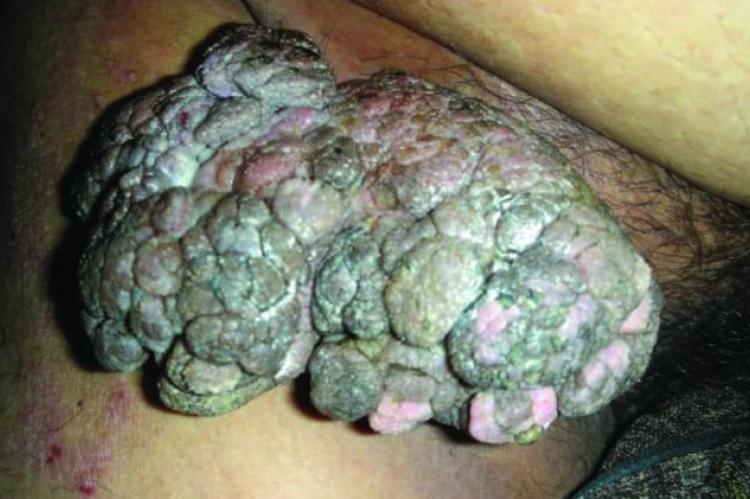
- Осложнения от папиллом и кондилом – редкое перерождение в злокачественные новообразования, при участии высокоонкогенных штаммов, чему способствует постоянное механическое повреждение, ослабленный иммунитет – чаще у мужчин, локализация половые органы, область ануса. Из узелков, растущих вширь и вглубь, образуется широкое основание, образование склонно к изъязвлению и деструкции, к рецидиву, относится к предраку. Необходимо глубокое хирургическое иссечение
Диагностика ВПЧ

Современные методики обнаруживают вирус, определяют тип и потенциальную настороженность.
- Кольпоскопия – осмотр с использованием кольпоскопа.
- Цитология – микроскопия мазка. В результатах: норма 1, 2 класс, 3 класс дополняется гистологией, 4, 5 класс обнаружение злокачественных клеток. В мазках койлоциты и дискератоциты, измененные клетки.
- Гистология биопатов – микроскопическое изучение измененных клеток в тканях.
- Антитела к вирусу – отслеживаются в крови до появления клинических проявлений. Ранняя диагностика, но не устанавливает точно тип и концентрацию ПВЧ.
- Амплификационный (Digene-тест) – точное обнаружение ВПЧ. С указанием типов, концентрации. Материал – соскоб со слизистой оболочки вагины или уретры.
- Неамплификационный (ПЦР) – применяется для онкогенных штаммов. Материал: мазки, кровь, моча, амниотическая жидкость. Обнаруживается ДНК вируса.
- Дерматоскопия – характеризует новообразование при помощи оптики.
- Онкомаркер S-100 используется при определенных формах рака (рак кожи, меланома); осуществляют контроль над прогрессом заболевания, ответом на терапию. Диагностическая ценность низкая.
Лечение ВПЧ
Лечения инфекции, вызванной ВПЧ, на сегодня нет.
Большинство людей даже не подозревают о наличии заболевания.
Некоторые штаммы вируса изгоняются организмом самостоятельно.
Другие не приносят явных проблем и клинических проявлений.
Лечение заключается в устранении проявлений заболевания.

Проводят удаление генитальных бородавок, дисплазии, хирургическим или химическим путем.
- выжигание электрокаутером или лазером
- замораживание жидким азотом
- хирургическое удаление (кюретаж, иссечение)
- лечение химическими препаратами
- противовирусная и иммуномоделирующая терапия
- при диагностике рака – хирургическое вмешательство, радиотерапия и химиотерапия
Лечение позволяет не перейти из фазы предрак в более тяжелую стадию, не дает инфекции прогрессировать.
Показывает положительные результаты лечения при раннем обнаружении.
Профилактика ВПЧ
Разработана эффективная первичная профилактика РШМ, широко применяемая во многих странах современного мира.
Скрининг – тестирование на предраковые состояния и рак у здоровых женщин.
Эффективность методов для понижения смертности в глобальных масштабах, при раннем выявлении заболевания высока, как и вероятность излечения.
Проводится в возрасте 30-49 лет, учитывая длительную инкубацию.
Виды скрининга:
- визуальный осмотр с применением уксусной кислоты
- тесты на штаммы высокого риска
- цитологический тест окрашивание по Папаниколау шеечных и анальных мазков (РAP), цитология жидкости (LBC)
В странах, где применение скрининговых программ и раннее лечение предотвращает возникновение РШМ до 80%, реально виден результат.
При позднем, симптоматическом выявлении заболевания, лечение малоэффективное.
Вакцинация против ВПЧ
Вакцина против ПВЧ на 2013 год применялась уже в 55 странах ВОЗ.
Вакцинация не отменяет применение скрининга на РШМ, а дополняет его.
Проведение вакцинации для профилактики онкологии от ВПЧ 16 и 18 типов эффективно до внедрения вируса в организм человека.
Вакцины не излечат инфекцию и онкологию, вызванную папилломавирусом, поэтому их применяют до начала половых контактов.
В некоторых странах вакцинируют мальчиков, для сокращения аногенитального рака, вирусоносительства.
Одна из вакцин гарантирует перекрестное воздействие на вирус вызывающий рост генитальных кондилом у обоих полов.
Девочек по рекомендации ВОЗ вакцинируют в 9-13 лет, для минимизации затрат здравоохранения на эффективную профилактику РШМ.
Математическое моделирование прогнозирует при полном курсе первичного вакцинирования девочек 12-13 лет (3 дозы):
- значительное снижение рисков заболеваемости РШМ – на 63%
- предрака на 51%
- цитологические нарушения у женщин до 30 лет снижаются на 27%
Рекомендованный возраст для вакцинации: мальчики и девочки 9 – 17 лет, девушки 18 – 26 лет.
Ведутся исследования для вакцинации людей старше 30 лет.
Вакцины от ВПЧ
Наличие вакцины означает возможность первичной профилактики РШМ и других онкологических заболеваний.
Вакцины успешно применяются и показывают эффективность профилактических мер в США, Франции, Германии и других странах.

Вакцинация трехкратная, проводится с первым интервалом в 2 месяца и вторым в 4 месяца.
Возможна укороченная схема с первым интервалом в месяц и вторым в 2 месяца.
В случае наступления беременности вакцинация переносится в послеродовой период.
Проведение профилактики в течение 12 месяцев считается успешной и законченной вакцинацией.
Однако, отношение к вакцинации остается неоднозначным.
Вакцинация снижает риски от определенных штаммов вируса 16 и 18, но РШМ начинают вызывать штаммы, ранее признанные неонкогенными.
Прививка женщин, имеющих сексуальные контакты, практически нерезультативна.
Есть опасения, что вакцинация подростков вызовет пренебрежение к другим способам защиты.
При появлении признаков ВПЧ обращайтесь к автору этой статьи – дерматовенерологу в Москве с многолетним опытом работы.
Инфекционная клиническая больница №2, Москва
Московский областной НИИ акушерства и гинекологии;
кафедра акушерства и гинекологии ФУВ МОНИКИ им. М.Ф. Владимирского
Кафедра акушерства, гинекологии, перинатологии и репродуктологии факультета последипломного профессионального обучения врачей Московской медицинской академии им. И.М. Сеченова;
Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова
Инфекционная клиническая больница №2, Москва
Особенности патологии шейки матки у больных c ВИЧ-инфекцией
Журнал: Российский вестник акушера-гинеколога. 2013;13(1): 17‑22
Гафуров Ю.Т., Краснопольская К.В., Назаренко Т.А., Сундуков А.В. Особенности патологии шейки матки у больных c ВИЧ-инфекцией. Российский вестник акушера-гинеколога. 2013;13(1):17‑22.
Gafurov IuT, Krasnopol'skaia KV, Nazarenko TA, Sundukov AV. The specific features of abnormalities of the cervix uteri in HIV-infected patients. Russian Bulletin of Obstetrician-Gynecologist. 2013;13(1):17‑22. (In Russ.).
Инфекционная клиническая больница №2, Москва
В обзоре отражены частота, особенности этиологии, патогенеза предраковых заболеваний и рака шейки матки у ВИЧ-инфицированных пациенток. Описаны методы обследования и лечения данной категории больных. Собраны разные мнения об эффективности стандартных методов терапии, приведены данные о положительной роли применения высокоактивной антиретровирусной терапии в комплексе лечебных мероприятий.
Инфекционная клиническая больница №2, Москва
Московский областной НИИ акушерства и гинекологии;
кафедра акушерства и гинекологии ФУВ МОНИКИ им. М.Ф. Владимирского
Кафедра акушерства, гинекологии, перинатологии и репродуктологии факультета последипломного профессионального обучения врачей Московской медицинской академии им. И.М. Сеченова;
Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова
Инфекционная клиническая больница №2, Москва
Рак шейки матки (РШМ) занимает второе место в структуре смертности от онкологических заболеваний у женщин [3]. Диагностика и лечение патологии шейки матки остается одной из актуальных проблем гинекологии и, несмотря на успехи современной медицины, уровень заболеваемости имеет устойчивый восходящий тренд. Этиологическим фактором в развитии дисплазии шейки матки признано поражение вирусом папилломы человека (ВПЧ), а длительная персистенция ВПЧ способствует возникновению рецидивов и/или злокачественной трансформации поражений [4]. Особую актуальность представляет проблема заболеваний шейки матки у больных, пораженных вирусом иммунодефицита человека (ВИЧ). Это обусловлено тем, что повреждения шейки матки ВПЧ развиваются на фоне дисфункции иммунитета с нарушением противовирусного ответа [2], а наблюдение и обследование больных ВИЧ-инфекцией могут помочь смоделировать развитие интраэпителиальных повреждений в условиях иммунодефицита и разработать методы профилактики и лечения.
Накопленные данные исследователей всего мира показывают, что ВИЧ-инфицированные женщины отличаются более высоким уровнем хронического поражения ВПЧ, многообразием типов онкогенных вирусов, более частыми патологическими изменениями мазков по Папаниколау, агрессивностью течения РШМ по сравнению с этими данными у ВИЧ-отрицательных пациенток [64]. Выявлена прямая зависимость между продолжительностью заражения ВИЧ-инфекцией и возникновением патологии шейки матки [41]. Несмотря на успехи применения высокоактивной антиретровирусной терапии (ВААРТ), уровень поражения РШМ у ВИЧ-инфицированных остается выше, чем в популяции [13]. Длительное применение ВААРТ продлевает жизнь ВИЧ-инфицированных пациенток, следовательно, растет удельный вес ВПЧ-индуцированных заболеваний у этой категории больных [64].
ВИЧ-инфекция повышает риск поражения наружных половых органов ВПЧ [66], способствует более раннему [17] и более частому [37, 43] развитию тяжелой формы дисплазии и РШМ. При этом, чем выше степень иммунносупрессии и ниже уровень клеток СD4+, тем чаще выявляются высокоонкогенные штаммы ВПЧ и интраэпителиальные заболевания шейки матки, вплоть до рака [6, 18, 24, 45, 63].
Повреждения шейки матки способствуют гетеросексуальной и перинатальной передаче ВИЧ-инфекции [74]. У юных беременных, перинатально зараженных ВИЧ-инфекцией, при обследовании во время беременности чаще, чем в популяции, выявляли патологию шейки матки методом Папаниколау [15].
Мониторинг больных с дисплазией шейки матки показал значимое прогрессирование процесса у ВИЧ-инфицированных больных по сравнению с его течением у здоровых женщин [59, 63]. При обследовании больных с дисплазией шейки матки II-III степени выявлено, что у ВИЧ-инфицированных снижены показатели местного иммунного ответа [5]. ВПЧ высокого онкогенного риска, выявленный методом полимеразной цепной реакции из отделяемого цервикального канала, низкий уровень СD4+ и высокая вирусная нагрузка, являются факторами, способствующими возникновению дисплазии шейки матки, интраэпителиальной неоплазии [30, 37, 50, 73]. Напротив, при уровне СД4+ более 500 клеток/мл частота диагностики внутриэпителиальных повреждений у больных с ВИЧ-инфекцией не отличается от таковой у здоровых пациенток [81].
Частота выявления ВПЧ-инфекции быстро возрастает в течение первых лет после сероконверсии ВИЧ, по всей видимости, вследствие иммунной дисфункции слизистой оболочки шейки матки, характерной для ВИЧ-инфекции [79]. Хотя ВПЧ-инфицирование связано с передачей половым путем, у 22% ВИЧ-инфицированных больных с уровнем СD4+ менее 200 клеток/мл, не живущих половой жизнью, выявляли, по крайней мере, один тип ВПЧ [75].
В образцах, полученных при биопсии шейки матки, с нормальным эпителием и особенно с цервикальной интраэпителиальной неоплазией (CIN) у ВИЧ-инфицированных больных значительно чаще выявляли маркеры апоптоза [78].
ВИЧ-инфекция запускает патогенез плоскоклеточного РШМ у ВПЧ-пораженных больных [8, 38]. Уровень заболеваемости РШМ у лиц с ВИЧ или СПИДом имел стойкую тенденцию к увеличению в США за период с 1980 по 2007 г. [72]. В некоторых странах Африки РШМ является причиной самой высокой смертности [54]. Этот факт объясняется большим количеством ВИЧ-инфицированных женщин и отсутствием возможности цитологического исследования шейки матки [20]. Замечено, что РШМ чаще поражает больных, заразившихся половым путем [28], причем количество больных РШМ растет вместе с ростом числа ВИЧ-инфицированных [62].
У ВИЧ-инфицированных спектр ВПЧ более многообразен, чем у ВИЧ-негативных больных [24]. ВИЧ-инфицированные больные, пораженные РШМ, в среднем на 13 лет моложе ВИЧ-негативных [61]. Одни авторы указывают, что ВПЧ 16-го типа выявлялся у больных с ВИЧ-инфекцией, повреждениями шейки матки высокой степени тяжести и РШМ значительно чаще, чем у женщин с нормальными цитологическими мазками [24, 30, 44, 70]. Другие получили противоположный результат - ВПЧ
В настоящее время обязательным является ежегодный осмотр пациентки, включающий цитологическое исследование (РАР-тест), кольпоскопию, типирование ВПЧ у ВИЧ-инфицированных больных [19, 46]. Часто ВИЧ-инфицированные пациентки не знают, что использование РАР-теста может помочь в предотвращении РШМ [65], поэтому цитологическое исследование шейки матки должно быть включено в стандарт оказания помощи ВИЧ-инфицированным больным [65, 73]. Обязательному цитологическому обследованию должны быть подвергнуты ВИЧ-инфицированные пациентки старше 30 лет, так как у них вероятность диагностики повреждений шейки матки высокой степени тяжести достигает более 70% [9], и пациентки с уровнем СD4+ менее 200 клеток/мл [31].
Помимо РАР-теста в настоящее время для скрининга применяют цитологическое исследование вагинальных смывов, типирование ВПЧ, методы прямой визуализации [42]. Тестирование ВПЧ может способствовать сокращению числа случаев прогрессирующего РШМ [71]. Цитологическое исследование вагинальных смывов может быть альтернативой РАР-тесту [36], но не имеет преимуществ перед тестом Папаниколау [76]. Использование количественной оценки уровня вирусной нагрузки ВПЧ как маркера повреждения шейки матки у ВИЧ-инфицированных пациенток [51] и уровня СD4+ может быть полезным в качестве индикатора риска прогрессирования процесса [63].
ВПЧ проявляет наибольшую активность при уровне СD4+ менее 200 клеток/мл и вирусной нагрузке более чем 100 000 копий/мл [31, 75]. Любой подозрительный участок должен быть подвергнут биопсии и гистологической экспертизе [27], так как у 14,3% ВИЧ-инфицированных с нормальной цитологической картиной шейки матки выявляли CIN [7]. Эта группа больных характеризовалась уровнем СD4+ менее 500 клеток/мкл и поражением ВПЧ. Биопсия шейки матки должна сочетаться с выскабливанием цервикального канала, так как при этом значительно чаще выявляется патология у серопозитивных женщин [16].
Чаще всего для лечения повреждения шейки матки используется петлевая эксцизия, так как данная процедура может быть выполнена амбулаторно, позволяет исключить инвазивную неоплазию, оценить края резекции, сохранить репродуктивную функцию, сопровождается минимальной кровопотерей и низким процентом послеоперационных осложнений [68]. Однако данное вмешательство у ВИЧ-инфицированных больных менее эффективно, чем у ВИЧ-негативных пациенток [9, 52]. Петлевая эксцизия, выполненная больным с HSIL, несмотря на свою эффективность в 15% случаев дает рецидив процесса [53]. Рецидивы CIN после конизации составляют от 20 до 75% [77]. Описаны случаи развития рака через 2 года после петлевой эксцизии, выполненной по поводу LSIL [36]. Одной из причин неудачи считается низкий иммунный статус: при уровне СD4+ меньше 200 клеток/мл и CIN II-III степени [56]. Напротив, при уровне СD4+ более 500 клеток/мл, 5-летний мониторинг после конизации или петлевой эксцизии, выполненной по поводу HSIL, не выявил различий в группах ВИЧ-позитивных и ВИЧ-негативных пациенток [33]. Еще одна причина рецидива в том, что дооперационная кольпоскопия не всегда в состоянии визуализировать всю зону преобразования, и у части больных было эндоцервикальное распространение поражения [32].
ВИЧ-инфицированные больные хуже поддаются лучевой терапии РШМ [35]. В результате применения сочетанного (дистанционное + внутриполостное) лучевого лечения больных РШМ IIB-III стадии 4-летняя выживаемость у ВИЧ-негативных и ВИЧ-инфицированных составила 46% и 0 соответственно [47]. Поэтому есть мнение, что более предпочтительны радикальные методы лечения, например, экстирпация матки с верхней третью влагалища при дисплазии шейки матки [1].
Профилактика РШМ у ВИЧ-инфицированных больных остается важной задачей [40]. Среди женщин с ВИЧ-инфекцией в проспективном исследовании, которое включало меры по профилактике РШМ, уровень последнего не превышал такового в группе сравнения ВИЧ-негативных женщин [57].
Многие исследователи утверждают, что ВААРТ способствует снижению частоты, регрессу ВПЧ-повреждений шейки матки [60], предотвращению рецидива повреждений и РШМ [21, 39]. К примеру, ингибитор протеазы ВИЧ индинавир способен воздействовать на клетки, пораженные РШМ [48]. Следовательно, применение ВААРТ может быть приоритетом в профилактике РШМ по сравнению с вакциной.
Таким образом, большинство исследователей указывают на более высокую заболеваемость РШМ у ВИЧ-инфицированных больных по сравнению с таковой в общей популяции. Многие авторы обращают внимание на большую распространенность ВПЧ у этой категории больных.
В то же время существуют противоположные публикации, утверждающие, что вероятность более частого возникновения CIN и РШМ у больных ВИЧ-инфекцией не доказана [19], уровень клеток СD4+ у пораженных ВПЧ и ВПЧ-отрицательных не различается [19] и не влияет на возникновение интраэпителиальных повреждений [61]. Уровень повреждения эпителия шейки матки не зависит от продолжительности ВИЧ-инфекции, использования ВААРТ, вирусной нагрузки [30, 49, 59]. Уровень СD4+ до ВААРТ и после нее не имеет значения для прогнозирования течения РШМ [10]. Применение ВААРТ, увеличивая выживаемость за счет сокращения случаев смерти от оппортунистических инфекций, не влияет на продолжительность жизни больных раком шейки матки [14].
Таким образом, в мировой литературе нет единого мнения об особенностях патогенеза, терапии и профилактики интраэпителиальных повреждений у ВИЧ-инфицированных больных, и, следовательно, данная проблема ждет своего разрешения.
ФГБУ "Ивановский научно-исследовательский институт материнства и детства им. В.Н. Городкова" Минздрава России
Инфекция шейки матки, ассоциированная с 52, 58 и 59-м типами вируса папилломы человека
Журнал: Российский вестник акушера-гинеколога. 2015;15(5): 10‑14
Цель исследования — определение интенсивности свободнорадикальных процессов и антиоксидантной активности у беременных с недифференцированной дисплазией соединительной ткани. Материал и методы. Основную группу составили 60 беременных, которые были обследованы в сроки беременности 22, 36 и 40 нед с недифференцированной дисплазией соединительной ткани. В контрольную группу включены 30 соматически здоровых беременных с физиологическим течением беременности. Изучено функциональное состояние плацентарной системы при помощи ультразвукового исследования и допплерометрии, реактивность сердечно-сосудистой системы плода с помощью кардиотокографа. Свободнорадикальное окисление и антиоксидантную активность определяли методом индуцированной хемолюминесценции. Результаты. Установлено, что синдром недифференцированной дисплазии соединительной ткани во время беременности сопровождается развитием окислительного стресса и повышением антиоксидантной активности. Заключение. Недифференцированная дисплазия соединительной ткани, имеющая генерализованный характер ее поражения с вовлечением в патологический процесс репродуктивной системы, отражается на течении беременности и родов. Результаты хемолюминесцентного анализа свидетельствуют о высокой концентрации свободных радикалов, развитии окислительного стресса, повышении антиоксидантной активности в организме женщин с недифференцированной дисплазией соединительной ткани, что диктует необходимость дальнейших исследований для определения комплекса диагностических и профилактических мер при недифференцированной дисплазии соединительной ткани и беременности. Авторы информируют об отсутствии конфликта интересов.
ФГБУ "Ивановский научно-исследовательский институт материнства и детства им. В.Н. Городкова" Минздрава России
Высокая распространенность папилломавирусной инфекции (ПВИ), ее доказанная роль в развитии злокачественных новообразований половых органов свидетельствуют об актуальности данной проблемы. В настоящее время известно более 150 типов вируса папилломы человека (ВПЧ), 40 из которых вызывают заболевания аногенитальной области. По степени канцерогенного риска согласно классификации IARC (International Agency for Research on Cancer), в 2012 г. выделено три группы ВПЧ: канцерогенные — 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 и 59-й (1-я группа), вероятно канцерогенные — 26, 30, 34, 53, 66, 67, 68, 70, 73, 82, 69, 85 и 97-й (2-я группа: 2А, 2В), неканцерогенные — 6, 11-й и др. (3-я группа). Все типы подразделены на определенные филогенетические группы. Наибольший клинический интерес представляет филогенетическая группа α, к которой относятся следующие типы ВПЧ высокого онкогенного риска (ВПЧ ВР): α5 (ВПЧ 51), α6 (ВПЧ 56), α7 (ВПЧ 18, ВПЧ 39, ВПЧ 45, ВПЧ 59), α9 (ВПЧ 16, ВПЧ 31, ВПЧ 33, ВПЧ 35, ВПЧ 52, ВПЧ 58) [1, 2]. Разделение по группам важно для динамического наблюдения за вирусной инфекцией и более точного прогнозирования ее развития, так как разные типы ВПЧ обладают разным онкогенным потенциалом, а также способностью к персистенции [3, 4].
Цель исследования — определить особенности течения цервикальной ПВИ, ассоциированной с 52, 58 и 59-м типами ВПЧ.
Материал и методы
В проспективное исследование в результате целенаправленного отбора включены 84 пациентки в возрасте 18—58 лет с цервикальной, обусловленной 52, 58 и 59-м типами ВПЧ, обследованные на специализированном приеме по патологии шейки матки женской консультации Омска. Средний возраст инфицированных пациенток составил 29,9±1,0 года (медиана и интерквартильный размах — 27 (23,0—32,5 года). Критерии включения в исследование: возраст от 18 до 60 лет, позитивный цервикальный ВПЧ-тест на наличие 52, 58 и 59-го типов, информированное согласие пациентки. Критерии исключения: беременность и лактация, отказ от участия в исследовании.
Комплексная диагностика включала жидкостную цитологию (Bethesda, 2001); кольпоскопическое исследование; гистологическое исследование цервикальных биоптатов и эндоцервикальных образцов и расширенный скрининг для дифференциального выявления ДНК ВПЧ, включая определение ВПЧ ВР 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 и 59-го типов методом полимеразной цепной реакции (ПЦР) в режиме реального времени (тест-система РеалБест ДНК ВПЧ ВКР генотип) [1]. При трактовке вирусной нагрузки ВПЧ учитывали порог клинической значимости — 3 lg на 10 5 клеток, порог прогрессии (более 5 lg на 10 5 клеток) [21].
Статистический анализ данных проводился с применением пакета Statistica 6, возможностей MS Excel. Во всех процедурах статистического анализа критический уровень значимости р принимался равным 0,05. Проверка нормальности распределения производилась с использованием критерия Шапиро—Уилки, проверка гипотез о равенстве генеральных дисперсий — с помощью F-критерия Фишера. Средние выборочные значения количественных признаков приведены в тексте в виде M±SE, где M — среднее выборочное, SE — стандартная ошибка среднего. При распределении значений в ряду, отличном от нормального, указывались медиана (P 0,5), 25-й перцентиль (P 0,25) и 75-й перцентиль (P 0,75). При анализе таблиц сопряженности оценивались значения информационной статистики Кульбака (статистика 2I).
Результаты
В возрасте моложе 35 лет (включительно) были 79,8±4,4% пациенток группы наблюдения. Распределение инфицирования шейки матки 52, 58 и 59-м типами ВПЧ в зависимости от возраста было следующим: ранний репродуктивный возраст (18—25 лет) — 33 пациентки, средний (26—35 лет) — 34, старше 36 лет — 17.
Проведен анализ частоты ВПЧ-ассоциированных поражений шейки матки, которые подразделяют на клиническую (экзофитная кондилома), латентную (отсутствие клинических, морфологических изменений при обнаружении ДНК ВПЧ), субклиническую форму (невидимые невооруженным глазом, бессимптомные, выявляются только при кольпоскопии и/или морфологически), CIN I—III степени и РШМ [1]. Случаев клинической формы ПВИ не наблюдалось. Среди инфицированных женщин наблюдались пациентки с CIN (46—54,8%), относительно латентной формой инфекции без клинических ее проявлений (12—14,3%), субклинической формой инфекции (24—28,6%) и РШМ (2—2,4%).
В зависимости от тяжести гистологически верифицированного предрака CIN I установлена в 51,2%, CIN II — в 32,5%, CIN III — в 16,3% наблюдений.

Таблица 1. Формы папилломавирусной инфекции, ассоциированной с 52, 58 и 59-м типами, в зависимости от возраста

Таблица 2. Частота выявления ВПЧ 52, 58 и 59-го типов у женщин с ПВИ

Рис. 1. Распределение ВПЧ-ассоциированных поражений шейки матки при моно- и сочетанной формах инфекции.
Проведена оценка вирусной нагрузки ВПЧ 52, 58 и 59-го типов среди 84 инфицированных женщин (включая моно- и сочетанное инфицирование) (табл. 3). В 30 случаях ее уровень был ниже порога клинической значимости, в 30 случаях вирусная нагрузка ВПЧ 52, 58 и 59-го типов была в пределах от 3 до 5 lg на 10 5 клеток, в 33 случаях вирусная нагрузка была выше порога прогрессии. Превышение порога прогрессии варьировало в диапазоне 25—46,7% в зависимости от типа ВПЧ (рис. 2).

Таблица 3. Распределение уровня вирусной нагрузки по типам ВПЧ в группе обследованных пациенток (моно- и сочетанная инфекция) Примечание. * Здесь и в табл. 4: число наблюдений вирусной нагрузки не совпадало с числом обследованных пациенток в связи с сочетанным инфицированием.

Рис. 2. Вирусная нагрузка ВПЧ 52, 58 и 59-го типов у женщин с ПВИ.
При анализе взаимосвязи клинических форм ПВИ и уровня вирусной нагрузки установлено двукратное превышение случаев c нагрузкой, превышающей 5 lg на 10 5 клеток, у женщин с CIN: 25 против 10 (менее 3 lg на 10 5 клеток) и 11 (от 3 до 5 lg на 10 5 клеток) случаев, p=0,0091 (табл. 4).

Таблица 4. Зависимость формы ПВИ при 52, 58 и 59-м типах ВПЧ (моно- и сочетанная инфекция) от вирусной нагрузки
В случае моноинфекции латентная форма не сопровождалась нагрузкой выше порога прогрессии, субклиническая форма протекала на фоне превышения порога прогрессии в 1 случае против остальных 11, в то время как ЦИН и РШМ — в 13 против 7 случаев с меньшей вирусной нагрузкой (табл. 5). Установлено наличие статистически значимой связи между тяжестью формы ПВИ и уровнем вирусной нагрузки 52, 58 и 59-го типов (2I=16,29; p<0,05).

Таблица 5. Формы ПВИ при моноинфекции 52, 58 и 59-м типами ВПЧ
Согласно данным исследований, основанных на большом клиническом материале, среди различных возрастных групп повышение уровня вирусной нагрузки увеличивает тяжесть поражения шейки матки ВПЧ [5, 20, 22—24]. Согласно исследованию G. Shen и соавт. [25], отмечена положительная корреляция между уровнем вирусной нагрузки и степенью поражения шейки матки. Полученные нами данные доказывают влияние вирусной нагрузки для 52, 58 и 59-го типов ВПЧ на прогрессирование цервикальной неоплазии.
Выводы
1. Среди когорты женщин с папилломавирусной инфекцией шейки матки, ассоциированной с 52, 58 и 59-м типами ВПЧ, значительная доля женщин моложе 35 лет (79,8%).
2. Установлен возрастзависимый характер частоты субклинической формы инфекции и цервикальной неоплазии у инфицированных женщин.
3. Папилломавирусная инфекция, ассоциированная с 52, 58 и 59-м типами ВПЧ, сопровождалась наличием CIN и рака шейки матки в 57,1% случаев.
4. Высокая частота цервикальной неоплазии при моноинфекции (54%), сопоставимая с ее частотой при сочетании с другими типами ВПЧ ВР (59,6%; р>0,05), а также взаимосвязь тяжести поражения с уровнем вирусной нагрузки подтверждают высокий риск формирования предрака и рака шейки матки при наличии моноинфекции 52, 58 и 59-го типов ВПЧ.

Половина людей, которые имели половой контакт хотя бы раз в жизни, заражаются вирусом папилломы. ВПЧ может жить в организме годами, не давая симптомов. Поэтому большинство женщин узнают, что у них вирус папилломы, только на обследовании у гинеколога.
Кто может быть заражен вирусом папилломы?
Риску быть инфицированным вирусом папилломы может любой, кто когда-либо имел половой генитальный контакт. И мужчины, и женщины могут распространять вирус папилломы, даже не зная об этом. Риск заражения увеличивается, когда человек начинает вести активную половую жизнь в раннем возрасте, имеет много партнеров или имеет партнера, имевшего множественные половые связи.

Множественные половые связи
Как узнать о заражении ВПЧ, если нет симптомов?
Есть исследование, которое обнаруживает вирус папилломы, вызывающий рак шейки матки. Проходить такое обследование рекомендуется для всех женщин старше 30 лет. Благодаря анализу, вирус папилломы может быть обнаружен до того, как он вызывает патологические изменения в шейке матки.
Не путайте анализ на ВПЧ с тестом по Папаниколау. Во время теста Папаниколау мазок, взятый с шейки матки, исследуется на клеточном уровне. При подозрении на онкогенные ВПЧ необходимо выполнять оба теста.
Профилактика заражения вирусом папилломы
Во многих странах для предотвращения рака шейки матки, вызванного вирусом папилломы человека, применяется вакцина. Кроме того, существуют меры, снижающие риск заражения папилломавирусом. Одна из них — аккуратный подход к выбору партнеров.
Вакцинация эффективно защищает от вирусов типа 16 и 18, вызывающих большинство случаев рака шейки матки. Существует также четырехвалентная вакцина, которая содержит дополнительные компоненты, защищающие от вирусов типа 6 и 11. Однако вакцинация не защищает от всех типов вируса папилломы человека, которые могут вызвать рак шейки матки, поэтому даже сделав прививку, нужно всегда помнить о рисках заражения ВПЧ.
Вакцинация наиболее эффективна для девочек-подростков, не вступавших в половые отношения. Эффективность вакцинации у сексуально активных женщин ниже.

Вакцинация
Помните: вакцинация уменьшает, но не исключает риск развития рака шейки матки. Даже если вы вакцинированы, необходимо проходить регулярный скрининг на рак шейки матки.
Данные по эффективности вакцины против вируса папилломы человека показывают, что она обеспечивает эффективную защиту в течение не менее 7,3 лет. Согласно Европейскому центру по контролю и профилактике заболеваний, вакцины, которые в настоящее время используются для девочек, безопасны.
Как вылечить папилломавирус
К сожалению, удалить сам вирус папилломы из организма невозможно. Но можно вылечить заболевания, вызванные этим вирусом — генитальные бородавки, изменения в шейки матки, рак шейки матки.
Есть несколько способов лечения генитальных бородавок — все они безболезненные и эффективные. Если генитальные бородавки не лечить, со временем они могут расти и размножаться.
Все женщины, которые имеют или имели активную половую жизнь, должны проходить регулярные Пап-тесты. Благодаря этой точной диагностике, изменения в шейке матки можно выявить на клеточном уровне даже на очень ранних стадиях. Следовательно, проблема будет решена до появления рака шейки матки. Своевременная диагностика является необходимым условием для эффективного лечения.
Генитальный герпес
Генитальный герпес является одним из наиболее распространенных венерических заболеваний. Считается, что вирусом простого герпеса заражен каждый пятый взрослый человек. При этом болезнь часто протекает бессимптомно, поэтому больные продолжают заражать партнеров.
При ослаблении иммунитета у большинства пациентов появляются болезненные пузырьки вокруг половых органов (половой член, задний проход, ягодицы, вульва). Герпесная сыпь также может распространяться на бедра и бедра.
Как передается половой герпес
Главный способ передачи генитального герпеса — половой путь. Одним из способов передачи вируса простого герпеса являютс я роды, когда мать заражает новорожденного.
Симптомы
Симптомы, характерные для генитального герпеса, проявляются внезапно. В области, где вирус попал в организм появляется сыпь. Волдыри, наполненные жидкостью, увеличиваются и становятся болезненными. Место поражения сильно зудит. Затем пузырьки лопаются, кожа в этом месте покрывается корочкой.
Часто заболевание протекает бессимптомно или с такой незначительной сыпью, что пациент может даже этого не заметить.
Сыпь появляется через несколько недель после заражения и держится около 2-3 недель. Иногда опухают и болят паховые лимфатические узлы. Могут наблюдаться и другие симптомы: боль в суставах, лихорадка, головная боль, а иногда даже болезненное мочеиспускание. Тошнота, головокружение и затруднение мочеиспускания редки и указывают на повреждение нервной системы.
Сыпь может исчезнуть, но это не конец заболевания. После первоначальной вспышки вирус переходит в латентную фазу и продолжает жить в спинном мозге. Заболевание, как правило, напоминает о себе несколько раз в год, хотя симптомы наиболее остры во время первой вспышки, затем они становятся все более редкими и менее заметными. Частота рецидивов индивидуальна. Это зависит от типа вируса и иммунной системы человека.
Частота рецидивов полового герпеса
Рецидивам активации генитального герпеса способствуют все факторы, повреждающие иммунную систему. К ним относятся болезни, стрессы, солнечное облучение, усталость и менструация. Наблюдения также показали, что у женщин болезнь протекает тяжелее, чем у мужчин.
Диагностика
Диагностика генитального герпеса несложная. Опытному гинекологу или урологу достаточно осмотреть сыпь и выслушать жалобы. Но для более точного и убедительного ответа рекомендуется выполнить несколько тестов.
Для некоторых диагностических тестов достаточно анализа крови, а для других необходим мазок. После исследования мазка становится ясно, есть ли вирус герпеса. Однако вирус обычно обнаруживается только во вновь образованных пузырьках, поэтому важно, чтобы пациент обратился к врачу в течение первых 48 часов после появления симптомов.

Анализ крови
Анализ крови выявляет антитела к герпесвирусу, но они могут не появляться в крови на ранних стадиях заболевания, потому что для их формирования требуется некоторое время.
Генитальный герпес не следует путать с другими венерическими заболеваниями, которые также характеризуются появлением язв на половых органах.
Лечение возможно генитального герпеса
Современная медицина, к сожалению, не может вылечить больного генитальным герпесом, но бороться с вирусом можно. Антивирусное лечение снижает тяжесть заболевания, ослабляет симптомы, снижает риск передачи вируса. Лечение особенно эффективно в течение первых 72 часов после появления симптомов. Обычно применяется подавляющая терапия, при которой пациент ежедневно получает небольшую дозу противовирусного препарата. В результате рецидивы сходят на нет. Такое лечение рекомендуется, если у человека развивается 6 или более рецидивов в год или у него ослабленная иммунная система (например, инфицирована вирусом иммунодефицита человека). Риск заражения партнера во время супрессивной терапии уменьшается.
Снизить риск передачи вируса может правильное использование латексных презервативов, но такая профилактика не устраняет его полностью — вероятность заражения сохраняется.
Беременность и генитальный герпес
Если первая вспышка генитального герпеса происходит ближе к моменту родов, риск заражения у новорожденного возрастает. Поэтому роды следует проводить с учетом мер безопасности.
Поскольку герпес у новорожденных является очень серьезным заболеванием, беременная женщина должна заранее сообщить об этом своему врачу. Если заболевание рецидивировало несколько раз во время беременности, рекомендуется проводить лечение ацикловиром, а если роды совпали с периодом обострения — назначается кесарево сечение.
Болезнь, известная как чума двадцатого века, становится все более распространенной и в наше время. При этом, несмотря на то, что с момента обнаружения ВИЧ / СПИДа прошло уже более 30 лет, и во всем мире (в том числе в нашей стране) действуют образовательные программы, большинство людей почти ничего не знают об этом венерическом заболевании.
Откуда взялся СПИД?
СПИД (синдром приобретенного иммунодефицита) впервые был описан в Соединенных Штатах в 1981 году, когда было диагностировано несколько случаев редких заболеваний — пневмоцистной пневмонии и саркома Капоши.
Эти заболевания ранее встречались только у пациентов с нарушениями иммунной системы, поэтому врачи заподозрили иммунодефицит. Вскоре они убедились, что имеют дело с новым заболеванием, которое в 1982 году Центры США по контролю и профилактике заболеваний официально зарегистрировали как новое заболевание — синдром приобретенного иммунодефицита (СПИД).
В 1983 году был обнаружен вирус, вызывающий заболевание, называемый вирусом иммунодефицита человека (ВИЧ).
За это время появилось много теорий о происхождении и распространении болезни. Родиной СПИДа является Африка. где был обнаружен вирус иммунодефицита обезьян, который вызывает то же заболевание, что и вирус иммунодефицита человека. В результате мутации вирус изменил свой вид и стал опасным для человека.
Вирус распространился в Африке и разошелся по другим странам, где в медицинских целях использовалась кровь африканского населения. Люди, инфицированные ВИЧ-инфицированной кровью, распространяли вирус через иглы и шприцы, половой контакт.
Что такое вирус иммунодефицита человека? Почему невозможно защититься от него вакцинацией?
ВИЧ относится к ретровирусам и характеризуется сильной мутагенностью — очень быстро меняет свой внешний вид. Поэтому создать вакцину для него очень сложно. При этом генотип вируса меняется от одного человека к другому.
Представители семейства ретровирусов характеризуются длительным инкубационным периодом, что означает, что вирус, который проникает в организм, живет там годами, размножается, повреждает организм, но клинически не проявляется. Пациент может быть носителем вируса 5-7 лет, при этом быть источником инфекции, и не знать об этом, пока не будет проведено обследование непосредственно на ВИЧ-инфекцию.
Каков основной путь распространения ВИЧ?
- Незащищенный половой контакт;
- Через кровь. Этот путь включает в себя переливание крови, медицинские манипуляции нестерильными инструментами, а также использование общей иглы, шприца или другого инъекционного устройства;
- Вертикальная передача — заражение плода инфицированной беременной женщиной во время родов или кормления грудью.
Группа риска включает в себя:
- Потребители инъекционных наркотиков, которые хотя бы один раз использовали иглу, шприц или другое инъекционное устройство, которое применял кто-то другой;
- Лица, имеющие частые незащищенные половые контакты (как гетеросексуальные, так и гомосексуальные);
- Пациенты, у которых была инфекция, передающаяся половым путем;
- Зараженные гепатитом В и С.
Также относятся к группе риска пациенты на гемодиализе и пациенты, которые часто подвергаются медицинским манипуляциям.
Симптомы СПИДа
- Частые простуды;
- туберкулез;
- воспаление легких более 2 недель;
- частый понос;
- увеличенные лимфатические узлы;
- снижение веса (масса тела 10% и выше);
- ночные поты;
- слабость.
Как диагностируется заболевание?
Пациенты часто говорят, что они сдавали общий анализ крови, но он ничего не показал. Почему-то многие считают, что диагностировать заболевание можно с помощью стандартных тестов. Чтобы обнаружить ВИЧ-инфекцию, тест должен быть выполнен непосредственно на вирусный антиген или антитела к ВИЧ.
Как долго продлится период окна?
Период окна обычно длится 6-8 недель, но если анализ проводился с помощью тестов 4-го поколения, этот период может быть сокращен до 4-6 недель. После предтестовой консультации пациенту предлагается пройти тест на ВИЧ, который включает обнаружение антител к ВИЧ и называется скринингом или первичным обследованием.
Если при первоначальном скрининге получен отрицательный результат, это означает, что человек не заражен. В случае положительного ответа, исследование следует продолжить методами подтверждения (метод иммуноблоттинга, метод цепной реакции полимеризации).
Диагностика детей в возрасте до одного года, рожденных от ВИЧ-позитивных матерей, проводится только методом цепной реакции полимеризации.
Обязательно ли всем беременным женщинам проходить тестирование на ВИЧ?
Согласно законодательству, тестирование на ВИЧ является обязательным только для доноров крови, органов или спермы, а также для тех, в отношении кого такое решение принял суд. В других случаях тестирование на ВИЧ является добровольным. Но врачи требуют, чтобы обследование беременной женщины включало этот анализ.
Насколько безопасен ВИЧ / СПИД?
СПИД не передается через предметы домашнего обихода. Опасно использовать только бритву пациента, ножницы и другие предметы, которые контактируют с кровью.
Нет риска использовать общую ванную комнату, постельное белье, полотенца, посуду, целовать пациента, обниматься, учиться или работать в одной комнате с ним. Врачей часто спрашивают, передается ли ВИЧ / СПИД через укусы комаров и собак? Нет, ВИЧ не распространяется таким образом. Есть только три пути передачи: половой контакт, кровь и вертикальная передача.
Читайте также:

