Действие химических веществ на вирусы
Обновлено: 13.05.2024
Регистрационный номер:
Торговое наименование:
Международное непатентованное или группировочное наименование:
Лекарственная форма:
таблетки, покрытые пленочной оболочкой
Состав
Фавипиравир – 200,0 мг
Повидон (К-30), кремния диоксид коллоидный, гипролоза низкозамещенная, целлюлоза микрокристаллическая (тип 101), кросповидон, стеариновая кислота.
Готовое пленочное покрытие Опадрай ® 03F220114 желтый [Гипромеллоза, титана диоксид, макрогол 4000 (Полиэтиленгликоль 4000), краситель железа оксид желтый Е172].
Описание:
таблетки круглые, двояковыпуклые, покрытые пленочной оболочкой светло-желтого цвета. На поперечном разрезе ядро белого или почти белого цвета.
Фармакотерапевтическая группа:
Код ATX:
Фармакологические свойства
Фармакодинамика
Противовирусная активность in vitro
Фавипиравир обладает противовирусной активностью против лабораторных штаммов вирусов гриппа А и В (половинная максимальная эффективная концентрация (ЕС50) 0,014-0,55 мкг/мл).
Для штаммов вирусов гриппа А и В, резистентных к адамантану (амантадину римантадину), осельтамивиру или занамивиру, ЕС50 составляет 0,03-0,94 мкг/мл и 0,09-0,83 мкг/мл, соответственно. Для штаммов вируса гриппа А (включая штаммы, резистентные к адамантану, осельтамивиру и занамивиру), таких как свиной грипп типа А и птичий грипп типа А, включая высокопатогенные штаммы (в том числе, H5N1 и H7N9), ЕС50 составляет 0,06-3,53 мкг/мл.
Для штаммов вирусов гриппа А и В, резистентных к адамантану, осельтамивиру и занамивиру, ЕС50 составляет 0,09-0,47 мкг/мл; перекрестная резистентность не наблюдается.
Фавипиравир ингибирует вирус SARS-CoV-2, вызывающий новую коронавирусную инфекцию (COVID-19). ЕС50 в клетках Vero Е6 составляет 61,88 мкмоль, что соответствует 9,72 мкг/мл.
Фавипиравир метаболизируется в клетках до рибозилтрифосфата фавипиравира (РТФ фавипиравира) и избирательно ингибирует РНК-зависимую РНК полимеразу, участвующую в репликации вируса гриппа. РТФ фавипиравира (1000 мкмоль/л) не показала ингибирующего действия на α ДНК человека, но показала ингибирующее действие в диапазоне от 9,1 до 13,5 % на β и в диапазоне от 11,7 до 41,2 % на γ ДНК человека. Ингибирующая концентрация (IC50) РТФ фавипиравира для полимеразы II РНК человека составила 905 мкмоль/л.
После 30 пересевов в присутствии фавипиравира не наблюдалось изменений в восприимчивости вирусов гриппа типа А к фавипиравиру, резистентных штаммов также не наблюдалось. В проведенных клинических исследованиях не обнаружено появление вирусов гриппа, резистентных к фавипиравиру.
Фармакокинетика
Фавипиравир легко всасывается в желудочно-кишечном тракте. Время достижения максимальной концентрации (Тmax) 1,5 ч.
Связывание с белками плазмы составляет около 54 %.
Фавипиравир в основном метаболизируется – альдегидоксидазой и частично метаболизируется до гидроксилированной формы ксантиноксидазой. В клетках метаболизируется РТФ фавипиравира. Из других метаболитов, кроме гидроксилата, в плазме крови и моче человека регистрировали также конъюгат глюкуроната.
В основном фавипиравир выводится почками в виде активного метаболита гидроксилата, небольшое количество в неизменном виде. Период полувыведения (Т1/2) около 5 ч.
Пациенты с нарушением функции печени
При приеме фавипиравира пациентами с печеночной недостаточностью легкой и средней степени тяжести (класс А и В по классификации Чайлд-Пью) увеличения Сmax и AUC составили 1,5 раза и 1,8 раз, соответственно, по сравнению со здоровыми добровольцами. Данные увеличения Сmax AUC пациентов с печеночной недостаточностью тяжелой степени тяжести (класс С по классификации Чайлд-Пью) составляли 2,1 раз и 6,3 раза, соответственно.
Пациенты с нарушением функции почек
У пациентов с почечной недостаточностью средней степени тяжести (СКФ through) увеличивалась в 1,5 раза по сравнению с пациентами без нарушения функции почек. У пациентов с почечной недостаточностью тяжелой и терминальной степени тяжести (СКФ
Показания к применению
Лечение новой коронавирусной инфекции (COVID-19).
Противопоказания
Повышенная чувствительность к фавипиравиру или любому компоненту препарата Арепливир.
Печеночная недостаточность тяжелой степени тяжести (класс С по классификации Чайлд-Пью).
Почечная недостаточность тяжелой и терминальной степени тяжести (СКФ
Беременность или планирование беременности.
Период грудного вскармливания.
Детский возраст до 18 лет.
С осторожностью
У пациентов с подагрой и гиперурикемией в анамнезе (возможно повышение уровня мочевой кислоты в крови и обострение симптомов), у пожилых пациентов, пациентов с печеночной недостаточностью легкой и средней степени тяжести (класс А и В по классификации Чайлд-Пью), пациентов с почечной недостаточностью средней степени тяжести (СКФ
Применение при беременности и в период грудного вскармливания
В доклинических исследованиях фавипиравира в дозировках, схожих с клиническими или меньшими, наблюдалась гибель эмбриона на ранней стадии и тератогенность.
Препарат Арепливир противопоказан беременным, а также мужчинам и женщинам во время планирования беременности. При назначении препарата Арепливир женщинам, способным к деторождению (в том числе в постменопаузе менее 2-х лет), необходимо подтвердить отрицательный результат теста на беременность до начала лечения. Повторный тест на беременность необходимо провести после окончания приема препарата.
Необходимо использовать эффективные методы контрацепции (презерватив со спермицидом) во время приема препарата и после его окончания: в течение 1 месяца женщинам и в течение 3 месяцев мужчинам.
При назначении препарата Арепливир кормящим женщинам необходимо прекратить грудное вскармливание на время приема препарата и в течение 7 дней после его окончания, так как основной метаболит фавипиравира попадает в грудное молоко.
Способ применения и дозы
Внутрь, за 30 мин до еды. Препарат Арепливир назначается в условиях стационара.
Рекомендуемый режим дозирования:
в 1-ый день приема по 1 600 мг (8 таблеток) 2 раза в день, во 2-10 дни по 600 мг (3 таблетки) 2 раза в день.
Общая продолжительность курса лечения составляет 10 дней или до подтверждения элиминации вируса, если наступит ранее (два последовательных отрицательных результата ПЦР-исследования, полученных с интервалом не менее 24 часов).
Побочное действие
В клиническом исследовании препарата Арепливир (данные промежуточного отчета) нежелательные реакции наблюдались у 9 пациентов из 40 (22,5 %), в том числе повышение активности аланинаминотрансферазы (АЛТ) у 5 (12,5%) пациентов, повышение активности аспартатаминотрансферазы (ACT) у 7 (17,5 %) пациентов и повышение активности креатинфосфокиназы у 1 (2,5 %) пациента. Данные нежелательные реакции соответствуют известным нежелательным лекарственным реакциям фавипиравира, представленным в Таблице 1.
Таблица 1. Нежелательные реакции
| Классификация по системам органов | Нежелательные реакции |
| Нарушения со стороны крови и лимфатической системы | часто: нейтропения, лейкопения редко: лейкоцитоз, моноцитоз, ретикулоцитопения |
| Нарушения со стороны обмена веществ и питания | часто: гиперурикемия, гипертриглицеридемия нечасто: глюкозурия редко: гипокалиемия |
| Нарушения со стороны иммунной системы | нечасто: сыпь редко: экзема, зуд |
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | редко: бронхиальная астма, боль в горле, ринит, назофарингит |
| Нарушения со стороны желудочно-кишечного тракта | часто: диарея нечасто: тошнота, рвота, боль в животе редко: дискомфорт в животе, язва двенадцатиперстной кишки, кровянистый стул, гастрит |
| Нарушения со стороны печени и желчевыводящих путей | часто: повышение активности АЛТ, повышение активности ACT, повышение активности гамма-глутамилтрансферазы (ГГТ) редко: повышение активности щелочной фосфатазы (ЩФ), повышение концентрации билирубина в крови |
| Другие | редко: аномальное поведение, повышение активности креатинфосфокиназы (КФК), гематурия, полип гортани, гиперпигментация, нарушение вкусовой чувствительности, гематома, нечеткость зрения, боль в глазу, вертиго, наджелудочковые экстрасистолы, боль в грудной клетке |
Передозировка
Взаимодействие с другими лекарственными средствами
Препарат Арепливир не метаболизируется цитохромом Р450, главным образом метаболизируется альдегидоксидазой и частично ксантиноксидазой. Препарат Арепливир ингибирует альдегидоксидазу и цитохром CYP2C8, но не индуцирует цитохром Р450.
Таблица 2. Межлекарственные взаимодействия
| Лекарственные средства | Признаки, симптомы и лечение | Механизм действия и факторы риска |
| Пиразинамид | Гиперурикемия | Дополнительно повышается реабсорбция мочевой кислоты в почечных канальцах. |
| Репаглинид | Может повыситься концентрации репаглинида в крови, возможно развитие нежелательных реакций на репаглинид | Ингибирование CYP2C8 приводит к повышению концентрации репаглинида в крови. |
| Теофиллин | Концентрация фавипиравира в крови может повыситься, возможно развитие нежелательных реакций на фавипиравир | Взаимодействие с ксантиноксидазой может привести к повышению концентрации фавипиравира в крови |
| Фамцикловир, сулиндак | Эффективность данных лекарственных препаратов может быть снижена | Ингибирование фавипиравиром альдегидоксидазы может привести к снижению концентрации активных форм данных препаратов в крови. |
Особые указания
Применение препарата возможно только в условиях стационарной медицинской помощи.
При развитии побочного действия необходимо сообщать об этом в установленном порядке для осуществления мероприятий по фармаконадзору. До начала приема препарата Арепливир необходимо предоставить письменную информацию пациенту об эффективности препарата и рисках, связанных с его применением (в том числе о риске влияния на эмбрион и плод) и получить письменное согласие на применение препарата.
Поскольку в исследованиях фавипиравира на животных наблюдалась смерть эмбрионов и тератогенность, препарат Арепливир нельзя назначать беременным и предположительно беременным женщинам.
- При назначении препарата Арепливир женщинам, способным к деторождению (в том числе в постменопаузе менее 2-х лет), необходимо подтвердить отрицательный результат теста на беременность до начала лечения. Женщинам, способным к деторождению, необходимо в полной мере объяснить риски и тщательно проинструктировать использовать наиболее эффективные методы контрацепции с их партнерами во время приема препарата и в течение 1 месяца после его окончания (презерватив со спермицидом). При предположении о возможном наступлении беременности необходимо незамедлительно отменить прием препарата и проконсультироваться с врачом.
- При распределении в организме человека препарата Арепливир попадает в сперму. При назначении препарата пациентам мужчинам необходимо в полной мере объяснить риски и тщательно проинструктировать использовать наиболее эффективные методы контрацепции при сексуальных контактах во время приема препарата и в течение 3 месяцев после его окончания (презерватив со спермицидом). Дополнительно необходимо проинструктировать пациентов мужчин не вступать в сексуальные контакты с беременными женщинами.
- При распределении в организме человека препарат Арепливир попадает в грудное молоко. При назначении препарата кормящим женщинам необходимо в полной мере объяснить риски и тщательно проинструктировать прекратить грудное вскармливание на время приема препарата и в течение 7 дней после его окончания.
Влияние на способность управлять транспортными средствами, механизмами
Следует соблюдать осторожность при управлении транспортными средствами и работе с механизмами.
Форма выпуска
Таблетки, покрытые пленочной оболочкой, 200 мг.
По 10 таблеток в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой печатной лакированной или из пленки поливинилхлоридной/поливинилиденхлоридной и фольги алюминиевой печатной лакированной.
По 40, 100 таблеток в банку из полиэтилена высокой плотности, укупоренную крышкой из полипропилена с контролем первого вскрытия. Свободное пространство в банке заполняют ватой медицинской гигроскопической. Каждую банку или 4 контурные ячейковые упаковки вместе с инструкцией по медицинскому применению помещают в пачку из картона.
Условия хранения
При температуре не выше 25 °С во вторичной упаковке.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности.
Условия отпуска
Отпускают по рецепту.
Владелец регистрационного удостоверения
Производитель
Организация, принимающая претензии потребителя
Арепливир таблетки - цена, наличие в аптеках
Указана цена, по которой можно купить Арепливир таблетки в Москве. Точную цену в Вашем городе Вы получите после перехода в службу онлайн заказа лекарств:
Методика химической инактивации вирионов. Примеры методов химической инактивации вирусов.
Химическая инактивация вирионов технически проста. Однако надежное подавление инфекционности нередко сопровождается существенным снижением других видов биологической активности, в том числе иммуногенности. К тому же, в ряде случаев требуется нейтрализация инактивирующих агентов.
Можно сказать, что все инактивирующие агенты в той или иной степени вызывают изменения как в нуклеиновой кислоте, так и в белковой оболочке. При этом характер изменений вирусных частиц во многом определяется природой инактивирующего агента и возбудителя.
Приготовление эффективных инактивированных вакцин из некоторых оболочечных вирусов (вирус кори, респираторно-синцитиальный и др.) оказалось трудной задачей, поскольку все оболочечные вирусы имеют сложную липопротеиновую оболочку (липидный бислой с встроенными белками), наружные белки которой играют основную роль в индукции протективного иммунитета и часто денатурируются в процессе инактивации и последующего хранения.
Изучение воздействия химических инактиваторов на эпитопы гликопротеинов вируса лихорадки долины Рифт показало, что вскоре после начального периода инактивации этиленимин мало действует на эпитопы. Бета-пропиолактон в значительной мере изменяет структуру семи эпитопов, а формальдегид частично воздействует на конфирмационную структуру большинства из них. Эпитопы всех инактивированных антигенов отличаются сниженной способностью реагировать со специфическими моноклональными антителами в случае хранения их более 6 мес.
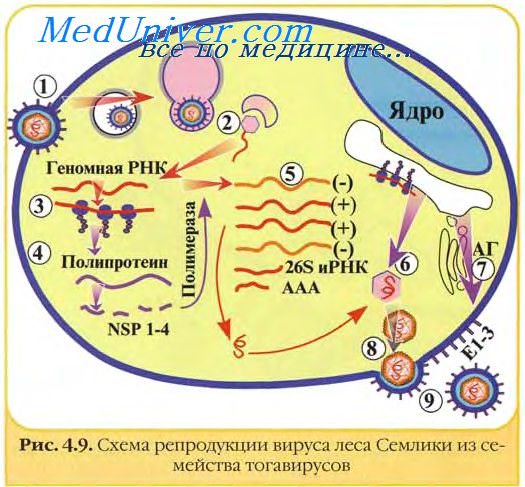
Опытным путем на различных вирусах установлено, что при щадящих условиях инактивации, как правило, вначале теряется инфекционность, а затем антигенность. Считается, что чем больше разница во времени между утратой этих свойств, тем перспективнее режим инактивации данного вируса.
Изучение механизма взаимодействия инактивирующих факторов с нуклеиновыми кислотами и белками вирусов, а также выяснение структурных и функциональных модификаций этих макромолекул поможет сделать выбор оптимальных условий инактивации вирусов с учетом их групповых и индивидуальных особенностей.
Первым реагентом для изготовления многих вирусных инактивированных вакцин был формальдегид. Около 50 лет назад была предложена инактивированная формалином сорбированная вакцина против ящура, технологию изготовления которой совершенствовали в течение многих лет. На ранних этапах широкого применения такой вакцины имели место случаи неполного обезвреживания вируса ящура, что нередко приводило к вспышкам заболевания в европейских странах. Все это создало необходимость изыскать новые методы инактивации, обеспечивающие полную потерю инфекционных свойств вируса без снижения его антигенности, в результате чего предпочтение было отдано ацетилэтиленимину.
Однако в последнее время представлены новые доказательства в пользу пригодности формальдегида для приготовления безопасной противоящурной вакцины. Этому способствовало использование фильтрованной вирусной суспензии, инактивация вируса перед добавлением ГОА и соблюдение общепринятого режима инактивации (0,04% формалина; рН 8,5; 25°С). Исключение адсорбации вируса перед добавлением формалина значительно облегчает контроль кинетики инактивации вируса, а также позволяет проводить очистку и концентрирование инактивированного вирусного антигена. При длительном хранении иммуногенность формолвакцины была выше, чем вакцины, инактивированной АЭИ. Сохранность полных вирионов (146S-частиц) через 1 год (4°С) после инактивации формальдегидом глицилальдегидом и бета-пропионлоктоном соответственно составляла 30—50%, 80—90% и 10—20%.
Д. Солк и сотрудники, используя культуральный вирус и формалин, впервые в истории профилактики полиомиелита получили безопасную инактивированную вакцину. Фильтрованный вирус инактивировали формалином (1:4000; 37°С; рН 7,0; 12 суток). В дальнейшем, инактивированная формалином трехвалентная вакцина против полиомиелита повышенной активности была приготовлена в институте Мерье (Франция) из вируса, выращенного в культуре клеток Vera на микроносителе.
Вакцина против болезни Тешена, инактивированная бета-пропиолактоном, оказалась более иммуногенной, чем формолвакцина, полученная аналогичным образом, тогда как другие исследователи при создании инактивированных вакцин против африканской чумы лошадей и болезни Тешена отдавали предпочтение формалину.
Вирус африканской чумы лошадей инактивировали бета-пропиолактоном (30 мин, 25°С) или формалином (48 ч, 25°С). Иммуногенная активность обоих антигенов, сорбированных на гидрате окиси алюминия, была одинаковой. Бета-пропиолактон оказался эффективным средством при изготовлении инактивированных вакцин против ныокаслской болезни и везикулярной болезни свиней.
Вирус гепатита А, адаптированный к культуре клеток человека, концентрировали преципитацией сульфатом аммония и инактивировали бета-пропиолактоном. Вакцина обладала выраженной антигенностью, вызывая длительную персистенцию антител у вакцинированных животных. Другие авторы при изготовлении вакцины против гепатита А вирус выращивали в культуре диплоидных клеток человека MRC-5. Очищенный и концентрированный вирус инактивировали формальдегидом, консервировали 2-феноксиэтанолом, а в качестве адъюванта добавляли ГОА. Одна доза (1 мл) вакцины, содержащая 720 ед. (ИФА) вирусного антигена, вызывала практически 100%-ную сероконверсию у взрослых, а после бустеризации обеспечивала защиту сроком не менее 10 лет. Аналогичная вакцина при испытании на обезьянах и морских свинках обладала выраженной антигенностью и иммуногенностью.
Инактивированная вакцина против гепатита А была лицензирована в ряде европейских стран. Лицензированная вакцина 5 KB для взрослых содержала 1,440 единиц/мл вирусного антигена (определение в стандартном ИФА), 0,5 мг. А1(ОН)3 в качесте адъюванта и 2-феноксиэтанол в качестве консерванта. Первичную иммунизацию проводили внутримышечно одной дозой вакцины, бустеризация — через 6—12 месяцев усиливала иммунитет. Для иммунизации детей использовали уменьшенную дозу вакцины. При ускоренном методе старения при 37°С вакцина сохраняла активность 3 недели, а при 2-8°С - 15 месяцев.
Другой аналогичной лицензированной вакциной является вакцина VAQTA. Очищенный концентрированный частично аттенуированный вирус инактивировали формальдегидом и сорбировали на гидрате окиси алюминия. У вакцинированных шимпанзе в течение 2 недель развивались ВНА и они были защищены от внутривенного заражения вирулентным вирусом гепатита А. Обе инактивированные вакцины были безопасны и иммуногены для людей.
Инактивированную сорбированную вакцину против кори применяли трехкратно. Иммунизация сопровождалась образованием различного уровня нейтрализующих антител и антител, подавляющих ГА. Вакцинированные пациенты были защищены от заболевания в течение нескольких месяцев после иммунизации. Титр антител быстро снижался и они вновь становились чувствительными к естественному заражению.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Особенности химических методов инактивации вирусов. Принципы химической инактивации.
В опытах с герпесвирусом типа I крупного рогатого скота установлено, что в процессе инактивации формальдегидом эпитопы гликопротеинов g I, g II и g IV на 80% теряют способность связывать соответствующие моноклональные антитела. Однако это не коррелировало с их способностью вызывать антительный ответ. Инактивация формальдегидом энтеровирусов не влияла на распознавание группоспецифического антигена Т клетками. В изготовлении инактивированных вакцин, кроме формальдегида, нашел применение глютаровый альдегид. Он вызывает агрегацию вирионов благодаря образованию межмолекулярных связей в результате взаимодействия формальдегида с аминогруппами поверхностных белков вирионов. При сшивке белковых молекул альдегидом блокируется до 2/3 остатков лизина. Инактивация глютаральдегидом не сопровождается заметным снижением антигенных свойств вирусов, вероятно, благодаря полимеризации белковых молекул.
Бета-пропиолактон представляет собой высокоактивный алкилирующий агент, нестойкий в водных растворах и легко гидролизуемый с образованием безвредных веществ: гидроакриловой и бета-оксипропионовой кислот. В связи с этим отпадает необходимость в нейтрализации избытка бета-пропиолактона и продуктов его распада.
Бета-пропиолактон оказывает инактивирующее действие на многие вирусы. При оптимальной концентрации бета-пропиолактона снижается инфекционность вируса ньюкаслской болезни без существенного изменения гемагглютинирующей, нейраминидазной и гемолизирующей активности. Бета-пропиолактон разрушает инфекционность вируса Сендай, не влияя на его антигенные свойства. Высказано предположение, что потеря инфекционности вирусами Сендай и ньюкаслской болезни обусловлена взаимодействием бета-пропиолактона с вирусным геномом. С помощью бета-пропиолактона удалось получить высокоактивные вакцины против бешенства и неинфекционные антигенноактивные препараты вируса катаральной лихорадки овец, а также инфекционного бронхита птиц.
Инактивация вирусов бета-пропиолактоном зависит от концентрации инактиватора, температуры взаимодействия и содержания белка в вирусной суспензии. Повышение концентрации бета-пропиолактона может привести к нежелательной реакции с вирусными белками и, вследствие этого, к снижению антигенной активности.
Из других химических веществ для инактивации вирусов представляет интерес гидроксиламин, который, как и бета-пропиолактон, полностью разлагается в течение короткого периода. Инактивирующее действие гидроксиламина определяется его взаимодействием с пиримидиновыми основаниями нуклеиновой кислоты, зависящим от величины рН. В слабокислой среде происходит, главным образом, изменение цитозина, а в щелочной — урацила. Обработка некоторых вирусов (полиомиелита, бешенства, западного и восточного энцефаломиелита лошадей, гриппа, ньюкаслской болезни, осповакцины и др.) гидроксиламином при оптимальном режиме инактивации не приводила к существенным изменениям их антигенной активности, что позволило использовать это вещество для изготовления диагностических антигенов и инактивированных вакцин.
В последние годы внимание исследователей привлекли азиридины, и особенно этиленимин и его производные. Этиленимин - насыщенное, гетероциклическое соединение, впервые было синтезировано из бромэтиламина в 1988 г.. Этиленимин, как и другие азиридины, относится к группе высокореакционных алкилирующих соединений, обладающих токсичностью.
Этиленимин и его производные оказывают сильное инактивирующее действие на вирусы, сохраняя их антигенные свойства. Инактивирующий эффект этиленимина на вирусы, по-видимому, объясняется депуринизацией и последующей деполимеризацией нуклеиновых кислот. Замена формальдегида этиленимином основывалась на следующих преимуществах. В отличие от формальдегида, вызывающего образование поперечных связей в вирусных белках, этиленимин оказывал влияние только на нуклеиновую кислоту. При 25°С инактивация вируса представляла собой быстрый, легко контролируемый линейный процесс, а полученные при этом полностью неинфекционные антигены оказались удобными в дальнейшей переработке — концентрировании и очистке.
Изучение кинетики инактивации вируса леса Семлики ацетилэтиленимином показало возрастание скорости инактивации с увеличением температуры (до 40°С) и концентрации инактиватора (до 0,1%). Оптимальной оказалась температура 37°С, так как при ее снижении ниже 23°С вирус полностью не инактивировался, а при повышении — происходила термоинактивация вируса и потеря протективных свойств. Отмечена перспективность применения ацетилэтиленимина для приготовления инактивированных вакцин против тогавирусов.
Для инактивации вирусов чаще применяют ацетилэтиленимин (АЭИ) и особенно димер этиленимина (ДЭИ), который значительно менее токсичен по сравнению с этиленимином. Использование азиридинов для приготовления инактивированных противовирусных вакцин во многом обязано исследованиям с вирусом ящура.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Дезинфицирующие средства, содержащие в качестве действующих веществ (ДВ) соединения из группы поверхностно-активных веществ (ПАВ) [1], в частности четвертично-аммониевые соединения (ЧАС), имеют ряд преимуществ: их можно применять в присутствии пациентов (персонала) в лечебно-профилактических учреждениях (ЛПУ) и др.; они не раздражают верхние дыхательные пути, не имеют резкого запаха, не обесцвечивают ткани, не вызывают коррозии металлов. Кроме того, многие из них обладают, наряду с дезинфицирующими свойствами, моющим действием, что позволяет сочетать обеззараживание объектов с удалением загрязнений. В связи с этим дезинфектанты на основе ПАВ наиболее удобны при проведении текущей и профилактической дезинфекции.
Долгое время считалось, что к недостаткам средств из группы ПАВ можно отнести отсутствие способности инактивировать мелкие, не имеющие липидной оболочки РНК-содержащие, так называемые "гидрофильные" вирусы (энтеровирусы, вирусы полиомиелита и др.), вызывать гибель спор, микобактерий туберкулеза, некоторых видов грибов. В связи с этим такие средства были известны, в основном, как бактерициды и только некоторые из них - как слабые вирулициды, эффективные в отношении лишь некоторых "липофильных" вирусов (вирусы гриппа, парагриппа и др.).
Для расширения спектра антимикробной активности при разработке новых средств на основе ПАВ в состав их рецептур стали вводить такие компоненты, как глутаровый альдегид, перекись водорода и др., обуславливающие вирулицидное (Бианол, Аламинол, Пероксимед, ПВК, Септодор-форте и др.), туберкулоцидное и фунгицидное действие.
Учитывая, что для дезинфекции изделий медицинского назначения (ИМН) могут применяться только те средства, которые эффективны в отношении вируса гепатита В, других парентеральных вирусов и ВИЧ, а также необходимость обеззараживания всех ИМН после применения у пациентов, большой спрос и актуальность имеют средства, обладающие вирулицидным действием. В связи со сложившейся в стране ситуацией по туберкулезу не меньшую значимость приобретают средства для профилактики туберкулеза. Широкая распространенность дерматофитий определяет существенную роль фунгицидов в профилактике грибковых инфекций в ЛПУ, гостиницах, общежитиях, банях и др.)
В последние годы для регистрации в России из зарубежных стран все чаше стали поступать средства, содержащие в своих рецептурах ПАВы, предназначенные для дезинфекции при вирусных инфекциях (гепатите В, ВИЧ-инфекции), туберкулезе и грибковых инфекциях. При разработке отечественных средств больше внимания также стало уделяться приданию им вирулицидных, туберкулоцидных и фунгицидных свойств.
Нами проведена оценка спектра антимикробного действия некоторых средств, производимых в России и за рубежом, содержащих ПАВы в качестве действующих (ДВ). Для оценки вирулицидной активности использовали тест-вирус (вирус полиомиелита 1 типа, вакцинный штамм LSc 2ab), являющийся высокорезистентным к действию дезинфицирующих средств из различных химических групп; изучение туберкулоцидной и фунгицидной активности проводили с использованием культур Mycobacterium В5, Candida albicans, Trichophyton gypseum [2].
Перечень средств и спектр их антимикробной активности приведены в таблице.
Таблица
Спектр антимикробного действия некоторых дезинфицирующих средств из группы ПАВ отечественного и зарубежного производства
| Наименование средства, фирма-производитель | Действующие вещества | Антимикробное действие | |||
| Вирулицидное | Туберкулоцидное | Фунгцидное | |||
| Инактивация вируса полиомиелита | Разрушение HbsAg | ||||
| Катамин АБ ОАО "Синтез", Москва | ЧАС | - | не исследовалось | не исследовалось | не исследовалось |
| ПВК ОАО "Синтез", Москва | ЧАС, Перекись водорода | + | + | + | + |
| Аламинол ГНЦ "НИОПИК", Москва | ЧАС, глиоксаль | + | + | + | + |
| Бианол ГНЦ "НИОПИК", Москва | ЧАС, глутаровый альдегид | + | + | + | + |
| Септодор-форте Дорвет Лтд, Израиль | ЧАС, глутаровый альдегид | + | + | + | + |
| Септустин АОЗТ "Уралстинол-С", Россия | ЧАС | + | + | + | + |
| Септаксилин ЗАО "Акс-техно", Россия | ЧАС | + | + | + | + |
| Дезэффект "Ликва-Тех. Индастриес, Инк", США | ЧАС | + | + | + | + |
| РИК-Д ПКФ "Фантом", Россия | ЧАС | - | + | не исследовалось | + |
| Велтолен ЗАО "BEЛT", Оренбург | ЧАС | - | + | + | + |
| Септабик "Абик", Израиль | ЧАС | - | + | не исследовалось | + |
| Бромосепт "Абик", Израиль | ЧАС | - | + | + | + |
Согласно данным, приведенным в таблице, катамин АБ не способен инактивировать тест-вирус, но в сочетании с перекисью водорода (в виде средства ПВК) композиция приобретает вирулицидное действие. Наличием перекиси водорода обусловлена вирулицидная активность Пероксимеда. Широкий спектр активности Бианола, Аламинола и Септодора-форте объясняется присутствием в рецептурах этих средств альдегидов.
Совершенно непредсказуемым оказалось наличие вирулицидного действия, причем в отношении высокорезистентного вируса - вируса полиомиелита, у таких средств, как Септаксилин, Септустин и Дезэффект (прежнее название Санифект-128, в разработке и исследованиях средства Дезэффект принимали участие З. Гэлб, США, А.В. Ригберг и И.Л. Михно, Украина). Показано, что они вызывают гибель тест-микроорганизмов: Mycobacterium В5, С.albicans и T.gypseum. Кроме того, установлено, что растворы Дезэффекта при температуре 50 о С способны вызывать гибель спор B.cereus. Изучение в лабораторных условиях эффективности обеззараживания тест-объектов из различных материалов (металлов, стекла, резин, пластмасс и др.), контаминированных микобактериями, грибами и вирусами, позволило рекомендовать средства Септаксилин, Септустин и Дезэффект для дезинфекции поверхностей в помещениях, приборов, оборудования, белья, посуды и др. объектов при туберкулезе, вирусных и грибковых инфекциях в ЛПУ.
Исследования, проведенные в НИИ вирусологии им. А.И. Ивановского (Исаева Е.И.) показали, что средства Велтолен, Септабик, Бромосепт и РИК-Д способны разрушать HBsAg. Однако эти средства не вызывали инактивацию тест-вируса (вирус полиомиелита), более устойчивого к воздействию дезинфектантов, чем HBsAg. Установлено, что они способны также вызывать гибель грибов рода Candida и Trichophyton, а Велтолен и Бромосепт, кроме того, активны в отношении Mycobacterium В5 (исследование туберкулоцидных свойств Септабика и РИК-Д не проводилось).
Были изучены дезинфицирующие свойства Велтолена и Бромосепта при обеззараживании тест-поверхностей и изделий медицинского назначения из различных материалов, белья, посуды, предметов ухода за больными, контаминированных бактериями (в том числе микобактериями), вирусами (ВИЧ, HBsAg), грибами (рода Candida, Trichophyton) в зависимости от времени воздействия, концентрации раствора, способа обработки. Разработаны режимы обеззараживания ИМН и других объектов, вошедшие в методические указания по применению этих средств.
Таким образом, получена новая информация о спектре антимикробной активности средств из группы ПАВ, а именно: о способности некоторых из них - Септаксилина, Септустина, Дезэффекта инактивировать даже высокорезистентные к дезинфицирующим средствам мелкие РНК-содержашие вирусы, типичным представителем которых является вирус полиомиелита; о наличии у средств РИК-Д, Велтолен, Септабик, Бромосепт свойства разрушать HBsAg, выявляемого современными методами его индикации; способности вышеназванных средств из группы ПАВ вызывать гибель микобактерий туберкулеза, грибов рода Candida и дерматофитов рода Trichophyton.
Литература
1. В.И. Вашков. "Антимикробные средства и методы дезинфекции при инфекционных заболеваниях", М., 1977.
2. "Методы испытаний дезинфекционных средств для оценки их безопасности и эффективности", Москва, Минздрав РФ, 1996 г.
Читайте также:

