Двухцепочечная рнк у вирусов
Обновлено: 25.04.2024
Структура и типы РНК человека: транспортная, ядерная, рибосомальная, митохондриальная и т.д.
Гетерогенная ядерная и информационная РНК
ГяРНК и её производное — информационная (или матричная) РНК переносят генетическую информацию от ядерной ДНК к цитоплазме.
Количество видов гяРНК равно количеству генов, так как она служит прямой копией кодирующих последовательностей генома. В процессе транскрипции РНК с ДНК ключевую роль играет фермент РНК-полимераза II. Информационная РНК образуется в результате процессинга гяРНК, при котором происходят вырезание некодирующих участков (интронов) и склеивание кодирующих экзонов. Таким образом, в состав иРНК входят кодирующая информация соответствующих видов гяРНК, а также фланкирующий лидерный и трейлерный участки, по этой причине она значительно короче.
Транспортная РНК
Так, например, тРНК, антикодон которой имеет последовательность 5'-ЦЦА-3', может нести только аминокислоту триптофан. Следует отметить, что данная зависимость лежит в основе передачи генетической информации, носителем которой выступает тРНК.
Транскрипция молекул тРНК происходит с кодирующих её последовательностей в ДНК при участии фермента РНК-полимеразы III. Различают более 40 семейств тРНК, которые, в свою очередь, подразделяют на несколько видов.
Рибосомальная РНК
Существует несколько субъединиц рРНК, которые различаются по коэффициенту седиментации (осаждения), измеряемому в единицах Сведберга (S). Данный коэффициент зависит от скорости осаждения субъединиц при центрифугировании в насыщенной водной среде.
Траскрипция рРНК с ДНК происходит при помощи двух дополнительных РНК-полимераз. РНК-полимераза I транскрибирует 5S, 5,8S и 28S в виде одного длинного 45S-тpaнскрипта, который затем разделяется на необходимые части. Таким образом обеспечивается равное количество молекул. В организме человека в каждом гаплоидном геноме присутствует примерно 250 копий последовательности ДНК, кодирующей 45S-транскрипт. Они расположены в пяти кластерных тандемных повторах в коротких плечах хромосом 13, 14, 15, 21 и 22.
Данные участки известны как ядрышковые организаторы, так как их транскрипция и последующий процессинг 45S-транскрипта происходят внутри ядрышка.
Не менее чем в трёх кластерах хромосомы 1 существует 2000 копий 5S-pPHK гена. Их транскрипция протекает в присутствии РНК-полимеразы III снаружи ядрышка. Затем они доставляются к местам сборки рибосом при помощи рибосомальных белков.
В рРНК насчитывают около 95 псевдоуридиновых участков, образованных посредством изомеризации уридина малой ядрышковой РНК.
Малая ядерная РНК. Превращение гяРНК в иРНК путём удаления интронов проходит в ядерном комплексе РНК-белков, называемом сплайсомой. У каждой сплайсомы есть ядро, состоящее из трёх малых (низкомолекулярных) ядерных рибонуклео-протеинов, или снурпов. Каждый снурп содержит хотя бы одну малую ядерную РНК и несколько белков. Существует несколько сотен различных малых ядерных РНК, транскрибируемых в основном РНК-полимеразой II.
Считают, что их основная функция — распознавание специфических рибонуклеиновых последовательностей посредством спаривания оснований по типу РНК—РНК. Для процессинга гяРНК наиболее важны Ul, U2, U4/U6 и U5.
Малая ядрышковая РНК. Малая (низкомолекулярная) ядрышковая РНК в основном участвует в направлении или проведении модификаций оснований в рРНК и малой ядерной РНК, таких, как, например, метилирование и псевдоуридинизация. Большинство малых ядрышковых РНК находятся в интронах других генов.
Сигналраспознающая РНК. Сигналраспознающая РНК распознаёт сигнальную последовательность белков, предназначенных для экспрессии, и участвует в их переносе через цитоплазматическую мембрану.
Митохондриальная РНК
Митохондриальная ДНК представляет собой непрерывную петлю и кодирует 13 полипептидов, 22 тРНК и 2 рРНК (16S и 23S). Большинство генов находятся на одной (тяжёлой) цепи, однако некоторое их количество расположено и на комплементарной ей лёгкой. При этом обе цепи транскрибируются в виде непрерывных транскриптов при помощи митохондриоспецифической РНК-полимеразы. Данный фермент кодируется ядерным геном. Длинные молекулы РНК затем расщепляются на 37 отдельных видов, а мРНК, рРНК и тРНК совместно транслируют 13 мРНК. Большое количество дополнительных белков, которые поступают в митохондрию из цитоплазмы, транслируются с ядерных генов.
У пациентов с системной красной волчанкой обнаруживают антитела к снурп-белкам собственного организма. Кроме того, считают, что определённый набор генов малой ядерной РНК хромосомы 15q играет важную роль в патогенезе синдрома Прадера—Вилли (наследственное сочетание олигофрении, низкого роста, ожирения, гипотонии мышц).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Одни вирусы способны интегрироваться в геном клетки-мишени и таким образом оставаться во всех дочерних клетках, которые будут в будущем получены после ее деления. К таким вирусам относятся гаммаретровирусы и лентивирусы. Другие делать этого не умеют (например, адено- и аденоассоциированные вирусы). Но для производства белков и репликации (размножения) все они используют клетку и ее синтетический аппарат.
Как это работает?
Для того чтобы вирус мог проникнуть в клетку, белки его оболочки должны связаться с мембранными белками клетки-мишени. Важно отметить, что проникает вирус только в те клетки, которые могут в дальнейшем помочь его репликации. Вирус ВИЧ живет в клетках иммунной системы, вирус гепатита С — в клетках печени. Есть особые вирусы, которые поражают только растения или даже только бактерии.
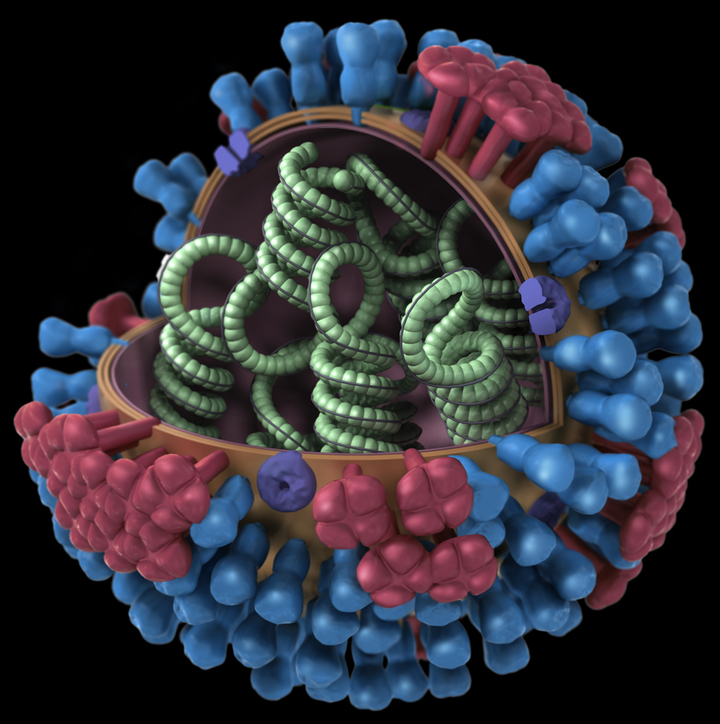
Строение вируса гриппа. Под оболочкой вириома - генетический материал вируса, необходимый для его воспроизводства в клетке.
Содержащие неактивный вирус и оставшиеся в живых клетки иногда сохраняют возможность нормального функционирования. В этом случае клетки могут быть заражены, но вирус проявит себя спустя длительный период времени. Так устроен герпес.
В зависимости от того, каким типом нуклеиновой кислоты представлен генетический материал, выделяют ДНК-содержащие вирусы и РНК-содержащие вирусы. И тут стоит остановиться на классификации.
Типы вирусов. Коротко о главном
Современная типология вирусов содержит 7 классов и была предложена Дэвидом Балтимором еще в 1971 году. С тех пор, впрочем, она была уточнена и расширена, в том числе советскими учеными. И выглядит в настоящее время таким образом:
Вирусы, содержащие двухцепочечную ДНК
Описание
Для репликации вирусу необходимо попасть в ядро клетки-мишени и воспользоваться ее ДНК-полимеразой. Иногда вирус вызывает незапланированное деление самое клетки, то есть становится онкогенным. Эти вирусы хорошо изучены.
Пример: Вирус герпеса, адено- и папилломавирусы
Вирусы, содержащие одноцепочечную ДНК
Описание
Попадая в ядро клетки, вирусы образуют двухцепочечную ДНК, после чего реплицируются так же, как вирусы класса I.
Пример: Парво- и цирковирусы
Вирусы, в которых РНК способна к репликации (редупликации)
Описание
Вирусы этого класса могут размножаться в цитоплазме клетки, им не нужна молекула ДНК. Каждый ген, находящийся в РНК вируса, кодирует только один вирусный белок.
Пример: Бирна- и реовирусы
Вирусы, содержащие одноцепочечную (+) РНК
Описание
Из геномной (+) РНК на рибосомах хозяина создаются вирусные белки. В одном фрагменте РНК могут быть закодированы разные белки, что увеличивает сложность вируса без удлинения генов.
Пример: Пикорнавирусы (полиомиелит, гепатит А) и коронавирусы
Вирусы, содержащие одноцепочечную (–) РНК
Описание
(–) РНК этих вирусов предварительно должна быть транскрибирована в (+) РНК вирусными РНК-полимеразами, после чего может начаться синтез вирусных белков. Вирусы этого класса делятся еще на две группы, в зависимости от их генома и места его репликации (цитоплазма или ядро).
Пример: Филовирусы, аренавирусы (геморрагическая лихорадка Ласса), ортомиксовирусы (вирусы гриппа) и так далее.
Вирусы, содержащие одноцепочечную (+) РНК, реплицирующиеся через стадию ДНК
Описание
Такие вирусы используют фермент обратную транскриптазу для превращения (+) РНК в ДНК, которая встраивается в геном хозяина ферментом интегразой. Дальнейшая репликация происходит при помощи полимераз клетки хозяина.
Пример: Ретровирусы (в том числе ВИЧ)
Вирусы, содержащие двухцепочечную ДНК, реплицирующиеся через стадию одноцепочечной РНК
Описание
Молекула ДНК замкнута в кольцо и является матрицей для синтеза мРНК и дополнительных молекул РНК, которые используются при репликации вирусного генома обратными транскриптазами.
Пример: Колимовирусы (вызывают инфекции растений) и гепаднавирусы (например, гепатит В)
Вакцинация и лечение
Как правило, организмы умеют бороться с паразитирующими на них вирусами. На примере млекопитающих и человека мы обычно говорим о главном инструменте — врожденном иммунитете.
Впрочем, наиболее эффективен этот вид защиты в отношении бактериальных инфекций и не может обеспечить продолжительную и надежную защиту, особенно от инфекций вирусных.
Именно поэтому огромное значение имеет приобретенный иммунитет, в результате которого клетки иммунной системы обучаются вырабатывать специфические к вирусу антитела, способные уничтожать как саму вирусную частицу, так и зараженные ею клетки.
Еще одна врожденная система борьбы с вирусными инфекциями — внутриклеточная. Как правило, клетка способна распознать чужеродную РНК в своей цитоплазме, куда ее сперва и доставляют многие вирусы, и имеет специальные комплексы для ее деградации. Но часть вирусов научились обходить и эту ловушку. К примеру, ротавирусы, которые даже внутри клетки сохраняют капсид с геномной РНК.
Миссия: уничтожить
Основная сложность в лечении вирусных заболеваний заключается в том, что они используют естественные функции клеток-мишеней для своего размножения, поэтому ученым зачастую оказывается не так-то просто придумать препарат, который будет токсичен для вируса и безопасен для самой клетки. Если такой безопасности достичь не удастся, лекарство будет иметь слишком много побочных эффектов, повреждающих сам организм, что окажется нецелесообразно для использования.

Сравнение жизненных циклов ВИЧ и вируса гриппа. Если первый использует обратную транскрипцию и живет в клетках иммунной стистемы, вирион второго, проникая в эпительные клетки дыхательных путей целиком - а именно там он и обитает - распадается уже внутри клетки, а репликация вирусной РНК происходит в ядре с помощью вирусных полимераз PA, PB1 и PB2 путем комплементарного копирования.
По принципу действия противовирусные препараты подразделяются на две группы: стимулирующие иммунную систему атаковать вирусы (например, за счет индукции синтеза белков-интерферонов) и атакующие вирусы напрямую. Препараты второй группы различаются по этапу жизненного цикла вируса, на котором они активны: это препараты, препятствующие проникновению вируса в клетку, препятствующие размножению вируса внутри клетки и препятствующие выходу копий вируса из клетки.
Еще один класс противовирусных препаратов блокирует ферменты, необходимые для создания и модификаций белков вируса. Такие лекарства называют протеазными ингибиторами.
Вместо заключения: а могут ли вирусы приносить пользу?
Безусловно, да. Несмотря на то, что вирусы ассоциируются у большинства людей с однозначным вредом, они могут приносить и пользу — если речь идет о так называемых вирусных векторах и терапевтических подходах на их основе.
Исследователи давно научились помещать в белковую оболочку вируса интересующие их нуклеиновые кислоты, чтобы доставлять нужный ген в клетки, а также убирать те гены, которые делают вирус опасным для организма.
Это позволило сделать возможной генную терапию, помогающую бороться с заболеваниями, вызванными известными генетическими мутациями. Создание вирусных векторов — достаточно непростая задача, к тому же ограниченная свойствами самих вирусных частиц: количеством помещающейся генетической информации, местом ее вставки, стабильностью. Кроме того, вирусный вектор, используемый в медицине, не должен вызывать иммунного ответа или критично влиять на жизнедеятельность клетки. Тем не менее эти сложности решаются, поэтому уже одобрен ряд вполне успешных и безопасных генных терапий. А в качестве основы для вирусных векторов чаще всего используются ретро-, ленти-, адено- и аденоассоциированные вирусы.

Обзор
У вирусов архей семейства Bicaudaviridae вирионы имеют крайне необычную морфологию: к одному или двум концам заостренного капсида прикрепляются белковые хвосты, длина которых может варьировать.
Автор
Редактор
Вирусы заражают все клеточные формы жизни, и археи — не исключение. Хотя сейчас известно гораздо меньше вирусов архей, чем вирусов бактерий и эукариот, разнообразие устройства их вирионов и используемых молекулярных механизмов поражает воображение: некоторые из них имеют вирионы в форме бутылки, у других генетический материал в вирионе хранится в форме А-ДНК, третьи обзавелись уникальным типом биологических мембран или используют для выхода из зараженной археи ранее неизвестные клеточные структуры. Наша статья посвящена этим пока еще малоизученным, но удивительно самобытным генетическим элементам.
Давно прошли те времена, когда археи считались обитателями исключительно тех мест, где никакая другая клеточная жизнь существовать не может, например, горячих источников. В действительности, архей можно найти везде, даже в желудочно-кишечном тракте человека, однако наиболее многочисленны они на глубоководьях морей и океанов. Так, показано, что археи, окисляющие ионы аммония до нитрата (они относятся к типу Thaumarchaeota) являются одной из самых многочисленных клеточных форм жизни в океанах. Неудивительно, что и вирусы архей также очень многочисленны: метагеномный анализ показал, что в некоторых зонах на долю вирусов архей приходится около 10% самых распространенных там вирусов. Объемы клеток архей, которые погибают из-за вирусов, тоже впечатляют: установлено, что в верхних 50 см океанического донного грунта клетки архей, лизированные вирусами, составляют до трети всей ежегодной биомассы погибших микробов, что соответствует 0,3–0,5 гигатоннам углерода ежегодно [1].
Все известные на данный момент вирусы архей имеют геномы, представленные ДНК: одноцепочечной или двухцепочечной, кольцевой или линейной. Недавно, однако, в горячих источниках Йеллоустонского национального парка, которые населены почти исключительно археей Sulfolobus solfataricus, с помощью метагеномики обнаружили вирусный РНК-геном, отдаленно напоминающий эукариотические РНК-вирусы, поэтому, возможно, существуют и РНК-содержащие вирусы архей.
Пока вирусы архей представлены 17 семействами. Стоит отметить, что вирусы архей, вообще-то, составляют две сильно различающиеся группы. К первой относят вирусы, которые структурно и генетически близки к вирусам бактерий и эукариот, а ко второй — вирусы, уникальные для архей и мало похожие на вирусы других клеточных форм. Практически все специфические для архей вирусы поражают представителей типа Crenarchaeota, а вирусы, близкие к бактериофагам и вирусам эукариот, чаще всего паразитируют на археях типа Euryarchaeota [1].
Строение вирусных частиц
Вирусы, специфичные для архей, нередко имеют вирионы необычной формы (рис. 1а).
Так, представители семейства Ampullaviridae имеют вирионы в виде бутылок из-под шампанского, причем поверх белков капсида они обтянуты липидной оболочкой. А у членов семейства Spiraviridae вирионы в виде спиралей. Столь необычная форма вирионов у вирусов этих двух семейств связана с особым способом упаковки генома при помощи белков капсида [1].

Рисунок 1а. Морфология вирионов вирусов, специфичных для архей. Просвечивающая электронная микроскопия.

Рисунок 1б. Морфология вирионов некоторых вирусов архей и бактерий
Некоторые специфичные для архей вирусы имеют веретеновидные капсиды. Среди них у вирусов семейства Fuselloviridae на одном из заостренных концов капсида находится пучок белковых филаментов, а у членов семейства Bicaudaviridae на одном или двух концах капсида — одиночные придатки в виде хвостов. Не менее удивительна морфология вирионов Guttaviridae: у этих вирусов вирионы тоже похожи на веретено, однако один их конец закруглен и имеет каплевидную форму [1].
У многих специфичных для архей вирусов нитчатые вирионы, которые могут нести специальные придатки, предназначенные для распознавания клеток архей. Иногда, как у вирусов семейства Tristromaviridae, капсид сформирован не одним, а тремя типами белков [1].
Некоторые вирусы, специфичные для архей, имеют сферические вирионы, причем иногда поверх капсида находятся липидная мембрана и еще один слой белков, из-за чего частицы принимают икосаэдрическую форму [1].
Вирионы Pleolipoviridae по строению похожи на везикулы, которые образуют многие археи: голая геномная ДНК находится внутри мембранного пузырька, который пронизан белками двух типов. Такие пузырьки могут содержать как одноцепочечную, так и двухцепочечную ДНК линейной или кольцевой формы [1].

Рисунок 2. Морфология вирионов вирусов архей, родственных бактериофагам и вирусам эукариот. Просвечивающая электронная микроскопия.
Чем можно объяснить столь необычную морфологию вирусов архей? Вирионы некоторых из них удалось не только рассмотреть под электронным микроскопом, но и детально изучить с помощью криоэлектронной микроскопии. Так ученые выяснили, что геномы некоторых вирусов архей в капсидах находятся в А-форме! Это первый известный случай, когда А-форма ДНК присутствует в живых организмах в нормальных условиях. Один из вирусов с геномом в виде А-ДНК, AFV1, имеет очень тонкую липидную оболочку с необычным химическим составом — главным ее компонентом является липид глицеролдибифитанилглицеролтетраэфир (GDGT-0), имеющий необычную U-образную конфигурацию (рис. 3). В мембране, состоящей их таких липидов, их гидрофильные головки обращены наружу, а гидрофобные дуги — внутрь. Наряду с фосфолипидным бислоем и монослоем архей такое строение можно считать третьим из известных типов биологических мембран [1].

Рисунок 3. Химическая структура GDGT-0 (вверху), его схематическое представление (внизу слева; красным цветом показаны гидрофильные головки) и модель (внизу справа) в U-образной конформации подпись
Геномы
Все выделенные на данный момент вирусы архей имеют ДНК-геномы (хотя, как отмечалось выше, в горячих источниках Йеллоустона с помощью метагеномики удалось найти РНК-геном возможного вируса архей). В большинстве случаев геном представлен двухцепочечной молекулой ДНК, и лишь у членов семейств Spiraviridae и Pleolipoviridae геномы состоят из одноцепочечной ДНК. Размеры геномов архейных вирусов варьируют от 5300 пар нуклеотидов (п.н.) у клававируса APBV1 (это один из мельчайших известных геномов ДНК-содержащих вирусов) до 143 800 п.н. у миовируса HGTV-1. Как правило, вирусы, специфичные для архей, имеют меньшие геномы, чем вирусы архей, родственные бактериофагам и вирусам эукариот [2].
Механизмы репликации геномов вирусов архей экспериментально изучены лишь для небольшого числа вирусов. Известно, что ДНК представителей порядка Caudovirales (которые, кстати, имеют самые большие геномы среди архейных вирусов) кодирует часть или даже все компоненты аппарата репликации ДНК: ДНК-полимеразы, белки скользящего зажима (PCNA), праймазы и хеликазы. Имеющие более скромные размеры геномов вирусы архей, как правило, кодируют белки, которые необходимы для привлечения аппарата репликации клетки-хозяина. Стоит, однако, отметить, что в геномах многих вирусов, специфичных для архей, не удалось найти белки, связанные с репликацией ДНК, так что они либо полностью зависимы от аппарата репликации клетки-хозяина, либо используют уникальные, пока еще не изученные механизмы репликации ДНК. Например, удалось показать, что и инициация, и терминация репликации генома липотриксвируса AFV1 связаны с рекомбинационными процессами [1].
Механизмы упаковки генома в капсид у вирусов архей детально не изучены. Тем не менее известно, что члены порядка Caudovirales имеют гомологи терминазы, которая упаковывает геномную ДНК в пустой капсид. Механизм формирования вирионов с использованием терминазы используют также вирусы бактерий и эукариот. Можно предположить, что упаковка генома в капсид у вирусов архей протекает так же, как и у бактериофагов и вирусов эукариот, а вот в плане репликации ДНК вирусы архей или целиком зависят от клетки-хозяина, либо используют уникальные, пока еще не изученные механизмы [1].
Взаимодействие с клеткой-хозяином
Выход зрелых вирионов из клетки архей во многих случаях напоминает отпочковывание от эукариотической клетки-хозяина у вируса гриппа, ВИЧ и вируса Эбола. Когда вирион покидает клетку археи, он забирает с собой фрагмент ее мембраны, который становится дополнительной оболочкой поверх капсида. У некоторых вирусов архей финальные стадии созревания вирионов происходят уже после выхода из клетки, когда капсид претерпевает морфологические перестройки [1].
У некоторых вирусов архей (а именно, представителей семейств Rudiviridae и Turriviridae) все стадии созревания вириона проходят в цитоплазме клетки. Новые вирусные частицы покидают клетку через специальные структуры с семиосевой симметрией на их поверхности, которые получили название вирусассоциированных пирамид (virus-associated pyramids, VAP). VAP образуются на внутренней поверхности мембраны зараженной клетки, проходят сквозь ее поверхностный S-слой и открываются на финальных этапах инфекции, давая возможность вирионам выйти из клетки (рис. 4) [1].

Рисунок 4. Вирусассоциированная пирамида. а и б — Пирамида на поверхности клетки археи Pyrobaculum oguniense в закрытой (а) и открытой (б) конформациях. в и г — Открытая пирамида вируса SIRV2 на поверхности Sulfolobus islandicus. а–в — Визуализация с помощью трансмиссионной электронной микроскопии. г — С помощью электронной криотомографии (CryoET).
Выход некоторых вирусов архей из клетки сопровождается ее лизисом. К их числу относятся вирусы семейства Tristromaviridae, которые, хотя и развиваются целиком в цитоплазме, каким-то образом ухитряются приобрести липидную оболочку. Примечательно, что сифовирус ψM2 кодирует фермент псевдомуреинэндоизопептидазу, который разрушает псевдомуреиновую клеточную стенку археи [1].
Эволюция и родственные связи
Вирусы, специфичные для архей, как правило, заражают только представителей типа Crenarchaeota. Они отличаются от всех других вирусов не только нестандартной морфологией вирионов, но и генетически: около 90% их генов не имеет гомологов в существующих базах данных. В геномах некоторых архейных вирусов не удалось найти ни одного белка, для которого существовал бы функционально охарактеризованный белок-гомолог.
Иногда, если гомологию не удается установить по нуклеотидным или аминокислотным последовательностям, на помощь приходят пространственные структуры. Действительно, для различных белков вирусов архей получили пространственные структуры, но ситуация от этого не стала яснее: оказалось, что во многих из них содержатся совершенно уникальные структурные мотивы. Более того, функции многих генов вирусов архей совершенно непонятны: так, оказалось, что фузелловирус SSV1 может спокойно обойтись без половины своих генов. Можно предположить, что такие неохарактеризованные гены-сироты кодируют белки, участвующие во взаимодействии вируса с клеткой архей, например, противодействующие системам CRISPR-Cas [1].
Впрочем, многие вирусы архей родственны некоторым бактериофагам и вирусам эукариот. Однако вирусы, специфичные для архей, стоят особняком среди всех ДНК-содержащих вирусов. Более того, различные группы вирусов, специфичных для архей, неродственны друг другу и эволюционируют независимо друг от друга. Высказывается предположение, что некоторые группы специфичных для архей вирусов появились на заре эволюции клеточной жизни и были впоследствии утрачены бактериями и эукариотами. Другие группы специфичных архейных вирусов могли появиться в момент обособления домена архей или даже позже, в отдельных группах архей [1].
Любопытно, что некоторые вирусы архей родственны лишенным капсидов мобильным генетическим элементам (например, плазмидам) . Эти вирусы, так же как и мобильные генетические элементы, имеют родственные гены основных белков репликативного аппарата [1], [2].
Несмотря на то, что мы только-только начинаем приподнимать завесу тайны над вирусами архей, многие уже известные особенности их морфологии или генетического аппарата поражают воображение. Несомненно, дальнейшее изучение вирусов архей при помощи метагеномики и других подходов подарит нам множество сюрпризов.
И это неудивительно хотя бы потому, что вирусы — штука довольно непонятная. Неясно даже, считать их живыми или нет. С одной стороны, это просто хрупкий набор молекул, который не может существовать автономно, без живой клетки. Он не производит и не накапливает энергии, а также не поддерживает постоянства внутренней среды — ее попросту нет. Но когда вирус попадает в клетку, он проходит жизненный цикл, копирует себя и эволюционирует. Невидимое глазу нечто существует в огромном количестве, постоянно меняется, переходит от одних хозяев к другим и причиняет страдания разной степени тяжести всему человечеству.
Как устроены вирусы?
РНК-содержащие вирусы можно разделить на собственно РНК-вирусы и ретровирусы. Первые — это вирусы гриппа, бешенства, гепатита С, а также коронавирусы и вирус Эбола. Они содержат РНК и используют для размножения РНК-зависимую РНК-полимеразу, с ее помощью на исходной молекуле РНК сразу синтезируется новая. А к ретровирусам относится, например, ВИЧ. Он содержит РНК, но в ходе жизненного цикла она превращается в ДНК и встраивается в геном клетки-хозяина. После чего новая РНК синтезируется уже на основе молекулы ДНК — то есть так же, как у нас.
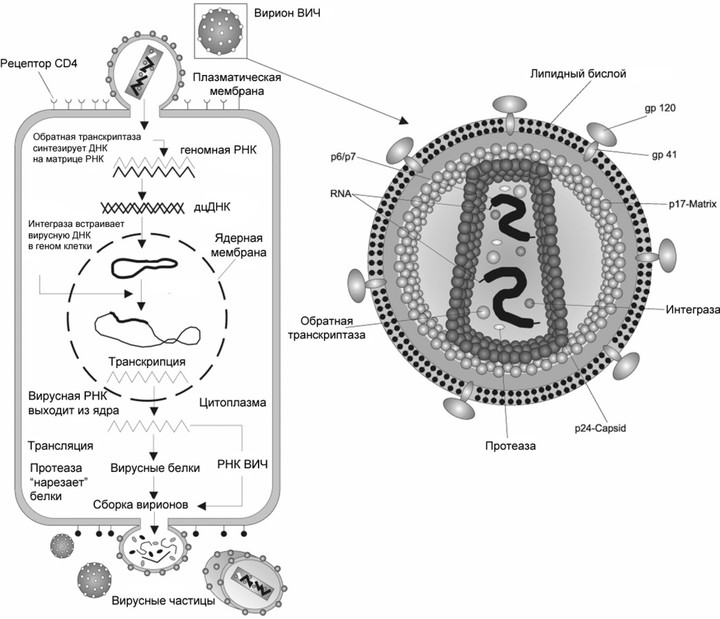
Жизненный цикл вируса, на примере вируса иммунодефицита
Как с ними бороться?
Еще одна стратегия — активная и пассивная иммунопрофилактика. Активная — это простая и всем знакомая вакцинация. Человеку вводят неактивную форму вируса или его кусочек, в организме срабатывает иммунный ответ и синтезируются антитела, которые защитят человека в будущем, если он когда-нибудь встретится с настоящим живым вирусом. Но вакцину не всегда можно создать, да и уже существующие порой не работают на все сто. Так, вакцина от гриппа защищает только от нескольких — самых распространенных в текущем сезоне — штаммов (видов) вируса. Пассивная иммунопрофилактика — это введение готовых антител тем, кто уже встретился с вирусом или с большой вероятностью сделает это. Такие лекарства существуют для респираторно-синцитиального вируса (рекомендованы недоношенным младенцам) и ветряной оспы (для людей с подавленным иммунитетом).
И, наконец, последняя стратегия на случай, если ничто не помогло и человек заболел, — антивирусные препараты. Их развитие подстегивали научный прогресс и насущные проблемы. Чтобы придумать противовирусный препарат, нужно сначала изучить вирус и его жизненный цикл и выбрать возможные мишени для атаки. Причем такие, чтобы они как можно сильнее отличались от человеческих аналогов. Иначе лекарство будет бороться и с вирусами, и с невинными человеческими клетками, вызывая сильные побочные эффекты.
В 80-е произошло другое громкое открытие — вирус иммунодефицита человека. Это породило шквал научных работ, посвященных разработке новых противовирусных лекарств. К тому времени связанный с ним СПИД уже распространился по миру, а в США началась эпидемия.
Какие бывают антивирусные препараты?
Их можно разделить на 13 групп, причем к шести относятся различные лекарства против ВИЧ. Это ингибиторы входа вируса в клетку, вирусных ферментов интегразы и протеазы, а также три вида ингибиторов вирусного фермента обратной транскриптазы, или ревертазы. Все они действуют на разные этапы жизненного цикла вируса:
1. Проникновение в клетку
Это первое, что должен сделать вирус, попав в организм. То, какую клетку он поразит, определяется рецептором на ее поверхности. У ВИЧ это рецептор CD4, который есть у Т-хелперов, макрофагов, а также некоторых других видов клеток. Кроме него в связывании вируса и его проникновении участвуют: рецепторы CXCR4 и CCR5 со стороны клетки и поверхностные гликопротеины gp120 и gp41 — со стороны вируса.
Сейчас FDA (американское Управление по санитарному надзору за качеством пищевых продуктов и медикаментов) одобряет четыре лекарства, работающие на этой стадии. Каждый связывается с каким-то из участников процесса и мешает его работе. Например, к этой группе принадлежит самый новый препарат против ВИЧ — фостемсавир, его одобрили в США в июле 2020 года. В организме он превращается в активную форму темсавир, соединяется с вирусным гликопротеином gp120 и мешает ему связаться с клеточным рецептором CD4. Другой препарат — ибализумаб — связывается с самим CD4, причем так, что рецептор не может участвовать в проникновении вируса, но выполняет свою нормальную иммунную функцию — связывает и узнает антигены на поверхности антигенпрезентирующих клеток.
Подобные препараты также используются для лечения респираторно-синцитиального вируса, вирусов ветряной оспы и простого герпеса. Они тоже действуют на вирусные гликопротеины и их связывание с клеточными рецепторами. К этой же группе можно отнести препараты для пассивной иммунопрофилактики антителами.
2. Подготовка к размножению, часть 1
Когда вирус попал в клетку, он должен в ней размножиться, то есть создать копии себя, используя ресурсы самой клетки. Так как ВИЧ — ретровирус, его генетический материал — РНК, которая должна достроиться до двухцепочечной ДНК и встроиться в ДНК клетки. Процесс достраивания называется обратной транскрипцией, и для него необходим вирусный фермент обратная транскриптаза, ее еще называют ревертазой. Это самая популярная мишень препаратов против ВИЧ, которые делятся на две группы: нуклеозидные и ненуклеозидные.
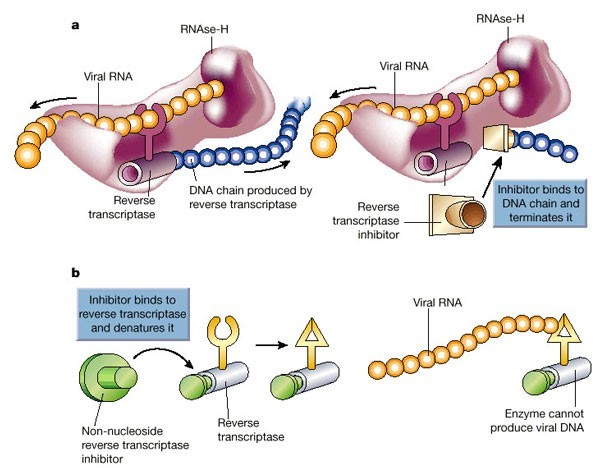
Механизм дейсвтия ингибиторов обратной транскриптазы
3. Подготовка к размножению, часть 2
Чтобы наконец размножиться, ВИЧ, уже в виде молекулы ДНК, необходимо встроиться в геном клетки-хозяина. В этом участвует другой вирусный фермент — интеграза. Ее ингибируют несколько одобренных лекарств, причем они часто используются вместе с другим препаратом — кобицистатом. Он никак не действует на вирус, но ингибирует некоторые ферменты печени и увеличивает биодоступность самих антивирусных препаратов.
4. Созревание
Другие препараты
Есть три группы антивирусных препаратов, которые мы еще не упоминали. Во-первых, это ингибиторы белков NS5A и NS5B вируса гепатита С, которые играют важную роль в репликации РНК вируса. Во-вторых, лекарства против вируса гриппа: три ингибитора вирусного белка нейраминидазы и один ингибитор РНК-полимеразы вируса. И, наконец, сборная солянка препаратов, которые не действуют прицельно на вирусные компоненты. Это интерфероны, а также иммуностимуляторы и ингибиторы митоза клеток.
Первые заслуживают особого внимания из-за обилия отечественных лекарств против гриппа и простуды на их основе. FDA одобряет инъекции (!) интерферонов только для лечения гепатита B и С, причем на практике они используются очень осторожно из-за серьезных побочных эффектов. Отечественные противовирусные препараты с интерферонами, которые выпускаются в форме мазей, спреев и суппозиториев, вряд ли работают. И слава богу. Иммуностимуляторы и ингибиторы митоза клеток выпускаются в виде мазей и используются для лечения генитальных бородавок, то есть папилломавируса человека.
Наука не стоит на месте, и разработка противовирусных препаратов продолжается, подстегиваемая новыми вирусами, эпидемиями, а также развитием резистентности к существующим лекарствам. Но по-прежнему самыми изученными и многочисленными препаратами остаются ингибиторы вирусных обратной транскриптазы или ДНК-полимеразы и протеазы. Для разработки других стратегий борьбы ученым еще предстоит изучить детали работы вирусов — как давно известных, так и совершенно новых.
Да, вирусы остаются источником зловещих идей в популярной культуре. Но существующих препаратов и методов уже достаточно, чтобы мы могли избежать заражения, быстро вылечиться или свести негативные последствия болезни к нулю.
Читайте также:

