Факторы влияющие на чувствительность животных к вирусам
Обновлено: 25.04.2024
Вирусы являются внутриклеточными инфекционными агентами. Весь репликативный цикл вируса осуществляется с исполь зованием метаболических и генетических ресурсов клеток. Поэтому патогенез вирусных инфекций, в первую очередь, следует рассматривать на молекулярном и клеточном уровнях (В.И. Покровский, О.И. Киселев, 2002). Вместе с тем, инфекционный процесс, вызванный вирусами, развивается в пределах того или иного органа или ткани, так как большинство вирусов обладают достаточно высокой органной или тканевой тропностью. Поэтому характер развития внутритканевых процес сов при вирусных инфекциях, с одной стороны, определяется, как правило, цитопатическим действием вируса на клетки данной ткани и органа, а с другой стороны, реакцией внутритканевых и органных систем защиты от вирусной инфекции. Последние не редко носят деструктивный характер и усугубляют течение забо левания и его последствия. Поэтому понимание патогенеза вирусных инфекций представляется исключительно важным для создания рациональных схем лечения, основанных на гармоничном сочетании симптоматического лечения и противовирусной химиотерапии.
Стадии репликативного цикла вируса гриппа представлены на рис. 1. Такой же репликативный цикл свойствен большинству РНК- и ДНК-содержащих вирусов, кроме тех, кото рые обладают особыми механизмами хронизации процесса, латенции и способностью к интеграции в клеточный геном (например, ВИЧ, гепатит С, вирус папилломы и.т.). Ключевыми стадиями репликативного цикла вируса являются проникновение в клетки, декапсидация, активация процессов транскрипции и трансляции, собственно репликация вирусного генома и созревание зрелых вирусных частиц с выходом нового потомства инфекционного вируса.
Проникновение вируса в клетки - одна из ключевых стадий патогенеза инфекционного процесса. Для большинства вирусов степень цитопатического действия вируса прямо зависит от множественности заражения. В естественных условиях инфицирова ние клеток вирусами не происходит обычно с высокой множе ственностью. Исключение составляют респираторные вирусы, которые передаются воздушно-капельным путем с высокой инфицирующей дозой. ВИЧ и гепатиты, наоборот, эффективно передаются с кровью в самых незначительных трудно определяе мых титрах. Такие вирусы имеют особые свойства, определяющие их контагиозность.
Для проникновения вируса в клетку, необходимо: высокое сродство к вирусоспецифическому рецептору; множественность рецепторов; эффективность слияния вируса с клетками при инфицировании; способность к образованию синцития, к образованию гигантских синпластов, состоящих из множества слившихся клеток, в которых вирусный нуклеопротеид без эндоцитоза беспрепятственно переходит от одной зараженной клетки к множеству других через цитоплазму.
Такими свойствами из респираторных вирусов обладает респираторно-синцитиальный вирус, а среди ретровирусов – вирус иммунодефицита человека.
Стадии жизненного цикла вируса гриппа и соответствующие ингибиторы репродукции в известной степени могут быть экстраполированы на многие другие вирусы, за исключением тех, жизненный цикл которых включает интеграцию в клеточный геном. В процессе репликации вирусов обычно происходит селективная блокада трансляции клеточных мРНК и активация экспресси клеточных генов, кодирующих провоспапительные лимфокины. Многократные раунды репликации вирусного генома приводят к истощению энер гетических ресурсов клеток и пула предшественников азотистых оснований. Повышенное содержание провоспалительных лимфокинов приводит к развитию воспалительной реакции и локально му генерированию свободных радикалов, оказывающих, в свою очередь, повреждающее действие на клетки и ткани через перекисное окисление липидов клеточных мембран, инактивацию жизненно важных ферментов. Поэтому одним из важнейших факторов патогенности вирусов является их репликативный потенциал: чем активнее происходит репликация, тем сильнее цитопатическое действие вирусов на клетки и пораженную ткань (орган).
Значительный вклад в цитопатическое действие вирусов вносит репродукция вирусов в митохондриях, что сопровождается нарушением функций этих органоидов, падением продукции АТФ и индукцией опосредованного митохондриями пути апоптоза.
Впервые возможность репродукции вирусов в митохондриях была доказана выдающимся отечественным вирусологом В.М. Ждановым. Узкий тропизм вирусов, в известной степени, спасителен для организма, так как инфекционный процесс ограничен одним органом.
Это обстоятельство позволяет, проводит рациональную симптоматическую терапию, направленную на защиту данной ткани или органа и ориентировать противовирусные средства в данный орган, например, легкие.
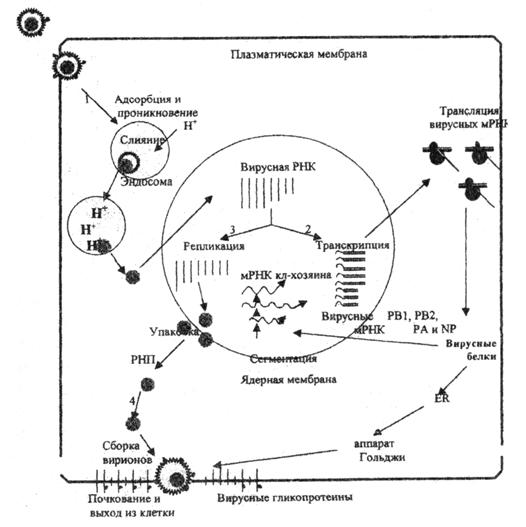
Рис. 1. Репликативный цикл вируса гриппа (В.И.Покровский, О.И.Киселев, 2002)
Представлены 4 основные фазы репликативного цикла вируса гриппа: 1 – адсорбция и проникновение вируса в клетку хозяина; 2 – транскрипция вирусной РНК и трансляция вирусных белков; 3 – репликация вирусной РНК и 4 – самосборка вирионов и последующий выход их из клетки.
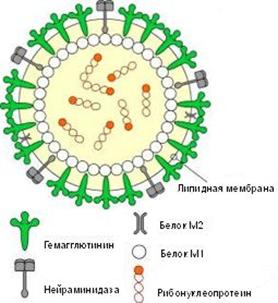
Рис. 2. Схематическое строение вируса гриппа
Гемаглютинин и нейраминидаза являются факторами агрессии вируса гриппа. Интенсивность интоксикации при гриппе определяется свойствами гемаглютинина, а нейраминидаза обладает выраженным иммунодепресивным действием. Оба поверхностных антигена характеризуются выраженной способностью к изменчивости, в результате чего появляются новые антигенные варианты вируса. Гемаглютинины 1, 2, 3 типов и нейраминидазы 1, 2 типов содержат вирусы, которые поражают человека. Другие антигены характерные для вирусов гриппа животных (свиней, собак, лошадей, многих видов птиц и др.).
Вирусы гриппа А. Эти возбудители более вирулентны и контагиозны, чем вирусы гриппа В и С. Это обусловлено тем, что вирус А содержит 2 типа нейраминидазы (N1, N2) и 4 –гемаглютинина (H0, H1, H2, H3); вирус В – 1 и 1 соответственно, поэтому он имеет лишь антигенные варианты внутри одного серотипа; вирус С содержит только гемаглютинин и не содержитнейраминидазу, но он имеет рецептор, который разрушает энзим. Вирусу С не свойственная изменчивость.
Одновременно циркулируют и имеют эпидемическое распространение 2 подтипа вируса гриппа А H3N2 и H1N1. На сегодняшний день во всем мире доминирует вариант А/Сидней/05/97, А/Берн/07/95 и А/Пекин/262/95. Характерной чертой современных вирусов гриппа А (H3N2) является изменение ряда их биологических свойств: тяжело размножаются в куриных эмбрионах, не агглютинируют эритроциты кур, взаимодействуют только с эритроцитами человека или морской свинки, имеют низкую иммуногенную активность.
Вирусы гриппа В выделяются только от людей. По вирулентности и эпидемиологической значимости они уступают вирусам гриппа А. По антигенным свойствам гемаглютинин инейраминидазу вируса В можно разделить на 5 подтипов. Их изменчивость носит более постепенный и медленный характер, что объясняет эпидемиологические особенности вируса гриппа В (эпидемии возникали 1 раз в 3-4 года до 1988 г.). В мире сейчас циркулируют 2 варианта вируса гриппа В: В/Пекин/184/93 (Европа, Америка, Африка, Австралия) и В/Виктория/2/87 (Юго-Восточная Азия). Характерной чертой современных вирусов гриппа А и В является их высокая чувствительность к ингибиторам гемаглютинирующей и инфекционной активности, которые содержатся в сыворотке крови нормальных животных.
Вирусы гриппа С . Вирусы гриппа С, в отличие от вирусов А и В, не вызывают эпидемий, но они могут быть причиной вспышек в организованных детских коллективах. Подъемы заболеваемости гриппом С нередко предшествуют или сопровождают эпидемии гриппа А и В. У детей раннего возраста и более старших возрастных группах он приводит к заболеваниям в легкой ибессимптомной форме.
Для вирусов гриппа С характерна значительно большая стабильность антигенных и биологических свойств. По ряду биологических характеристик эти возбудители отличаются от других представителей семейства ортомиксовирусов. Им присуща низкая репродуктивная активность в разных клеточных системах и наличие других, чем у вирусов гриппа А и В, рецепторов на поверхности эритроцитов. Рецептор-деструктирующая активность связана не с нейраминидазой, как у вирусов гриппа А и В, а с ферментом нейраминат-0-ацетилестеразою.
Сложность этиологии усиливают факты выделения от людей вирусов, которые не свойственные человеку. Гены вируса гриппа (H5N1), выделенные в 1997 году от человека в Гонконге, оказались подобными генам птичьего вируса, который преодолел межвидовой барьер. Оказалось, что человеческие и птичьи вирусы гриппа были реасортантами (рекомбинантные штаммы), которые получили внутренние гены РВ1 и РВ2 от перепелиного вируса гриппа А (H9N2) – штаммы А/перепел/Гонконг/61/97.
Вирусы гриппа малоустойчивы во внешней среде, в течение нескольких часов при комнатной температуре разрушаются. Под действием дезинфицирующих растворов (спирта, формалина, сулемы, кислот, щелочей) они быстро погибают. Нагревание до 50-60°С инактивирует вирусы в течение нескольких минут, в замороженном состоянии при температуре -70° С они сохраняются годами, не теряя инфекционных свойств, быстро погибают под воздействием ультрафиолетового излучения. Оптимум размножения вируса происходит при +37°С в слабощелочной среде. Как и другие вирусы, возбудитель гриппа отнюдь не чувствительный к антибиотикам и сульфаниламидам.
Вирус гриппа не растет на обычных питательных средах. Его можно выделить из материала, который получен от больного в первые дни болезни (смывы из носоглотки, мокроты), путем заражения культур или клеток куриных эмбрионов.
Традиционно считалось, что человеческий организм освобождается от возбудителя в ближайшие дни после выздоровления. Однако постепенно накапливались косвенные свидетельства, которые опровергают эту точку зрения. И в 1985 г. были получены прямые доказательства формирования длительной персистенции вируса гриппа. У одного человека удалось многократно выделять вирус гриппа в течение 9-ти месяцев и дольше. Возможность пожизненной персистенции вируса в организме человека продолжает изучаться.
1. Грипп и другие респираторные вирусные инфекции / под ред. О.И. Киселева, И.Г. Мариничева, А.А. Сомининой. – СПб. – 2003.
2. Дриневский В.П., Осидак Л.В., Цыбалова Л.М. Острые респираторные инфекции у детей и подростков // Практическое руководство под редакцией О.И. Киселева. – Санкт-Петербург. – 2003.
3. Железникова Г.Ф., Иванова В.В., Монахова Н.Е. Варианты иммунопатогенеза острых инфекций у детей. – Санкт-Петербург. – 2007. – 254 с.
4. Ершов Ф.И. Грипп и другие ОРВИ // Антивирусные препараты. Справочник. – М., 2006. –С. 226-247.
5. Ершов Ф.И., Романцов М.Г. Антивирусные средства в педиатрии. – М., 2005. – С.159-175.
6. Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы (от молекул до лекарств). – М., 2005. – С. 287-292.
7. Иванова В.В. Острые респираторно-вирусные заболевания // Инфекционные болезни у детей. – М., 2002.
8. Онищенко Г.Г., Киселев О.И., Соминина А.А. Усиление надзора и контроля за гриппом как важнейший элемент подготовки к сезонным эпидемиям и очередной пандемии. – М., – 2004. – С.5-9.
9. Об утверждении стандарта медицинской помощи больным гриппом, вызванным идентифицированным вирусом гриппа (грипп птиц) // Приказ Минздравсоцразвития №460 от 07.06.2006 г.
10. Романцов М.Г., Ершов Ф.И. Часто болеющие дети: Современная фармакотерапия. – М., 2006. – 192 с.
11. Стандартизированные принципы диагностики, лечения и экстренной профилактики гриппа и других острых респираторных инфекций у детей / под ред. О.И. Киселева. – СПб. – 2004. – С. 82-95.
12. Лекарственные средства в фармакотерапии патологии клетки / под редакцией Т.Г. Кожока.-М., 2007.
Тропизм – склонность вируса к тому или иному вороту инфекции. При респираторных инфекциях – вирус локализуется в носоглотке, трахее и легких; при энтеровирусных – в кале; при нейротропных – в ГМ или СМ; при дермотропных – в коже.
Патогенез вирусных инфекций.
Под патогенезом понимают совокупность процессов, вызывающих заболевание, его развитие и исход.
2.Количеством инфекционных частиц
3.Реакцией клетки на инфекцию.
4.Реакция организма на изменение клеток и тканей.
В основе тропизма вирусов лежит чувствительность к вирусу определенных клеток.
Патогенез обусловлен основными механизмами взаимодействия вирусов с клетками:
- атрофия или дистрофия (ЦПД)
- образование телец включений
- образование симпластов и синцитиев
- латентная (хроническая) инфекция.
Под инфекцией понимают состояние зараженности макроорганизма. Это комплекс процессов, происходящих при взаимодействии инфекционного агента с организмом хозяина. В связи с тем, что вирусы являются внутриклеточными паразитами в основе их взаимодействия с организмом всегда лежит инфекционный процесс на уровне клетки, который реализуется путем взаимодействия вирусного и клеточного генома, поэтому возможно классифицировать инфекцию как на клеточном, так и на организменном уровне.
Патогенез на клеточном уровне – сюда входит ЦПД (видимые морфологические изменения клеток под воздействием того или иного вирусного агента). Характер ЦПД различен и зависит от:
2.Биохимических свойств вируса
Характер ЦПД оценивается по 4-х бальной системе крестовой и учитываются изменения, когда используются культуры клеток для титрования (т.е.).
Патогенез на организменном уровне.
Состояние инфекции как всякого биологического процесса динамично, динамку взаимодействия обычно называют инфекционным процессом. С одной стороны инфекционный процесс включает: внедрение, размножение и распространение возбудителя в организме, а также патогенное действие, а с другой стороны реакцию организма на это действие.
Патогенное действие возбудителя может быть неодинаковым. Оно проявляется в форме инфекционной болезни различной тяжести, в другом без ярко выраженных клинических признаков в третьих проявляется лишь изменениями, выявленными вирусологическими, биохимическими, иммунологическими методами. Это зависит от:
- количества и качества возбудителя, проникшего в восприимчивый организм, условий внутренней и внешней среды, определяющих резистентность животного и характеризуются взаимодействием микро и макроорганизмов. По характеру взаимодействия возбудителя болезни и организма выделяют 3 формы:
1.инфекционная болезнь – это инфекционный процесс, характеризуется определенными клиническими признаками, а также нарушениями, функциональными расстройствами и морфологическими повреждениями тканей.
2.Микробоносительство – иммунологическая субинфекция. Дифференцированный подход к различным формам инфекции дает возможность правильно вести диагностику инфекции выявлять зараженных животных в неблагополучном стаде. Патогенез любой инфекционной болезни определяется специальным действием возбудителя и ответными реакциями организма, зависящими от условий, в которых происходит взаимодействие микро и макроорганизма. При этом немаловажное значение имеют пути проникновения и распределения возбудителя. Ворота возбудителя: кожа, слизистые, мочеполовая система, плацента.
Каждый вид возбудителя эволюционно приспособился к таким путям внедрения, которое обеспечивает благоприятные условия для размножения и распространения – входные ворота для каждой инфекции характеризуется специфичностью. Чтобы проводить профилактику необходимо учитывать специфичность ворот инфекции. Например, при ИНАН возбудитель проникает через кожу при укусе насекомых. При ящуре основной путь алиментарный, при бешенстве – через покус.
Классификация вирусных инфекций.
Различают автономные и интегрированные инфекции. Автономные - при этом вирусный геном реплицируется независимо от клеточного генома. Автономная инфекция характерна для большинства вирусов.
Интегрированные инфекции – вирусный геном включается в состав клеточного генома, т.е. интегрируются в клеточный геном и реплицируются вместе с ним. При этом вирусный геном реплицируется и функционирует как составная часть клеточного генома. Интегрировать может как полный геном так и часть. При интегрированных инфекциях нет ни сборки вирусных частиц ни выхода.
Автономная инфекция – клетка иногда приобретает способность к неограниченному делению в результате нарушения регулирующих механизмов, контролирующих деление. Это чаще наблюдается при онкогенных инфекциях.
Продуктивная и абортивная инфекции:
1.Продуктивная – завершается выходом инфекционного потомства.
2.Абортивная - инфекционного потомства не образуется или его мало.
Формы течения – как и продуктивная, так и абортивная могут протекать в острой и хронической форме. Острая инфекция – это инфекция, в результате которой клетка либо выздоравливает либо погибает. Острая инфекция на клеточном уровне может быть цитолитической (когда происходит гибель клетки).
Хроническая инфекция – это инфекция, при которой клетка продолжает продуцировать вирусные частицы в течение длительного времени и предает эту способность дочерним клеткам. Чаще хроническую форму приобретает абортивная инфекция т.к. вирусный материал накапливается и передается дочерней клетке.
Смешенная инфекция – клетка заражается двумя или несколькими разными вирусами, в результате чего в клетке могут совмещаться два и более инфекционных процесса. Возможно несколько вариантов взаимодействия вируса в процессе смешанной инфекции:
1.Интерференция – один вирус подавляет действие другого.
2.Комплементация (экзальтация) – один вирус усиляет действие другого.
Классификация вирусных инфекций на организменном уровне.
В основу классификации положено:
3.Проявление клинических симптомов
4.Выделение вирусов в окружающую среду
Одна из форм может переходить в другую (например, очаговая в генерализованную, острая в хроническую).
Вирус действует вблизи входных ворот инфекции, в связи с локальной репродукцией. Они имеют более короткий скрытый период по сравнению с генерализованными.
После ограниченного периода репродукции в первичных очагах происходит генерализация инфекций – вирусы проникают в другие системы, например при ящуре, полиомиелите, оспе.
Длится непродолжительный период и протекает с выделением в окружающую среду. Заканчивается гибелью или выздоровлением.
При продолжительном взаимодействии вируса с организмом. Она может быть латентная, хроническая, медленная.
Латентная инфекция – не сопровождается выделением вируса в окружающую среду, при определенных условиях может переходить в острую и хроническую.
При гриппе, сепсисе, СПИДе и др.
Это длительно текущий процесс. Характеризуется периодами ремиссии (аденовирус, герпес).
Медленные инфекции – своеобразное взаимодействие вируса с фагом и характеризуется длительными инкубационными периодами.
При изучении любого инфекционного заболевания важно знать источник, место постоянного обитания и размножения, пути распространения, место и сроки сохранения, возникновения во внешней среде, способы передачи от больных к здоровым.
Естественная среда – живой организм, здесь он находит все условия существования. Длительность пребывания вирусов колеблется в значительных пределах и зависит от биологических свойств, реактивности организма. От условий патогенеза. Источники инфекции – только зараженные организмы. Они играют роль лишь в процессе передачи. Большинство животных выделяют вирусы с экскретами, секретами, кровью, истечениями, мокротой. При большинстве вирусных инфекций в основе патогенеза лежит вирусемия (ящур, чума и др). При этих заболеваниях вирус выделяется всеми возможными путями. При хроническом течении вирусовыделение менее интенсивно, но может быть длительным. При вирусных заболеваниях локализация ограничивается одним путем: пневмонии – с каплями мокроты. Самое интенсивное выделение вируса во внешнюю среду наблюдается в острый период заболевания, однако при ряде заболеваний и в инкубационный период. Бессимптомные инфекции протекают при вакцинировании живыми вакцинами.
Инфекция — внедрение и размножение в организме инфекционного агента (возбудителя) с развитием инфекционного процесса.
Инфекционный процесс — процесс использования инфекционным агентом (возбудителем) организма хозяина (человека, животного) в качестве среды обитания и воспроизводства. Взаимодействие инфекционного агента и хозяина проявляется клинически выраженным заболеванием или носительством возбудителя. Это комплекс взаимных приспособительных реакций в ответ на внедрение и размножение патогенного микроорганизма в макроорганизме, направленный на восстановление нарушенного гомеостаза и биологического равновесия с окружающей средой. Развитие инфекционного процесса носит этапный характер.
Течение и исход инфекционного процесса определяют особенности возбудителя и состояние макроорганизма.
К важнейшим свойствам микроорганизмов, способных вызывать инфекционный процесс, относят патогенность, вирулентность, адгезивность, инвазивность, токсигенность.
Патогенность – видовой генетический признак возбудителя, его потенциальная возможность вызывать при благоприятных условиях специфический инфекционный процесс.
Фактически все возбудители инфекционных заболеваний являются патогенными, но чтобы вызвать заболевание, они должны обладать вирулентностью. Патогенность и вирулентность – это различные понятия. Микроорганизм считается вирулентным, если он при внедрении в организм животного, даже в малых дозах, вызывает развитие инфекционного процесса. Например, никто не сомневается в патогенных свойствах возбудителя сибирской язвы, однако среди культур этого микроорганизма встречаются авирулентные штаммы, не способные вызвать заболевания у животного.
Вирулентность – это степень патогенности конкретного микроорганизма, т.е. это индивидуальный признак. Вирулентность – это величина, которая подвергается измерению. За единицу измерения вирулентности условно приняты летальная и инфицирующая дозы. Минимальная смертельная доза (DLM) – это наименьшее количество живых микробов или их токсинов, вызывающее за определенный срок гибель большинства животных одного вида, взятых в опыт. Поскольку индивидуальная чувствительность животных к патогенному микробу (токсину) различна, то была введено понятие безусловно смертельная доза (DCL) - это наименьшее количество микроорганизмов, вызывающая гибель 100% зараженных животных. Наиболее точная единица вирулентности средняя летальная доза (LD50) – это наименьшее количество микроорганизмов (токсинов), вызывающая гибель половины животных в опыте. Для установления средней летальной дозы возбудителя принимают во внимание способ введения возбудителя, возраст подопытных животных, их массу.
У одного и того же микроорганизма вирулентность может значительно колебаться в зависимости от ряда биологических, физических и химических факторов, воздействующих на него. Вирулентность микроорганизма можно усилить или ослабить искусственными приемами. Ослабление вирулентности вызывает длительное выращивание культур вне организма на питательных средах при максимальной температуре, действие химических веществ (например, антисептиков: карболовая кислота, щелочь, желчь и т.д.). кроме того ослабление возбудителя вызывает длительное пассажирование (последовательное проведение) через организм определенного вида животного путем переноса возбудителя от больного животного к здоровому. Вирулентность микроорганизмов тесно связана с токсигенностью и инвазивностью. Токсигенность – это способность микроорганизма образовывать токсины, которые отрицательно воздействуют на макроорганизм, изменяя его метаболические функции. Токсигенность обеспечивается способностью микроорганизмов синтезировать ряд веществ с токсическими функциями.
Инвазивность – способность микроорганизма преодолевать защитные барьеры организма, проникать в органы, ткани и полости, размножаться в них, подавлять защитные средства макроорганизма. Инвазионные свойства патогенных бактерий обеспечиваются за счет микробных ферментов (гиалуронидаза), капсул, специальных структур клетки, обладающих антифагоцитарным и адгезивным действием.
Патогенные свойства микроорганизмов обеспечиваются рядом факторов. Под факторами патогенности понимают приспособительные механизмы возбудителей инфекционных болезней к меняющимся условиям макроорганизма, синтезируемые в виде специализированных структурных или функциональных молекул, при помощи которых они участвуют в осуществлении инфекционного процесса.
Острый инфекционный процесс имеет циклическое течение:
период адаптации в месте проникновения или в пограничных областях
колонизация — при наличии благоприятных условий для возбудителя происходит генерирование его новых поколений и распространение возбудителя за пределы первичного очага;
фазы пенетрации и диссеминации — распространение возбудителей происходит не только по определенной поверхности или на участках колонизации, но и вглубь клеток, тканей, органов.
Периодичность инфекционного процесса обычно соответствует по времени определенному периоду инфекционной болезни от фазы инкубации до периода клинического выздоровления:
Инкубационный период - отрезок времени от момента внедрения возбудителя до появления первых клинических признаков (симптомов) заболевания, варьирующих в широких пределах — от нескольких часов до десятилетий.
Продромальный период - выявляются слабые или более выраженные признаки, часто общие для многих инфекционных болезней, т. е. носящие неспецифический характер, например повышение температуры тела и др.
Стадия нарастания симптомов.
Период расцвета клинических симптомов, разгар болезни
Стадия угасания симптомов.
Патогенез — механизм зарождения и развития болезни и отдельных её проявлений. Рассматривается на различных уровнях — от молекулярных нарушений до организмом в целом.
ПАТОГЕНЕЗ ВИРУСНЫХ ИНФЕКЦИЙ
Под инфекцией понимают комплекс процессов, происходящих при взаимодействии инфекционного агента с организмом хозяина. Однако в связи с тем, что вирусы являются внутриклеточными паразитами, а точнее, генетическими паразитами, в основе их взаимодействия с организмом всегда лежит инфекционный процесс на уровне клетки, который реализуется путем взаимодействия вирусного и клеточного геномов. Поэтому возможно классифицировать инфекции как на клеточном уровне, так и на уровне организма.
КЛАССИФИКАЦИЯ ВИРУСНЫХ ИНФЕКЦИЙ НА УРОВНЕ ОРГАНИЗМА
В основу классификации положены четыре фактора: 1) генерализация вируса; 2) продолжительность инфекции; 3) проявление клинических симптомов; 4) выделение вируса в окружающую среду.
Вирусные инфекции можно разделить на две большие группы: 1) очаговые, когда действие вируса проявляется у входных ворот инфекции в связи с его локальной репродукцией, и 2) генерализованные, при которых после ограниченного периода репродукции вируса в первичных очагах происходит генерализация инфекции, и вирус достигает чувствительных тканей, формируя вторичные очаги инфекции.
Очаговые инфекции имеют более короткий инкубационный период, чем генерализованные, защитными факторами организма при этих инфекциях являются скорее секреторные антитела класса 1§А, чем антитела гуморальные, а эффективными вакцинами — те, которые стимулируют образование секреторных антител. При генерализованных инфекциях большее значение в защите организма имеют гуморальные антитела. Примером очаговых инфекций являются респираторные и кишечные вирусные инфекции, примером генерализованных — оспа, корь, полиомиелит. Сравнительная характеристика очаговых и генерализованных инфекций

Инфекционный процесс проявляется в виде трех форм: носительство, инаппарантная и манифестная.
ИНАППАРАНТНАЯ ИНФЕКЦИЯ (от лат. in — отрицат. частица и apparens, род. падеж apparentis — проявляющийся, очевидный), непроявленная инфекция, характеризующаяся отсутствием клинич. признаков при остром течении и заканчивающаяся через определённый срок исчезновением возбудителя из организма.
Манифестная форма включает типичный (острая, хроническая, медленная инфекция) и атипичный (стертая, латентная, микст-инфекция) варианты.
Острая инфекция длится относительно непродолжительный период времени и протекает с выделением вирусов в окружающую среду. Окончание инфекции сопровождается элиминацией вирусов благодаря иммунным механизмам. Инфекция может протекать как в клинической, так и в инаппарант-ной форме. Острая инфекция может завершиться выздоровлением или гибелью организма. Она соответствует продуктивной инфекции на уровне клетки.
Хронической инфекцией называется длительно текущий патологический процесс, характеризующийся периодами ремиссий, перемежающимися с периодами обострения, когда вирус выделяется в окружающую среду. Примерами хронической инфекции являются герпетическая, аденовирусная инфекции, хроническая форма вирусных гепатитов и т. д.
Медленные инфекции. Медленные инфекции —это своеобразное взаимодействие определенных вирусов с организмом, характеризующееся длительным инкубационным периодом, тянущимся многие месяцы и даже годы, и последующим медленным, но неуклонным развитием симптомов заболевания, ведущим к тяжелому нарушению функций органов и летальному исходу.
необычно продолжительный (месяцы, годы) инкубационный период;
медленно прогрессирующее течение;
необычность поражения органов и тканей;
абсолютный смертельный исход.
До недавнего времени считалось, что это заболевания в основном вирусной природы. Среди вирусных медленных инфекций особенно актуальны первичная гепатокарцинома, обусловленная вирусом гепатита В, хронический гепатит С, цирроз, лимфома Беркитта, саркома Капоши, Т-клеточная лим-фома и другие.
К медленным инфекциям относятся медленно прогрессирующие заболевания, в частности, заболевания ЦНС со спонгиоформными энцефалопатиями у человека — куру, болезнь Крейтцфельдта — Якоба (пресенильная деменция), а у животных — трансмиссивная энцефалопатия норок и скрепи у овец, подострый склерозирующий панэнцефалит, который вызывается вирусом кори, рассеянный склероз, амиотрофический боковой склероз и некоторые другие заболевания человека и животных.
При некоторых медленных инфекциях существенную роль играют генетические механизмы (скрепи, куру, амиотрофический боковой склероз), при других — иммунопатологические механизмы (подострый склерозирующий панэнцефалит, алеутская болезнь норок, лимфоцитарный хориоменингит).
При продолжительном взаимодействии вируса с организмом возникает персистентная форма инфекции Один и тот же вирус(Вирусы герпеса, гепатита В и аденовирусы) может вызвать как острую, так и персистентную инфекцию в зависимости от состояния организма и в первую очередь его иммунной системы.
Персистентные инфекции могут быть латентными, хроническими или медленными в зависимости от выделения вируса в среду и проявления симптомов заболевания.
Латентная инфекция — это скрытая инфекция, не сопровождающаяся выделением вирусов в окружающую среду. .Это своеобразная форма взаимоотношений вируса, клетки и организма, при которой все защитные факторы организма человека оказываются не в состоянии полностью ликвидировать инфекцию, в то время как вирус, длительно персистируя, не вызывает значительной деструкции клеток. При латентных инфекциях вирус не всегда удается обнаружить либо в связи с его дефектным состоянием, либо в связи с персистенцией субвирусных компонентов, либо в связи с интеграцией клеточным геномом. При воздействии ряда активирующих инфекцию факторов может произойти активация вируса, и латентная инфекция может перейти в острую или хроническую. Латентные инфекции могут вызывать аденовирусы, вирусы герпеса, онкогенные вирусы, вирус СПИД и др.
Большую роль персистенция вирусов играет в перинатальной патологии. Вертикальная передача персисти-рующего вируса от инфицированной матери плоду и активная репродукция вируса в его тканях особенно опасны в первые месяцы беременности, так как приводят к аномалиям развития плода или его гибели. К числу таких вирусов относятся вирусы краснухи, простого герпеса, ветряной оспы, цитомегалии, Коксаки В и ряд других.
Герминативный инфекционный процесс, или внутриутробная инфекция — процесс, возникающий внутриутробно или после рождения с развитием врожденной инфекционной болезни. Среди вирусных типичными являются ВИЧ-инфекция, цитомегаловирусная инфекция, краснуха, простой герпес, из бактериальных — врожденный сифилис, листериоз, лепра, из протозой-ных — токсоплазмоз. Заболевания этой группы характеризуются генерализованным и тяжелым течением.
10
Лекция №2
Культивирование вирусов.
2.1.Обзор живых систем для культивирования вирусов
В настоящее время существуют следующие методы культивирования вирусов:
■ на восприимчивых домашних и лабораторных животных (телята, мыши, белые крысы, кролики, морские свинки, хомяки, цыплята);
■ на развивающихся куриных эмбрионах, деэмбрионированных яйцах и эмбрионах других видов птиц;
■ в культурах ткани и клеток.
Вирусы различных групп могут быть культивированы в организме восприимчивых домашних или лабораторных животных. Наиболее широко, в том числе в лабораторных условиях, применяют культивирование вирусов на белых крысах, кроликах, белых мышах, хомяков, цыплят. У молодых мышей экспериментально воспроизводят грипп, флавивирусные инфекции, ящур и т .д.
Они восприимчивы ко многим вирусам, их легко разводить и с ними удобно работать. Лучше использовать мышей инбредных линий, так как они почти одинаково реагируют на тот или иной вирус. У крыс так-же создают инбредные линии, но эти животные более устойчивы к определенным вирусным инфекциям, чем мыши. Онкогенность некоторых вирусов широко изучают на золотистых хомячках.
Ту или иную инфекцию иногда изучают на животных нескольких видов, обладающих разной чувствительностью к данному вирусу, что позволяет дифференцировать вирусы, вызывающие клинически сходные симптомы болезни
(например, ящур, везикулярный стоматит, везикулярная экзантема и везикулярная болезнь свиней).
На чувствительность животных к вирусам влияют следующие факторы.
1. Возраст.
2. Наличие неспецифических ингибиторов, которые выполняют защитную функцию организма.
3. Пол животных. Наиболее чувствительны особи женского пола — самки
(болезнь Марека), менее — мужского пола (самцы).
4. Генетические линии. Одни животные более чувствительны, другие — резистентны.
По генетическим качествам лабораторных животных делят на четыре группы:
1) животные смешанного происхождения, полученные от разных животноводов, такие животные гетерогенны;
2) животные, полученные непосредственно из одного источника, однако генетически такие животные вариабельны;
3) инбредные линии животных. Их получают в результате спаривания брата с сестрой или родителей с детьми по крайней мере не менее 20 поколений. При таком методе разведения достигается все возрастающая степень гомозиготности. Из большого числа инбредных линий в качестве примера можно указать две линии мышей: инбредная линия СЗН, полученная Стронгом (1920 г.) путем скрещивания самок мышей Ваgg-Albino с самцами ДВА (мыши этой линии имеют светло- коричневую окраску).
4) однородные гибриды F1. Высокая степень гетерозиготности, характерная для каждого гибрида, связана здесь с генетическим однообразием, которое соответствует
12 вируссодержащего материала кровь, селезенку, печень, лимфатические железы больных животных, которые извлекают с соблюдением условий стерильности. Из органов и тканей готовят соответствующую суспензию, которую применяют для последующего заражения внутривенным или подкожным методами.
Для культивирования дерматропных вирусов (оспа овец и птиц,) используют пораженные участки кожи больного животного, суспензию из везикул и пустул (при оспе, ящуре), из оспенных эпителиом или дифтеритических клеток (при оспе, дифтерите птиц) или материал, взятый из трахеи (при ларинготрахеите птиц).
Вируссодержащий материал лабораторным животным вводится внутрикожно.
Культивирование вирусов на куриных эмбринах
Культивирование вирусов в куриных эмбрионах — наиболее доступный и удобный метод как для первичного выделения вирусов от больных животных и из объектов внешней среды, так и для последующего культивирования вирусов в лаборатории. Этот метод широко применяется для идентификации вирусов и антител, а также для приготовления вакцин и диагностикумов.
В куриных эмбрионах, поскольку они содержат четыре различных биологических субстрата: амнион, аллантоис, хорион- аллантоисную мембрану и желточный мешок,— способны размножаться многие вирусы. Они пригодны для выделения и титрования вирусов, получения антигенов, постановки реакции нейтрализации и т. д.
В ряде случаев при инокуляции вируссодержащего материала куриный эмбрион проявляет признаки данной инфекции, однако он не всегда свободен от посторонних вирусов и не образует антител. Преимущество куриных эмбрионов как биологической системы также в их сравнительно невысокой стоимости и доступности для любой диагностической лаборатории.
В лабораторно-диагностической работе чаще всего используются эмбрионы кур и сравнительно редко эмбрионы других птиц. Например, вирус гепатита утят значительно лучше размножается в утиных эмбрионах.
Яйца необходимо получать из благополучных по вирусным болезням хозяйств. В оплодотворенных яйцах даже от клинически здоровых кур могут находиться различные встречающиеся у этих птиц вирусы: ньюкаслской болезни, инфекционного бронхита, инфекционного ларинготрахеита, энцефа-ломиелита, парагриппа-2, полиартрита, оспы, арбовирусы, аденовирусы и др. Присутствие этих вирусов может, с одной стороны, привести к диагностическим ошибкам, а с другой, на основе явления интерференции, к подавлению размножения вируса, находящегося в исследуемой пробе. Эмбрионы, не содержащие вируса, но полученные от кур, бессимптомно зараженных определенными вирусами, также могут быть менее чувствительны или абсолютно нечувствительны к действию данного вируса благодаря наличию специфических антител, полученных от матери с желтком. Типичным примером может служить бессимптомное заражение кур вирусом энцефаломиелита.
Для удачного выделения вируса необходимо, чтобы куры, эмбрионы которых используют в работе, не были вакцинированы против болезни, возбудителя которой ищут. Например, эмбрионы кур, подвергнутых вакцинации против ньюкаслской
Условия, влияющие на размножение вирусов в куриных эмбрионах.
1. Температура от 35 до 37 °С является оптимальной для размножения вирусов гриппа.
13 2. Возраст эмбриона. В зависимости от вида вируса, способа заражения и задач исследования используют эмбрионы в возрасте 8—12 дней. Для культивирования вирусов гриппа чаще берут 9—10-дневные эмбрионы.
3. Концентрация введенного вируса существенно влияет на размножение вируса. Наиболее активное накопление вируса гриппа А2 отмечается при введении 10000—100000 инфекционных доз. Введение неразведенного вируса вызывает менее обильное накопление инфекционного вируса. Оптимальные дозы заражения вирусами осповакцины — от 10-1 до 10
3.
4. Метод заражения. При заражении в амнион и желточный мешок вирус осповакцины накапливается медленно и в низких титрах, а эмбрионы погибают через 48 ч, поражения на оболочках появляются в меньшем количестве. При заражении на ХАО поражения образуются чаще. При инфицировании же в аллантоисную полость эмбрионов погибает значительно меньше. При нанесении вируса в небольших концентрациях на ХАО гемагглютинины накапливаются в больших концентрациях, чем при заражении в аллантоисную оболочку.
Заражение куриных эмбрионов.
Подготовка куриных эмбрионов к заражению.
Перед заражением инкубированные яйца просвечивают, погибшие отделяют. На скорлупе яиц с живыми эмбрионами, которые различают по красному цвету кровеносных сосудов и движению эмбриона, карандашом отмечают место заражения. После разметки яйца до заражения переносят в инкубатор, в котором поддерживают необходимую для инкубации температуру. Внутри инкубатора для создания необходимой влажнсти устанавливают чашку с дистиллированной водой, а чтобы обеспечить необходимую циркуляцию воздуха, открывают все вентиляционные отверстия.
Яйца заражают при помощи стерильных шприца для туберкулинизации и специальных игл. Место заражения на яйце заливают парафином.
Учитывая патогенность исследуемых вирусов, работы ведут в маске, резиновых перчатках и защитных очках.
Заражение в аллантоисную полость . Используют, как правило, 9—12-дневных эмбрионов. Эту методику часто используют для получения больших количеств вируса при изготовлении антигенов, вакцин и т. д.
Заражение в амнион. Применяют главным образом для выделения вирусов из материала клинических проб. Инфицированный материал, введенный в полость амниона, заглатывается эмбрионом, а также попадает в дыхательные пути.
Заражение на хорионаллантоисную оболочку . Чаще всего используют для выделения и культивирования вирусов, образующих на оболочке бляшки или оспины (вирусы оспы, инфекционного ларинготрахеита птиц и др.), а также для титрования этих агентов, так как число инфекционных частиц можно рассчитать по количеству бляшек или оспин..
Заражение в желточный мешок. Используют обычно для выделения и культивирования риккетсий и хламидий. Они хорошо размножаются в клетках, выстилающих полость желточного мешка, где отчетливо видны на окрашенных микроскопических препаратах.
Внутримозговое
заражение
зародышей.
Применяют для вирусов, размножающихся в нервной ткани (нейротропные вирусы).
Наблюдение за зараженными эмбрионами. Длительность наблюдения зависит от вируса и дозы его введения. Эмбрионы просвечивают 2 раза в день — в начале и в
14 конце работы, погибшие вынимают и исследуют. Результаты наблюдений записывают в протоколы исследований.
Отрицательный результат заражения не исключает присутствия вируса в исследуемом материале. Он может свидетельствовать о том, что вируса ввели слишком мало или что к данному вирусу эмбрион нечувствителен. Для исключения первого предположения необходимо провести 1—2 пассажа.
Деэмбринированные яйца.
В основе метода лежит удаление эмбриона из яйца в период, когда к его скорлупе изнутри полностью прилегает хорионаллантоисная оболочка. Если внутрь такого яйца добавить питательную среду, то образуется своеобразная культура ткани, в которой может размножаться вирус.
Недостатки метода культивирования вирусов в куриных эмбрионах:
■ куриные эмбрионы могут быть носителями микроорганизмов (сальмонеллы, туберкулезная палочка), в том числе вирусов (лейкоз птиц, бронхит кур и др.) и противовирусных антител;
■ не все вирусы культивируются в куриных эмбрионах.
ИСПОЛЬЗОВАНИЕ КУЛЬТУРЫ КЛЕТОК В ДИАГНОСТИКЕ ВИРУСНЫХ
БОЛЕЗНЕЙ
Внедрение метода культивирования клеток и тканей в вирусологию и диагностику вирусных болезней позволило не только познать глубже сущность вирусов, но и расшифровать этиологию ряда болезней, создать высокоэффективные противовирусные вакцины (живые и убитые) для их профилактики.
Метод культуры клеток заключается в том, что от убитого животного как можно быстрее после клинической смерти берут ткань или клетки и до наступления биологической смерти помещают их в соответствующие питательные среды и условия, обеспечивающие поддержание процессов жизнедеятельности. Наряду с множеством других преимуществ метод культуры тканей относительно дешев и поэтому может быть использован массово.
Культура тканей позволяет получить достаточно чистый вирус (с небольшим количеством чужеродных антигенов), что очень важно при изготовлении сывороток и антигенов для серологических реакций.
В настоящее время в практической вирусологии широко используются не только первично-трипсинизированные, но и перевиваемые, и диплоидные клетки.
2.2. Культуры клеток: классификация, особенности, преимущества перед
другими живыми системами.
Культивирование вирусов в культурах тканей применяют в следующих случаях:
■ для замены лабораторных и домашних животных;
■ получения большого количества вирусов, необходимых для производства биологических препаратов — вакцин, сывороток и диагностикумов;
■ изучения развития вирусов в зараженных клетках.
Культура тканей — сборное понятие, обозначающее систему, в которой клетки, ткани или органы сохраняют жизнеспособность или способность размножаться in vitro более 24 ч. В зависимости от вида биологического объекта различают:
культуру клеток— термин, который обозначает рост клеток in vitro и включает в себя также рост единичных клеток (клетки в культуре не образуют ткань); культуру
тканей или органов — термин, который обозначает поддержание роста тканей,
15 зачатков органов или их частей in vitro при сохранении их дифференцировки, структуры и (или) функции.
Культивирование клеток.
Для роста и размножения клеток вне организма необходим комплекс физико- химических факторов. Для клеток млекопитающих и птиц оптимальная температура размножения колеблется в пределах
36. 38,5°С.
Для поддержания жизнедеятельности клеток большое значение имеет солевой состав питательной среды, создающий необходимую буферность и изотоничность. Для роста клеток животных обязательно присутствие в среде ионов Са+, К+,Mg, С1, карбонатов и фосфатов, которые входят в состав всех физиологических солевых растворов.
Оптимальный рост и развитие клеток возможны в среде при рН 7,2. 7,4; значительное отклонение от указанного оптимума отрицательно сказывается на росте культуры клеток. Для роста клеток обязательны кислород и диоксид углерода, аминокислоты, витамины, глюкоза.
В зависимости от входящих компонентов питательные среды делят на две группы: 1) содержащие естественные компоненты (сыворотку, амниотическую жидкость и др.); 2) синтетические и полусинтетические.
Натуральные среды состоят из смеси соответствующего солевого раствора
(Хенкса, Эрла), сыворотки (животных и человека), тканевого экстракта (эмбрионов кур, коров, человека), гидролизата лактальбумина.
Читайте также:

