Герпес лабиалис по латыни
Обновлено: 25.04.2024
Категории МКБ: Герпетическая болезнь глаз (B00.5+), Герпетическая инфекция неуточненная (B00.9), Герпетическая экзема (B00.0), Герпетический везикулярный дерматит (B00.1), Герпетический гингивостоматит и фаринготонзиллит (B00.2), Герпетический менингит (B00.3+) (G02.0*), Герпетический энцефалит (B00.4+) (G05.1*), Диссеминированная герпетическая болезнь (B00.7), Другие формы герпетических инфекций (B00.8), Инфекции, вызванные вирусом герпеса [herpes simplex] (B00)
Общая информация
Краткое описание
Герпетическая инфекция(простой герпес, herpessimplex) –антропонозная вирусная болезнь, вызываемая вирусом простого герпеса 1 и 2 типов, клинически проявляющаяся поражением многих органов и тканей, сопровождающаяся появлением группирующихся пузырьковых высыпаний на коже и слизистых оболочках. Имеет наклонность к длительному латентному течение с периодическими рецидивами.
Код(ы) МКБ-10
| МКБ-10 | |
| Код | Название |
| ВОО.О | Герпетическая экзема |
| ВОО.1 | Герпетический везикулярный дерматит |
| ВОО.2 | Герпетический гингивостоматит и фаринготонзиллит |
| ВОО.3 | Герпетический менингит (G02.0*) |
| ВОО.4 | Герпетический энцефалит (G05.1*) |
| ВОО.5 | Герпетическая болезнь глаз |
| ВОО.7 | Диссеминированная герпетическая болезнь |
| ВОО.8 | Другие формы герпетических инфекций |
| ВОО.9 | Герпетические инфекции неуточненные |
Дата разработки протокола: 2017 год.
Сокращения, используемые в протоколе:
| АД АлАТ Астр ВИЧ ВПГ | – – – – – | артериальное давление; аланинаминотрансфераза; аспартатаминотрансфераза; вирус иммунодефицита человека; вирус простого герпеса; |
| ГГГИ ГИ ЖКТ ИППП | – – – – | генитальный герпес; герпетическая инфекция; желудочно-кишечный тракт; инфекции, передающиеся половым путем; |
| ИФА ИФН КТ МРТ ОАК ОАМ ПЦР УД | – – – – – – – – | иммуноферментный анализ; интерфероны; компьютерная томография; магнитно-резонансная томография; общий анализ крови; общий анализ мочи; полимеразная цепная реакция; уровень доказательности. |
Пользователи протокола: врачи общей практики, педиатры, детские инфекционисты, детские невропатологи, детские дерматовенерологи, акушер-гинекологи, детские стоматологи, офтальмологи, детские отоларингологи, детские анестезиологи-реаниматологи.
Категории пациентов: дети.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты, которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследование случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+), результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование, или мнение экспертов. |
| GPP | Наилучшая фармацевтическая практика. |
Классификация
| По механизму заражения различают следующие формы ГИ: • Приобретенная: - первичная; - рецидивирующая • Врожденная (внутриутробная инфекция). | По распространенности поражений инфекционного процесса: • локализованную ГИ (при одном очаге поражения); • распространенную ГИ (при двух и более очагах поражения); • генерализованную(висцеральную, диссеминированную) ГИ. | По течению: • острое; • хроническое; • латентное. |
| Типичные формы: • поражения слизистых оболочек; • (стоматит, гингивит, фарингит и др.); • поражения кожи(герпес губ, носа, век, лица, рук и других участков кожи); • поражения глаз: офтальмогерпес (герпетический конъюктивит, блефароконъюнктивит, кератит, кератоиридоциклит, хориоретинит, увеит, периваскулит сетчатки, неврит зрительного нерва); • герпетическая экзема; • генитальный герпес(поражение полового члена, вульвы, влагалища, цервикального канала, промежности, уретры, эндометрия); • поражения ЦНС(энцефалит, менингоэнцефалит, неврит и др.); • висцеральные формы(гепатит, пневмония и др.). |
| Атипичные формы: • абортивная; • отечная; • буллезная; • геморрагическая; • язвенно-некротическая. |
| По тяжести процесса различают: • легкую, • среднетяжелую, • тяжелую формы. | Выделяют 2 стадии инфекции: • активная стадия инфекции – с клиническими проявлениями (рецидив), бессимптомно. • неактивная стадия инфекции – абортивная вирусная инфекция, реализуется генетическая информация только неструктурных (альфа-) генов без образования новых дочерних частиц вируса. |
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Диагностические критерии [1,2]
Жалобы и анамнез: в зависимости от формы герпетической инфекции, вызванной ВПГ 1, 2 типов.
Поражения слизистых оболочек(продолжительность болезни 1-2 недели; температура тела нормализуется на 3-5 день болезни, возможны рецидивы):
наблюдается у детей любого возраста, чаще возрасте 2-3 лет:
· повышение температуры тела до 39–40С;
· озноб;
· беспокойство;
· общее недомогание;
· отказ от еды из-за резкой болезненности во рту;
· слюнотечение, запах изо рта;
у детей раннего возраста:
· снижение массы тела;
· кишечные расстройства.
Поражение кожи чаще возникает вокруг рта - herpeslabialis, носа - herpesnasalis, ушных раковин - herpesoptiсum.
Локализованная форма:
· температура тела в норме
· сгруппированные пузырьки на коже;
· чувство жжения и покалывания;
· зуд, боль и чувство растяжения
Распространенная форма (диссеминированная),чаще встречается у детей раннего возраста и продолжительностью до 2-3-х недель и более:
· температура тела 39-40 С, озноб;
· головная боль;
· общая слабость, недомогание;
· снижение аппетита;
· мышечные и суставные боли;
· на высоте интоксикации отмечаются тошнота, рвота и судороги;
· сгруппированные пузырьки на различных участках кожи (на лице, руках, туловище);
Поражение глаз (офтальмогерпес) течение доброкачественное:
· боль, зуд в глазах;
· светобоязнь из-за усиления болей;
· снижение остроты зрения;
· покраснение глаз, слезотечение.
Генитальный герпес (herpesgenitalis) встречается у девочек подростков и юношей при заражении половым путем:
· сильные болевые ощущения;
· зуд, жжение и покалывание, саднениев пораженных участках;
Поражение нервной системы (энцефалит, менингоэнцефалит, неврит и др.):
· лихорадка;
· озноб;
· недомогание;
· упорная головная боль;
· рвота.
Генерализованная форма (герпетическая экзема, вакциноформныйпустулез, осповидные высыпания Капоши, герпетиформная экзема), чаще встречается у больных экземой, нейродермитом и др. дерматозами, иммунодефицитом. Болезнь бывает длительной, возможны повторные высыпания в течение 2-3-х недель, а в тяжелых случаях вовлечение нервной системы, висцеральных органов и зрения, вследствие чего может наступить летальный исход.
· температура тела 39-40 С;
· выраженная вялость, беспокойство, сонливость;
· возможны судороги с кратковременной потерей сознания;
· рвота;
· сгруппированные пузырьки на обширных участках кожи, особенно в местах, пораженных экземой, нейродермитом и др.
Простой герпес у новорожденных. Инфицирование происходитот материво время прохождения через родовые пути или сразу после рождения. Заболевание возникает на 5-10 день жизни ребенка. Первично поражается слизистая оболочка полости рта, затем появляются герпетические высыпания на коже, но нередко инфекция становится генерализованной с поражением многих органов (легкие, печень, ЦНС, глаза и др.).
· герпетические высыпания на слизистых оболочках полости рта и на коже;
· лихорадка (до 39-40 С);
· рвота;
· беспокойство;
· судороги, потеря сознания;
· жидкий стул.
Анамнез:
· острое начало;
· волнообразное течение при рецидивирующей форме;
· рецидивы часто возникают в холодное время года, после перенесенных ОРЗ, вирусно-бактериальных заболеваний, обострения хронических болезней.
Физикальное обследование:
При поражении слизистых:
· отечность и яркая гиперемия слизистой оболочки полости рта;
· герпетические высыпания в виде пузырьков, диаметром 2-10 мм, сначала с прозрачным, затем желтоватым содержимым на слизистой оболочке щек, десен, языка, внутренней поверхности губ, на мягком и твердом небе, небных дужках и миндалинах, которые позже вскрываются, образуя эрозии;
· стоматит;
· гингивит;
· фарингит;
· увеличение регионарных лимфатических узлов, болезненность при пальпации.
При поражении кожи:
· на месте внедрения вируса, сгруппированные пузырьки диаметром 0,1-0,3 см на фоне эритемы и отечности;
· пузырьки, окруженные зоной гиперемии, заполненные прозрачной жидкостью, склонные помутнению (иногда жидкость носит геморрагический характер из-за примеси крови)
· на месте вскрытых пузырьков остаются поверхностные эрозии, затем буровато-желтоватая корочка;
· на месте отпавших корочек остается небольшое покраснение кожи или легкая пигментация.
При распространении процесса:
· герпетические высыпания сливаются и образуют массивные корки;
· увеличение регионарных лимфатических узлов (к месту наибольшего поражения);
· офтальмогерпес (конъюнктивит, кератит, иридоциклит и др.; у новорожденных возможны катаракта, хориоретинит и увеит);
· генитальный герпес (везикулезные и эрозивно-язвенные высыпания, возникающие на эритематозно-отечной коже и слизистой оболочке гениталий (внутренний листок крайней плоти, кожа мошонки у мальчиков, у девочек высыпания на малых и больших половых губах, промежности, на внутренней поверхности бедер, реже на слизистой оболочке влагалища, клиторе и анусе);
· герпетические поражения нервной системы (менингит, энцефалит, менингоэнцефалит, неврит и т.д.);
· генерализованный простой герпес (пневмония, гепатит, сепсис; чаще встречается у новорожденных, но может быть и у детей старшего возраста.). Герпетическая пневмония и герпетический очаговый нефрит клинически не отличаются от поражений легких и почек другой этиологии.
Лабораторные исследования[1,2,4]:
Специфическая лабораторная диагностика:
· ПЦР крови–обнаружение ДНК ВПГ 1, 2 типов в крови, ликворе и других биологических материалах является лабораторным маркером активности инфекционного процесса.
Серологический метод диагностики (ИФА):
- определение Anti-HSV-IgMк ВПГ-1, 2 - острая инфекция, реактивация вируса;
- определениеAnti-HSV-IgGк ВПГ-1, 2- маркер инфицированности организма вирусом простого герпеса. Он выявляется на 3-4 неделе и достигает максимума на 6-8 неделе. В первые 3 месяца определяется низкоавидныеIgG(индекс авидности менее 30%), в дальнейшем синтезируются высокоавидные антитела.При рецидиве IgMопределяются в низком титре или отсутствуют, а титр IgGповышается на 2 неделе.
Лабораторный критерийактивности ВПГ– определение антител классаIgM, низкоавидныхIgGи повышение титраIgGв 4 раза и более.
При латентной формеобнаруживаютстабильно низкие титры высокоавидныхIgG.
У новорожденных и грудных детей в период до 18 месяцев в крови присутствует пассивно приобретенный IgG материнского происхождения, поэтому интерпретация результатов исследования IgG и их авидности затруднительна, целесообразно использование ПЦР.
Инструментальные исследования: нет
Дополнительные исследования:
· ОАК – лейкопения, нейтропения, лимфоцитоз, моноцитоз;
· биохимический анализ крови – при герпетических гепатитах, повышение содержания общего билирубина за счет прямой фракции и АлАТ;
· биохимический анализ ликвора- при менингите и энцефалите, повышение белка, лимфоцитарныйцитоз.
· рентгенография органов грудной клетки – признаки пневмонии (при поражении органов дыхания);
· МРТ головного мозга –при энцефалите;
Показания для консультации специалистов:
· консультация офтальмолога – при офтальмогерпесе;
· консультация невролога – при поражении ЦНС (менингоэнцефалит, энцефалит);
· консультация акушер-гинеколога – при генитальном герпесе у девочек подростков;
· консультация уролога – при генитальном герпесе у юношей;
· консультация анестезиолога-реаниматолога – при развитии неотложных состояний;
· консультация других узких специалистов – по показаниям.

Диагностический алгоритм:
Инфекции, вызванные вирусом простого герпеса. Эти инфекции вызывают появление болезненных пузырьков на губах или половых органах. Возраст, пол, генетика значения не имеют.
Высококонтагиозные вирусы простого герпеса вызывают множество различных заболеваний, при которых на коже и слизистых оболочках появляются мелкие болезненные пузырьки. Чаще всего они появляются на губах или на половых органах . Инфекция, обусловленная вирусом простого герпеса (ВПГ) передается при контакте с пузырьками.
После инфекции ВПГ иммунитет не образуется. Вирус остается в латентном состоянии в нервной ткани и может реактивироваться в периоды стресса или болезни. Как и в случае других вирусных болезней, заболевания наблюдаются чаще и протекают тяжелее у людей со сниженным иммунитетом, таких как больные СПИДом.
Классификация. В настоящее время обнаружено до восьми типов ВПГ, но только два из них широко распространены. ВПГ-1 вызывает преимущественно инфекцию губ, полости рта и лица, а ВПГ-2 — инфекцию половых органов. Большинство людей уже инфицировано ВПГ-1 к моменту достижения половой зрелости. В большинстве случаев первоначальное заражение происходит без симптомов, но у некоторых детей могут появиться пузырьки на слизистой оболочке полости рта, а у детей с экземой иногда появляется герпетиформная экзема. После первоначальной инфекции вирус приходит в латентное состояние. В дальнейшем он может периодически активироваться, вызывая герпетическую лихорадку.
ВПГ-2 обычно передается половым путем и вызывает генитальный герпес.Фактором риска заражения генитальным герпесом является незащищенный секс с несколькими партнерами. Это состояние, как и герпетическая лихорадка, также склонно к рецидивам. Инфекция ВПГ-2 считается болезнью, угрожающей жизни новорожденных, которые были в контакте с герпетическими пузырьками у матери во время родов.
Одним из проявлений инфекции, вызванной вирусом простого герпеса, является герпетическая лихорадка.
Герпетическая лихорадка часто локализуется на коже около губ. Обычно она развивается так:
- в пораженном месте начинается покалывание;
- появляется одно или несколько скоплений мелких и очень болезненных пузырьков, окруженных воспаленной кожей;
- пузырьки лопаются и покрываются корочкой;
- обычно недомогание проходит через 10–14 дней.
При рецидивах герпетической лихорадки пузырьки обычно появляются в тех же местах.
Инфекцию ВПГ диагностируют по внешнему виду и месту появления пу зырьков. Легкую герпетическую лихорадку обычно лечат противовирусными препаратами местного действия, отпускаемыми без рецепта. Но если у больного генитальный герпес или тяжелые рецидивирующие вспышки герпетической лихорадки, нужно принимать противовирусные лекарства внутрь.
Пациент может предотвратить вспышку инфекции, если воспользуется противовирусной мазью, например содержащей ацикловир, но ее нужно применять при первых же симптомах. В некоторых случаях назначают противовирусные лекарства в таблетках или капсулах. Несмотря на то что противовирусные средства способны предотвратить вспышку инфекции, вирус остается в организме и может вызывать рецидивы.
Людям с рецидивирующей герпетической лихорадкой следует защищаться от солнечных ожогов и холодного ветра (провоцирующие факторы). Для профилактики передачи инфекции нельзя трогать пузырьки пальцами и целоваться. Иногда при оральном сексе вирус может попасть изо рта на половые органы.
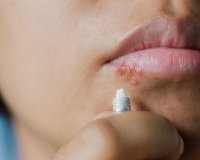
Лабиальный герпес – это вирусная инфекция, которая проявляется высыпаниями на коже и красной кайме губ. Заболевание вызвано вирусами герпеса 1-го и 2-го типов. Манифестация болезни происходит на фоне снижения иммунитета, переохлаждения, травмы и других стрессовых факторов. Лабиальный герпес проявляется пузырьковой сыпью на губах, которая быстро превращается в небольшие болезненные эрозии. Для диагностики заболевания используют вирусологические, серологические и молекулярно-генетические анализы. Лечение включает мази с противогерпетическими компонентами, ранозаживляющие средства, иммуномодуляторы и адаптогены.
МКБ-10


Общие сведения

Причины
ВПГ относится к ДНК-содержащим возбудителям, его наследственный материал содержит около 80 генов. Вирус устойчив к низким температурам, однако быстро разрушается при нагревании до 50°С, под действием ионизирующего излучения и химических растворителей. На влажной коже и поверхности предметов возбудитель сохраняет жизнеспособность в течение 1-4 часов.
До 90% лабиального герпеса вызвано ВПГ-1, у остальных пациентов причиной заболевания выступает ВПГ-2. Возможно одновременное присутствие в организме обоих типов вирусного возбудителя. Заражение происходит при контакте с больным человеком (особенно во время поцелуев), пользовании общей посудой и косметикой. Инфицирование ВПГ-2 наиболее вероятно при половом акте, большинство людей сталкиваются с возбудителем в начале сексуальной жизни.
Предрасполагающие факторы
При хорошем состоянии иммунной системы клинические проявления герпетической инфекции не возникают. Поэтому в практической дерматологии большое внимание уделяется предрасполагающим причинам, на фоне которых происходит первичная манифестация или рецидив заболевания. К типичным провоцирующим факторам лабиального герпеса относятся:
- первичные и вторичные иммунодефицитные состояния;
- частые респираторные инфекции;
- стоматологические вмешательства;
- пластические операции на лице;
- инъекционные косметологические процедуры в области губ;
- психоэмоциональные стрессы;
- период менструации у женщин;
- переохлаждение;
- чрезмерная инсоляция.
В группе риска находятся пациенты старше 70 лет, большинство из которых имеют несколько хронических заболеваний и физиологическое угнетение иммунной функции. Высокому риску лабиального герпеса подвергаются беременные женщины, что связано с гормональными перестройками, изменениями работы иммунной системы. Более частые обострения регистрируются у людей с низким социально-экономическим статусом.

Патогенез
В современной инфектологии выделяют несколько стадий развития герпетической инфекции. При первичном проникновении возбудителя наблюдается вирусемия, патоген распространяется по паренхиматозным органам, у части пациентов он поражает эпителий и вызывает характерную сыпь. Затем ВПГ проникает в нервные ганглии, заражает лимфоцитарные клетки крови, что способствует вторичной вирусемии.
При благоприятном течении заболевания спустя несколько недель иммунная система элиминирует возбудителя из эпителиальных клеток и внутренних органов, однако в нервных узлах формируются пожизненные очаги латентной инфекции. Под действием неблагоприятных факторов происходит реактивация вируса, его перемещение по нервным волокнам от ганглиев к поверхности кожи, в результате чего развивается обострение.
Структурные изменения эпителиальных клеток при герпетической инфекции проявляются увеличением ядер, фрагментацией хроматина, появлением базофильных или эозинофильных включений. В остром периоде герпеса наблюдается выраженный альтеративный компонент воспаления, проявляющийся гибелью отдельных клеток, расстройствами кровообращения, появлением мини-очагов некроза.
Симптомы лабиального герпеса
В начале обострения пациенты ощущают зуд, покалывание и жжение поверхности губ. В течение 12-36 часов на этом месте появляется группа пузырьков с прозрачным содержимым, которые сопровождаются покраснением и отечностью кожи. Жидкость внутри везикул быстро мутнеет, после чего они вскрываются с образованием ярко-красных эрозий. Ранки на губах покрываются корочками, которые отпадают в течение 6-9 дней по мере заживления тканей.
Помимо внешних проявлений лабильного герпеса, пациенты жалуются на боли во время еды, питья, разговора. Неосложненные формы заболевания протекают без системных нарушений здоровья, поэтому общее состояние остается удовлетворительным. У детей и ослабленных людей герпетическая инфекция может вызывать головные боли, слабость, повышение температуры тела в пределах субфебрильных значений.
Осложнения
При иммунодефицитах лабиальный герпес может принимать геморрагическую или язвенно-некротическую форму, распространяться на кожу периоральной зоны. Высыпания на губах нередко сопровождаются острым герпетическим стоматитом – поражением слизистой оболочки полости рта. Пациентов беспокоят множественные болезненные эрозии на поверхности щек, языка и мягкого неба, симптомы интоксикации, катаральные проявления.
Поврежденный эпителий на месте вскрывшихся пузырьков является входными воротами для вторичной инфекции. При плохой гигиене и привычке трогать губы грязными руками есть риск присоединения бактериального воспаления. В этом случае ранки нагнаиваются, становятся очень болезненными, кожа вокруг губы краснеет и отекает. У иммунокомпрометированных людей есть риск активации кандидоза полости рта.
Длительно существующий лабиальный герпес ассоциирован с недостаточностью иммунной системы пациента. Несмотря на наличие вируснейтрализующих антител, постепенно прогрессирует иммуносупрессия, учащаются рецидивы, увеличивается площадь поражения кожи. У людей, живущих с ВИЧ, получающих лечение цитостатиками или радиотерапию, герпетическая инфекция нередко принимает генерализованный характер.

Диагностика
Первичный осмотр пациентов с лабиальным герпесом проводится врачом-дерматологом, по показаниям к обследованию подключают инфекциониста, стоматолога, иммунолога. При типичной клинической картине предварительный диагноз удается поставить по данным визуального осмотра и сбора анамнеза болезни. Для подтверждения герпетической этиологии сыпи на губах применяются следующие методы исследования:
- Цитоморфологическое исследование. При микроскопии мазка с поверхности губ удается обнаружить гигантские клетки и внутриядерные включения, которые характерны для герпетической инфекции. Ввиду невысокой чувствительности метода его обязательно подтверждают другими анализами.
- Обнаружение вирусных антигенов. С помощью прямой иммунофлюоресценции обнаруживается специфическое свечение клеток, пораженных герпесвирусами. К косвенным признакам заболевания относят агрегацию ядерного вещества, отслаивание кардиолеммы, внутриядерные включения.
- Полимеразная цепная реакция. ПЦР признана самым быстрым и чувствительным способом диагностики лабиального герпеса. Для ее проведения используются соскобы из эрозий на губах, критерием положительного результата является обнаружение вирусной ДНК в биоматериале.
- Вирусологический анализ. Выделение ВПГ в культуре тканей занимает 2-5 дней, обеспечивает 100% специфичность и 85-100% чувствительность. Такой метод используется для подтверждения диагноза при сомнительных результатах других видов исследования.
- Серологические реакции. Определение антител классов IgM, IgG, IgA в крови проводится методом ИФА. Нарастание титра антител в 4 и более раза свидетельствует об активной фазе инфекции. При этом у иммунокомпрометированных больных иммуноглобулины могут не обнаруживаться даже во время рецидива.
Дифференциальная диагнгстика
Клинические проявления лабиального герпеса необходимо отличать от трещин на губах, возникающих на фоне авитаминозов и железодефицита. Дифференциальная диагностика проводится с травматической эрозией, аллергическими высыпаниями, метеорологическим (актиническим) хейлитом. Симптомы хронического герпеса дифференцируют с многоморфной экссудативной эритемой, пузырчаткой, рецидивирующим афтозным стоматитом.
Лечение лабиального герпеса
Консервативная терапия
Обострения простого герпеса, протекающие без осложнений, подлежат амбулаторному лечению. На весь период терапии ограничивается прием кислой, соленой и другой раздражающей пищи. Женщинам рекомендуют отказаться от декоративной косметики для губ и не пытаться замаскировать проблему тональными средствами. Для быстрой ликвидации герпетической сыпи используются следующие группы медикаментов:
- Противовирусные препараты. Препараты выбора для подавления репликативной активности ВПГ – синтетические ациклические нуклеозиды группы ацикловира. Они обладают высокой избирательностью действия и низкой токсичностью. При герпесе на губах применяются мази, которые наносятся на поврежденные участки кожи и слизистой.
- Ранозаживляющие средства. После купирования воспалительного процесса используются смягчающие и кератолитические средства для локального применения. Они содержат масляные растворы, витамины и ранозаживляющие компоненты, благодаря чему ускоряют ликвидацию неэстетичных проявлений инфекции.
При типичном течении болезни нет необходимости в применении противовирусных средств системного действия. Такие лекарства назначаются при часто обостряющихся вариантах инфекции, которые затрагивают не только область губ и периоральную зону, но и другие участки тела, в том числе внутренние органы. После купирования острых симптомов рассматривается прием иммуностимуляторов и адаптогенов для предупреждения рецидивов у представителей групп риска.
Прогноз и профилактика
При нормальном иммунном статусе единичные обострения болезни быстро купируются медикаментозной терапией. При рецидивирующих вариантах лабиального герпеса прогноз определяется преморбидным фоном, состоянием иммунитета, чувствительностью возбудителя к используемым лекарствам. Для предупреждения повторных высыпаний необходимо проводить коррекцию образа жизни, по возможности устранять провоцирующие факторы.
В рамках специфической профилактики часто рецидивирующей инфекции используется противогерпетическая вакцина. Иммунизация рекомендована при наличии более 3 случаев лабиального герпеса в год, физиологическом снижении иммунитета у пожилых людей, ВИЧ-позитивном статусе. После прохождения полного курса вакцинации у 63% пациентов обострения прекращаются, у 27% больных уменьшается частота рецидивов.
3. Лабиальный герпес: общая характеристика вирусов простого герпеса, этиология, патогенез и эпидемиология заболевания/ П.М. Яновский, Н.Д. Сергеева// Альманах сестринского дела. 2017. – №1.
4. Герпес-вирусная инфекция в дерматологии: проблемы и современный подход к лечению/ Н.В. Кунгуров// Клиническая дерматология и венерология. – 2015. – №5.
Ядро: от белого до почти белого цвета.
Фармакологическое действие
Фармакодинамика
Валацикловир является противовирусным средством, представляет собой L-валиновый сложный эфир ацикловира. Ацикловир является аналогом пуринового нуклеозида (гуанина).
В организме человека валацикловир быстро и полностью превращается в ацикловир и валин под воздействием фермента валацикловиргидролазы. Ацикловир обладает in vitro специфической ингибирующей активностью против вирусов простого герпеса (ВПГ) 1-го и 2-го типов, вируса ветряной оспы и опоясывающего герпеса (ВЗВ — варицелла-зостер вирус, Varicella zoster virus), ЦМВ , вируса Эпштейна-Барр (ВЭБ) и вируса герпеса человека 6-го типа. Ацикловир ингибирует синтез вирусной ДНК сразу после фосфорилирования и превращения в активную форму — ацикловиртрифосфат.
Первая стадия фосфорилирования требует активности вирусспецифических ферментов. Для ВПГ, ВЗВ и ВЭБ таким ферментом является вирусная тимидинкиназа, которая присутствует в пораженных вирусом клетках. Частичная селективность фосфорилирования сохраняется у ЦМВ и опосредуется через продукт гена фосфотрансферазы UL97. Активация ацикловира специфическим вирусным ферментом в значительной степени объясняет его селективность.
Процесс фосфорилирования ацикловира (превращение из моно- в трифосфат) завершается клеточными киназами. Ацикловиртрифосфат конкурентно ингибирует вирусную ДНК-полимеразу и, будучи аналогом нуклеозида, встраивается в вирусную ДНК , что приводит к облигатному разрыву цепи, прекращению синтеза ДНК и, следовательно, блокированию репликации вируса.
У пациентов с сохраненным иммунитетом ВПГ и ВЗВ с пониженной чувствительностью к валацикловиру встречаются крайне редко, но иногда могут быть обнаружены у пациентов с тяжелым нарушением иммунитета, например с трансплантатом костного мозга, у получающих химиотерапию по поводу злокачественных новообразований и ВИЧ-инфицированных.
Резистентность обычно обусловлена дефицитом тимидинкиназы, что приводит к чрезмерному распространению вируса в организме хозяина. Иногда снижение чувствительности к ацикловиру обусловлено появлением штаммов вируса с нарушением структуры вирусной тимидинкиназы или ДНК-полимеразы. Вирулентность этих разновидностей вируса напоминает таковую у его дикого штамма.
Фармакокинетика
После приема внутрь валацикловир хорошо всасывается из ЖКТ , быстро и почти полностью превращаясь в ацикловир и валин. Это превращение катализируется ферментом печени валацикловиргидралазой. После однократного приема валацикловира в дозе 250–2000 мг средняя Cmax ацикловира в плазме у здоровых добровольцев с нормальной функцией почек составляет 10–37 мкмоль/л (2,2–8,3 мкг/мл), а среднее Tmax — 1–2 ч. При приеме валацикловира в дозе от 1000 мг биодоступность ацикловира равна 54% и не зависит от приема пищи. Cmax валацикловира в плазме составляет лишь 4% от концентрации ацикловира, среднее Tmax валацикловира в плазме — 30–100 мин после приема дозы, предел количественного определения валацикловира в плазме достигается через 3 ч либо раньше. Валацикловир и ацикловир имеют аналогичные фармакокинетические параметры после приема внутрь.
Распределение
Степень связывания валацикловира с белками плазмы очень низка (всего 15%).
У пациентов с нормальной функцией почек T1/2 ацикловира из плазмы после приема валацикловира составляет около 3 ч, а у пациентов с конечной стадией почечной недостаточности средний T1/2 около 14 ч. Валацикловир выводится из организма почками преимущественно в виде ацикловира (более 80% дозы) и метаболита ацикловира 9-карбоксиметоксиметилгуанина, в неизмененном виде элиминируется менее 1% валацикловира.
Особые группы пациентов
Фармакокинетика валацикловира и ацикловира в значительной степени не меняется у пациентов, инфицированных ВПГ и ВЗВ.
На поздних сроках беременности суточный показатель AUC в равновесном состоянии после приема 1000 мг валацикловира был больше приблизительно в 2 раза, чем таковой при приеме ацикловира в дозе 1200 мг/сут.
У ВИЧ-инфицированных пациентов фармакокинетические параметры ацикловира после приема внутрь валацикловира в дозе 1000 или 2000 мг сопоставимы с параметрами, наблюдаемыми у здоровых добровольцев.
У реципиентов трансплантатов, получивших валацикловир в дозе 2000 мг 4 раза в сутки, Cmax ацикловира была сопоставима или превышала концентрацию, наблюдаемую у здоровых добровольцев после приема тех же доз, при этом суточные показатели AUC были существенно выше.
Показания
лечение опоясывающего лишая (Herpes zoster) (препарат способствует купированию болевого синдрома, уменьшает его продолжительность и процент больных с болями, вызванными опоясывающим лишаем, включая острую и постгерпетическую невралгию);
лечение инфекций кожи и слизистых оболочек, вызванных ВПГ, включая впервые выявленный и рецидивирующий генитальный герпес (Herpes genitalis), а также лабиальный герпес (Herpes labialis);
профилактика (супрессия) рецидивов инфекций кожи и слизистых оболочек, вызванных ВПГ, включая генитальный герпес;
профилактика передачи генитального герпеса здоровому партнеру при приеме в качестве супрессивной терапии в сочетании с безопасным сексом.
Взрослые и подростки от 12 лет и старше:
профилактика ЦМВ-инфекции, а также реакции острого отторжения трансплантата (у пациентов с трансплантатами почек), оппортунистических инфекций и других герпес-вирусных инфекций (ВПГ, ВЗВ) после трансплантации органов.
Противопоказания
гиперчувствительность к валацикловиру, ацикловиру или любому другому компоненту препарата;
детский возраст до 12 лет при профилактике ЦМВ-инфекции после трансплантации;
детский возраст до 18 лет для всех остальных показаний (в связи с недостаточным количеством данных по клиническим исследованиям для указанной возрастной группы).
С осторожностью: пациенты с почечной недостаточностью; пациенты с клинически выраженными формами ВИЧ-инфекции; одновременный прием нефротоксичных ЛС.
Применение при беременности и кормлении грудью
Данных о применении препарата Валтрекс ® при беременности недостаточно. Препарат следует применять при беременности только в том случае, если потенциальная польза для матери превосходит потенциальный риск для плода.
Данные регистрационных записей об исходе беременности у женщин, принимавших Валтрекс ® или другие препараты, содержащие ацикловир (ацикловир является активным метаболитом препарата Валтрекс ® ), не выявили увеличения числа врожденных дефектов у их детей по сравнению с общей популяцией. Поскольку в регистр включено небольшое количество женщин, принимавших валацикловир во время беременности, то достоверных и определенных заключений о безопасности валацикловира при беременности сделать нельзя.
Ацикловир, основной метаболит валацикловира, экскретируется с грудным молоком. После назначения валацикловира в дозе 500 мг внутрь Cmax ацикловира в грудном молоке в 0,5–2,3 раза (в среднем в 1,4 раза) превышала соответствующие концентрации ацикловира в плазме крови матери. Среднее значение концентрации ацикловира в грудном молоке составляло 2,24 мкг/мл (9,95 мкмоль/л). При приеме матерью валацикловира в дозе 500 мг 2 раза в день ребенок подвергается такому же воздействию ацикловира, как при приеме его внутрь в дозе около 0,61 мг/кг/сут. T1/2 ацикловира из грудного молока такой же, как из плазмы крови.
Валацикловир в неизмененном виде не определялся в плазме или грудном молоке матери, моче ребенка.
Препарат Валтрекс ® следует назначать с осторожностью кормящим женщинам.
Побочные действия
Нежелательные реакции перечислены ниже в соответствии с классификацией по основным системам и органам и частоте встречаемости, которая была определена следующим образом: очень часто — ≥1/10; часто — ≥1/100 и
Данные клинических исследований
Со стороны нервной системы: часто — головная боль.
Со стороны ЖКТ: часто — тошнота.
Данные постмаркетинговых исследований
Со стороны системы крови и органов кроветворения: очень редко — лейкопения, тромбоцитопения. В основном лейкопения наблюдалась у больных со сниженным иммунитетом.
Со стороны иммунной системы: очень редко — анафилаксия.
Со стороны нервной системы и психики: редко — головокружение, спутанность сознания, галлюцинации, угнетение сознания; очень редко — ажитация, тремор, атаксия, дизартрия, психотические симптомы, судороги, энцефалопатия, кома. Перечисленные выше симптомы в основном обратимы и обычно наблюдаются у пациентов с нарушением функции почек или на фоне других предрасполагающих состояний. У взрослых пациентов с трансплантированным органом, получающих высокие дозы (8 г в день) препарата Валтрекс ® для профилактики ЦМВ-инфекции, неврологические реакции развиваются чаще, чем при приеме более низких доз.
Со стороны дыхательной системы и органов средостения: нечасто — одышка.
Со стороны ЖКТ: редко — дискомфорт в животе, рвота, диарея.
Со стороны печени и желчевыводящих путей: очень редко — обратимые нарушения функциональных печеночных проб, которые иногда расценивают как проявления гепатита.
Со стороны кожи и подкожно-жировой клетчатки: нечасто — высыпания, включая проявления фоточувствительности; редко — зуд; очень редко — крапивница, ангионевротический отек.
Со стороны мочевыделительной системы: редко — нарушение функции почек; очень редко — острая почечная недостаточность, почечная колика. Почечная колика может быть связана с нарушением функции почек.
Прочие: у больных с тяжелыми нарушениями иммунитета, особенно у взрослых пациентов с далеко зашедшей стадией ВИЧ-инфекции, получающих высокие дозы валацикловира (8 г ежедневно) в течение длительного периода времени, наблюдались случаи почечной недостаточности, микроангиопатической гемолитической анемии и тромбоцитопении (иногда в комбинации). Подобные осложнения были отмечены у пациентов с теми же основным и/или сопутствующими заболеваниями, но не получающих валацикловир.
Взаимодействие
Клинически значимые взаимодействия не установлены.
Ацикловир выводится почками, в основном в неизмененном виде, посредством активной почечной секреции. Сочетанное применение ЛС с этим механизмом выведения может привести к повышению концентрации ацикловира в плазме.
После назначения препарата Валтрекс ® в дозе 1 г, циметидин и пробенецид, которые выводятся тем же путем, что и препарат Валтрекс ® , повышают AUC ацикловира и т.о. снижают его почечный клиренс. Однако, ввиду широкого терапевтического индекса ацикловира, коррекция дозы препарата Валтрекс ® в этом случае не требуется.
Необходимо соблюдать осторожность в случае одновременного применения препарата Валтрекс ® в более высоких дозах (4 г/сут и выше) и лекарственных препаратов, которые конкурируют с ацикловиром за путь выведения, т.к. существует потенциальная угроза повышения в плазме концентрации одного или обоих препаратов или их метаболитов. Было отмечено повышение AUC ацикловира и неактивного метаболита микофенолата мофетила, иммунодепрессивного препарата, применяемого при трансплантации, при одновременном применении этих препаратов.
Необходимо также соблюдать осторожность (мониторинг функции почек) при сочетании препарата Валтрекс ® в более высоких дозах (4 г/сут и выше) с препаратами, которые оказывают влияние на другие функции почек (например циклоспорин, такролимус).
Способ применения и дозы
Внутрь, вне зависимости от приема пищи, запивая водой.
Лечение опоясывающего лишая (Herpes zoster): рекомендуемая доза составляет 1000 мг 3 раза в день в течение 7 дней.
Лечение инфекций, вызванных ВПГ: рекомендуемая доза для терапии эпизода составляет 500 мг 2 раза в день в течение 5 дней.
В более тяжелых случаях дебюта заболевания лечение следует начинать как можно раньше, а его продолжительность может быть увеличена с 5 до 10 дней. В случае рецидивов лечение должно продолжаться 3 или 5 дней. При рецидивах ВПГ идеальным считается назначение препарата Валтрекс ® в продромальном периоде или сразу же после появления первых симптомов заболевания. В качестве альтернативы для лечения лабиального герпеса эффективно назначение препарата Валтрекс ® в дозе 2 г 2 раза в день. Вторая доза должна быть принята приблизительно через 12 ч (но не раньше чем через 6 ч) после приема первой дозы. При использовании такого режима дозирования продолжительность лечения составляет 1 сут. Терапия должна быть начата при появлении самых ранних симптомов лабиального герпеса (т.е. пощипывание, зуд, жжение).
Профилактика (супрессия) рецидивов инфекций, вызванных ВПГ: у пациентов с сохраненным иммунитетом рекомендуемая доза составляет 500 мг 1 раз в сутки. У пациентов с иммунодефицитом рекомендуемая доза составляет 500 мг 2 раза в сутки.
Профилактика передачи генитального герпеса здоровому партнеру: у инфицированных иммунокомпетентных лиц с рецидивами не более 9 раз в год рекомендуемая доза препарата Валтрекс ® составляет 500 мг 1 раз в день в течение года и более каждый день.
Данные о профилактике инфицирования в других популяциях больных отсутствуют.
Взрослые и подростки в возрасте от 12 лет и старше
Профилактика ЦМВ-инфекции после трансплантации: рекомендуемая доза составляет 2 г 4 раза в день, назначается как можно раньше, после трансплантации.
Дозу следует снижать в зависимости от клиренса креатинина.
Продолжительность лечения составляет 90 дней, но у пациентов с высоким риском курс лечения может быть продлен.
Особые группы пациентов
Пациенты с нарушением функции почек. Лечение опоясывающего лишая и инфекций, вызываемых ВПГ, профилактика (супрессия) рецидивов инфекции, вызванной ВПГ, профилактика передачи генитального герпеса здоровому партнеру: дозу препарата Валтрекс ® рекомендуется уменьшать у пациентов со значительным снижением функции почек (см. таблицу 1). У таких пациентов необходимо поддерживать адекватную гидратацию.
Опыта применения препарата Валтрекс ® у детей со значениями Cl креатинина менее 50 мл/мин/1,73 м 2 нет.
Профилактика (супрессия) рецидивов инфекций, вызванных ВПГ
Пациентам, находящимся на гемодиализе, рекомендуется применять Валтрекс ® сразу после окончания сеанса гемодиализа в такой же дозе, как пациентам с Cl креатинина менее 15 мл/мин.
Профилактика ЦМВ-инфекции после трансплантации: режим назначения препарата Валтрекс ® у больных с нарушением функции почек должен устанавливаться в соответствии с таблицей 2, приведенной ниже.
| Cl креатинина, мл/мин | Доза препарата Валтрекс ® |
| 75 и более | 2 г 4 раза в день |
| от 50 до менее 75 | 1,5 г 4 раза в день |
| от 25 до менее 50 | 1,5 г 3 раза в день |
| от 10 до менее 25 | 1,5 г 2 раза в день |
| менее 10 или диализ 1 | 1,5 г 1 раз в день |
1 У пациентов, находящихся на гемодиализе, препарат Валтрекс ® следует назначать после окончания сеанса гемодиализа.
Необходимо часто определять клиренс креатинина, особенно в период, когда функция почек быстро меняется, например сразу после трансплантации или приживления трансплантата, при этом доза препарата Валтрекс ® корректируется в соответствии с показателями клиренса креатинина.
Пациенты с нарушением функции печени. У взрослых пациентов с нарушением функции печени легкой или умеренной степени тяжести при сохранной синтетической функции коррекция дозы препарата Валтрекс ® не требуется. Фармакокинетические данные у взрослых пациентов с тяжелыми нарушениями функции печени (декомпенсированный цирроз), нарушением синтетической функции печени и наличием портокавальных анастомозов также не свидетельствуют о необходимости корректировать дозу препарата Валтрекс ® , однако клинический опыт при данной патологии ограничен.
Дети до 12 лет. Нет данных о применении препарата Валтрекс ® у детей.
Пациенты пожилого возраста. Коррекция дозы не требуется, за исключением значительного нарушения функции почек. Необходимо поддерживать адекватный водно-электролитный баланс.
Передозировка
Симптомы: острая почечная недостаточность и неврологические нарушения, включая спутанность сознания, галлюцинации, ажитацию, угнетение сознания и кому, а также тошнота и рвота, наблюдались у пациентов, получивших дозы валацикловира, превышающие рекомендованные. Подобные состояния чаще отмечались у пациентов с нарушением функции почек и пациентов пожилого возраста, получивших повторные превышающие рекомендованные дозы валацикловира, вследствие несоблюдения режима дозирования.
Лечение: больные должны находиться под тщательным медицинским наблюдением. Гемодиализ в значительной степени способствует выведению ацикловира из крови и может считаться методом выбора при ведении пациентов с передозировкой препарата Валтрекс ® .
Особые указания
У пациентов с риском дегидратации, особенно у пациентов пожилого возраста, необходимо обеспечить адекватное восполнение жидкости.
Поскольку ацикловир выводится почками, доза препарата Валтрекс ® должна корректироваться в зависимости от степени нарушения почечной функции. У пациентов с почечной недостаточностью отмечается повышенный риск развития неврологических осложнений, таким пациентам необходимо обеспечить тщательное наблюдение. Как правило, эти реакции в основном носят обратимый характер после отмены препарата.
Нет данных о применении препарата Валтрекс ® в высоких дозах (4 г/сут и выше) у больных с заболеванием печени, поэтому высокие дозы препарата Валтрекс ® им должны назначаться с осторожностью. Специальные исследования по изучению действия препарата Валтрекс ® при пересадке печени не проводились. Однако было показано, что профилактическое в/в назначение ацикловира в высоких дозах уменьшает проявления ЦМВ-инфекции.
Супрессивная терапия препаратом Валтрекс ® снижает риск передачи генитального герпеса, но полностью не исключает риск инфицирования и не приводит к полному излечению. Терапия препаратом Валтрекс ® рекомендуется в сочетании с безопасным сексом.
Влияние на способность управлять транспортными средствами или работать с механизмами. Необходимо учитывать клиническое состояние пациента и профиль побочных реакций валацикловира при оценке способности пациента управлять автомобилем или движущимися механизмами.
Форма выпуска
Таблетки, покрытые пленочной оболочкой, 500 мг. В блистерах из ПВХ/алюминиевой фольги по 10 шт. 1 блистер в картонной пачке.
В блистерах из ПВХ/алюминиевой фольги по 6 шт. 7 блистеров в картонной пачке.
Производитель
Юридический адрес: Польша, г. Познань, 60-322, ул. Грюнвальдска 189.
Валацикловир (в виде гидрохлорида) представляет собой порошок от белого до не совсем белого цвета, молекулярная масса 360,8 Да. Максимальная растворимость в воде при 25 °C составляет 174 мг/мл.
Фармакологическое действие
Фармакология
Фармакодинамика
Механизм действия. Валацикловир является нуклеозидным аналогом ингибитора ДНК-полимеразы. Быстро превращается в ацикловир, который продемонстрировал противовирусную активность в отношении вируса простого герпеса (ВПГ) типов 1 (ВПГ-1) и 2 (ВПГ-2) и вируса ветряной оспы как в культуре клеток, так и в естественных условиях. Ингибирующая активность ацикловира является высокоселективной благодаря его сродству к ферменту тимидинкиназе (ТК), кодируемому ВПГ и вирусом ветряной оспы. Этот вирусный фермент превращает ацикловир в монофосфат ацикловира, аналог нуклеотида. Монофосфат далее преобразуется в дифосфат клеточной гуанилаткиназой и в трифосфат рядом клеточных ферментов. В биохимических анализах ацикловир трифосфат ингибирует репликацию ДНК вируса герпеса. Это достигается 3 способами: конкурентное ингибирование вирусной ДНК-полимеразы, включение в цепь ДНК и прекращение растущей цепи вирусной ДНК и инактивация вирусной ДНК-полимеразы. Бóльшая противовирусная активность ацикловира в отношении ВПГ по сравнению с вирусом ветряной оспы обусловлена его более эффективным фосфорилированием вирусной ТК.
Противовирусная активность. Количественная взаимосвязь между восприимчивостью культуры клеток герпесвирусов к противовирусным ЛС и клиническим ответом на терапию у людей не установлена и тестирование на чувствительность к вирусам не стандартизировано. Результаты тестирования чувствительности, выраженные в концентрации, необходимой для подавления на 50% роста вируса в культуре клеток (EC50), сильно различаются в зависимости от ряда факторов. Значения EC50 для изолятов вируса простого герпеса варьируют от 0,09 до 60 мкмоль/л (0,02–13,5 мкг/мл) для ВПГ-1 и от 0,04 до 44 мкмоль/л (0,01–9,9 мкг/мл) для ВПГ-2. Значения EC50 для ацикловира по отношению к большинству лабораторных штаммов и клинических изолятов вируса ветряной оспы варьируют от 0,53 до 48 мкмоль/л (0,12–10,8 мкг/мл). Ацикловир также демонстрирует активность против штамма Ока вируса ветряной оспы со средним значением EC50 6 мкмоль/л (1,35 мкг/мл).
Устойчивость. Устойчивость ВПГ и вируса ветряной оспы к ацикловиру может быть результатом качественных и количественных изменений в вирусной ТК и/или ДНК-полимеразе. Клинические изоляты вируса ветряной оспы с пониженной чувствительностью к ацикловиру были получены от пациентов со СПИДом. В этих случаях были обнаружены мутировавшие варианты вируса ветряной оспы с дефицитом TK. Устойчивость ВПГ и вируса ветряной оспы к ацикловиру формируется по одинаковому механизму. В то время как большинство устойчивых к ацикловиру мутантов, выделенных до настоящего времени от пациентов с ослабленным иммунитетом, были признаны мутантами с дефицитом ТК, также были выделены другие мутанты с изменениями в вирусной ТК (частичная ТК и измененная ТК) и ДНК-полимеразе. TK-отрицательные мутанты могут вызывать тяжелые заболевания у пациентов с ослабленным иммунитетом. Возможность вирусной резистентности к валацикловиру (и следовательно к ацикловиру) следует учитывать у пациентов, которые демонстрируют плохой клинический ответ во время терапии.
Фармакокинетика
Фармакокинетика валацикловира и ацикловира после перорального приема изучалась в 14 исследованиях с участием 283 взрослых добровольцев и в 3 исследованиях с участием 112 детей от 1 мес до
Всасывание и биодоступность
После перорального приема валацикловир быстро всасывается из ЖКТ и почти полностью превращается в ацикловир и L-валин в результате метаболизма при первичном прохождении через кишечник и/или печень. Абсолютная биодоступность ацикловира составляет (54,5±9,1)% после перорального применения валацикловира в дозе 1 г и в/в введения ацикловира в дозе 350 мг у 12 здоровых добровольцев. Биодоступность ацикловира не изменяется при приеме валацикловира с пищей (через 30 мин после завтрака с 873 ккал, который включал 51 г жира). Наблюдалось менее чем пропорциональное дозе увеличение Cmax ацикловира и AUC после однократного и многократного (4 раза в день) применения валацикловира в дозах от 250 мг до 1 г.
У взрослых с нормальной функцией почек после приема валацикловира в рекомендуемых режимах дозирования ацикловир не накапливается.
Фармакокинетические параметры ацикловира в плазме крови после применения валацикловира у здоровых взрослых добровольцев (среднее значение ± стандартное отклонение)
| Доза, мг | Разовая доза (n=8) | Многократное введение (n= 24, 8 групп получавших лечение) | ||
| Cmax, мкг/мл | AUC, мкг·ч/мл | Cmax, мкг/мл | AUC, мкг·ч/мл | |
| 100 | 0,83 (±0,14) | 2,28 (±0,4) | Нет данных | Нет данных |
| 250 | 2,15 (±0,50) | 5,76 (±0,6) | 2,11 (±0,33) | 5,66 (±1,09) |
| 500 | 3,28 (±0,83) | 11,59 (±1,79) | 3,69 (±0,87) | 9,88 (±2,01) |
| 750 | 4,17 (±1,14) | 14,11 (±3,54) | Нет данных | Нет данных |
| 1000 | 5,65 (±2,37) | 19,52 (±6,04) | 4,96 (±0,64) | 15,7 (±2,27) |
Распределение
Связывание валацикловира с белками плазмы крови человека колеблется от 13,5 до 17,9%. Связывание ацикловира с белками плазмы крови — от 9 до 33%.
Валацикловир превращается в ацикловир и L-валин в результате метаболизма при первичном прохождении через кишечник и/или печень. Ацикловир в небольшой степени превращается в неактивные метаболиты при участии альдегидоксидазы и алкоголь- и альдегиддегидрогеназы. Ни валацикловир, ни ацикловир не метаболизируются с участием СYР450. Концентрация неизмененного валацикловира в плазме крови была низкой, обычно не поддающейся количественному определению через 3 ч после введения. Cmax валацикловира в плазме крови обычно составляет менее 0,5 мкг/мл при всех дозах. После однократного применения 1 г валацикловира средняя концентрация валацикловира в плазме крови составляла 0,5; 0,4 и 0,8 мкг/мл у пациентов с дисфункцией печени, почечной недостаточностью и у здоровых добровольцев, которые одновременно получали циметидин и пробенецид соответственно.
Фармакокинетическое распределение ацикловира, образующегося из валацикловира, согласуется с предыдущим опытом применения ацикловира в/в и перорально. После приема внутрь однократной дозы 1 г радиоактивно меченного валацикловира у 4 здоровых добровольцев 46 и 47% введенных радиоактивных веществ были выявлены в моче и кале соответственно в течение 96 ч. На ацикловир приходилось 89% радиоактивных веществ, выделяемых с мочой. Почечный клиренс ацикловира после введения однократной дозы валацикловира, равной 1 г, у 12 здоровых добровольцев составил приблизительно (255±86) мл/мин, что составляет 42% от общего кажущегося клиренса ацикловира в плазме крови. T1/2 ацикловира в плазме крови обычно составлял в среднем 2,5–3,3 ч во всех исследованиях с применением валацикловира у добровольцев с нормальной функцией почек.
Особые группы населения
Нарушение функции почек. Пациентам с нарушением функции почек рекомендуется снизить дозировку. После введения валацикловира добровольцам с терминальной почечной недостаточностью, T1/2 ацикловира составляет приблизительно 14 ч. Во время гемодиализа период полужизни ацикловира составляет примерно 4 ч. Примерно одна треть ацикловира в организме выводится с помощью диализа во время 4-часового сеанса гемодиализа. Кажущийся плазменный клиренс ацикловира у пациентов, находящихся на диализе, составил (86,3±21,3) мл/мин/1,73 м 2 по сравнению с (679,16±162,76) мл/мин/1,73 м 2 у здоровых добровольцев.
Нарушение функции печени. Назначение валацикловира пациентам с умеренным (цирроз, подтвержденный биопсией) или тяжелым (с асцитом и без цирроза, подтвержденного биопсией) заболеванием печени показало, что снижается скорость, но не степень превращения валацикловира в ацикловир, и T1/2 ацикловира не изменяется. Изменение дозы не рекомендуется у пациентов с циррозом печени.
Пожилой возраст. После однократного применения 1 г валацикловира у здоровых добровольцев пожилого возраста T1/2 ацикловира составлял (3,11±0,51) ч по сравнению с (2,91±0,63) ч у здоровых молодых взрослых добровольцев. Фармакокинетика ацикловира после однократного и многократного перорального приема валацикловира у пожилых добровольцев варьировала в зависимости от функции почек. У пожилых пациентов может потребоваться снижение дозы, в зависимости от основного состояния почек пациента.
Дети. Фармакокинетика ацикловира была оценена в общей сложности у 98 педиатрических пациентов (от 1 мес до
Фармакокинетические параметры ацикловира в плазме крови после применения первой дозы валацикловира 20 мг/кг в виде пероральной суспензии у педиатрических пациентов по сравнению со взрослыми, принимавшими валацикловир однократно в дозе 1 г (среднее значение ± стандартное отклонение)
| Параметр | Дети | Взрослые (n=15) | ||
| 1 год– | 2 года– | 6– | ||
| AUC, мкг·ч/мл | 14,4 (±6,26) | 10,1 (±3,35) | 13,1 (±3,43) | 17,2 (±3,1) |
| Cmax, мкг/мл | 4,03 (±1,37) | 3,75 (±1,14) | 4,71 (±1,2) | 4,72 (±1,37) |
Канцерогенез, мутагенез, влияние на репродуктивную функцию
Валацикловир не был канцерогенным в прижизненных биотестах на животных при однократных суточных дозах, дающих концентрацию ацикловира в плазме, эквивалентную достигаемой у человека, в биотесте на мышах, и в 1,4–2,3 раза превышающую уровень у человека, в биотесте на крысах. Не выявлено существенной разницы в частоте развития опухолей между испытуемыми и контрольными животными, и валацикловир не сокращал латентность опухолей.
Валацикловир был протестирован в 5 анализах генетической токсичности. Тест Эймса показал отрицательный результат при отсутствии или наличии метаболической активации. Также отрицательными были результаты цитогенетического исследования in vitro с лимфоцитами человека и результаты цитогенетического исследования у крыс. В анализе лимфомы мыши валацикловир не был мутагенным при отсутствии метаболической активации. При наличии метаболической активации (от 76 до 88% превращения в ацикловир) валацикловир был мутагенным. Валацикловир был мутагенным в микроядерном анализе у мышей.
Валацикловир не ухудшал фертильность или репродуктивность у крыс при уровне, в 6 раз превышающем МРДЧ.
Клинические исследования
Лабиальный герпес
Были проведены два двойных слепых плацебо-контролируемых клинических исследованиях с участием 1856 здоровых взрослых и подростков (≥12 лет) с рецидивирующими герпесными язвами в анамнезе. Пациенты самостоятельно начали терапию при самых ранних симптомах и до появления любых признаков герпеса. Большинство пациентов начали лечение в течение 2 ч после появления симптомов. Пациенты были рандомизированы на группы, получающие валацикловир в дозе по 2 г 2 раза в день в 1-й день с последующим плацебо во 2-й день, валацикловир в дозе по 2 г 2 раза в день в 1-й день с последующим применением в дозе 1 г 2 раза в день во 2-й день или плацебо в 1-й и 2-й дни. Средняя продолжительность эпизодов герпеса была примерно на 1 день короче у пациентов, получавших лечение, по сравнению с плацебо. Двухдневный режим дозирования не давал дополнительных преимуществ по сравнению с однодневным. Между пациентами, получавшими валацикловир или плацебо, не наблюдалось существенной разницы в предотвращении прогрессирования герпетических поражений после папулезной стадии.
Генитальный герпес
Начальный эпизод. 643 иммунокомпетентных взрослых с первым эпизодом генитального герпеса, который возник в течение 72 ч после появления симптомов, были рандомизированы в двойном слепом исследовании для получения в течение 10 дней валацикловира по 1 г 2 раза в день (n=323) или ацикловира для перорального приема по 200 мг 5 раз в день (n=320). В обеих группах лечения среднее время заживления поражения составило 9 дней, среднее время до прекращения боли — 5 дней, среднее время до прекращения вирусного выделения — 3 дня.
Повторяющиеся эпизоды. Были проведены 3 двойных слепых исследования (2 из них плацебо-контролируемые) с участием иммунокомпетентных взрослых с рецидивирующим генитальным герпесом. Пациенты самостоятельно начали терапию в течение 24 ч после появления первых признаков или симптомов рецидива генитального герпеса. В первом исследовании пациенты были рандомизированы для получения 5-дневного лечения либо валацикловиром по 500 мг 2 раза в день (n=360), либо плацебо (n=259). Среднее время до заживления поражения составило 4 дня в группе, получавшей валацикловир в дозе 500 мг, по сравнению с 6 днями в группе плацебо, а среднее время до прекращения выделения вируса у пациентов с по крайней мере 1 положительной культурой (42% от общей популяции исследования) составило 2 дня в группе, получавшей валацикловир по 500 мг, по сравнению с 4 днями в группе плацебо. Среднее время до прекращения боли составило 3 дня в группе, получавшей валацикловир по 500 мг, по сравнению с 4 днями в группе плацебо. Результаты, подтверждающие эффективность, были воспроизведены во втором исследовании. В третьем исследовании пациенты были рандомизированы для приема валацикловира по 500 мг 2 раза в день в течение 5 дней (n=398) или валацикловира по 500 мг 2 раза в день в течение 3 дней (и соответственно плацебо 2 раза в день в течение 2 дополнительных дней) (n=402). Среднее время заживления поражения составило около 4 с половиной дней в обеих группах лечения. Среднее время до прекращения боли составило около 3 дней в обеих группах лечения.
Супрессивная терапия. Было проведено два клинических исследования, одно с участием иммунокомпетентных взрослых и одно с участием ВИЧ-инфицированных взрослых. В двойное слепое 12-месячное плацебо-контролируемое исследование и исследование с активным контролем были включены иммунокомпетентные взрослые с историей 6 или более рецидивов в год. Результаты для всей исследуемой популяции показаны в таблице 3.
Частота рецидивов у иммунокомпетентных взрослых в течение 6 и 12 мес
| Исход | 6 мес | 12 мес | ||||
| Валацикловир, 1 г 1 раз в день (n=296) | Ацикловир для перорального приема, 400 мг 2 раза в день (n=267) | Плацебо (n=134) | Валацикловир, 1 г 1 раз в день (n=296) | Ацикловир для перорального приема, 400 мг 2 раза в день (n=267) | Плацебо (n=134) | |
| Без повторений | 55% | 54% | 7% | 34% | 34% | 4% |
| Повторения | 35% | 36% | 83% | 46% | 46% | 85% |
| Неизвестно 1 | 10% | 10% | 10% | 19% | 19% | 10% |
1 Включая пациентов, недоступных для последующего наблюдения, прекративших прием из-за неблагоприятных событий и отозвавших согласие.
Пациенты с 9 или менее рецидивами в год показали результаты, сопоставимые с приемом валацикловира в дозе 500 мг 1 раз в день.
Частота рецидивов у ВИЧ-инфицированных взрослых в течение 6 мес
| Исход | Валацикловир, 500 мг 2 раза в день (n=194) | Плацебо (n=99) |
| Без повторений | 65% | 26% |
| Повторения | 17% | 57% |
| Неизвестно 1 | 18% | 17% |
1 Включая данные, полученные у субъектов, недоступных для последующего наблюдения, прекративших прием из-за неблагоприятных событий и отозвавших согласие.
Снижение передачи генитального герпеса. Двойное слепое плацебо-контролируемое исследование для оценки передачи генитального герпеса было проведено с участием 1484 моногамных, гетеросексуальных, иммунокомпетентных взрослых пар. Пары были несовместимы по инфекции ВПГ-2. У исходного партнера в анамнезе было 9 или менее эпизодов генитального герпеса в год. Обоим партнерам были даны рекомендации по безопасному сексу и рекомендовано использовать барьерную контрацепцию в течение всего периода исследования. Партнеры-источники были рандомизированы для лечения либо валацикловиром по 500 мг 1 раз в день, либо плацебо 1 раз в день в течение 8 мес. Первичной конечной точкой эффективности было выявление симптомов ВПГ-2 у восприимчивых партнеров. Общее инфицирование ВПГ-2 определялось как инфицирование, определяемое по симптомам ВПГ-2 и/или как сероконверсия (появление специфических антигенных детерминант вируса, выявляемое серологическими методами анализа) ВПГ-2 у восприимчивых партнеров. Результаты эффективности обобщены в таблице 5.
Доля восприимчивых партнеров, которые приобрели ВПГ-2, определяемый первичными и выбранными вторичными конечными точками
| Конечная точка | Валацикловир 1 (n=743) | Плацебо (n=741) |
| Симптоматическое инфицирование ВПГ-2 | 4 (0,5%) | 16 (2,2%) |
| Сероконверсия ВПГ-2 | 12 (1,6%) | 24 (3,2%) |
| Общее инфицирование ВПГ-2 | 14 (1,9%) | 27 (36%) |
1 Результаты показывают снижение риска на 75% (симптоматическое инфицирование ВПГ-2), 50% (сероконверсия ВПГ-2) и 48% (общее инфицирование ВПГ-2) при применении валацикловира по сравнению с плацебо. Индивидуальные результаты могут варьировать в зависимости от последовательности практик безопасного секса.
Опоясывающий лишай
Были проведены два рандомизированных двойных слепых клинических испытания с участием иммунокомпетентных взрослых с локализованным опоясывающим герпесом. Валацикловир сравнивали с плацебо у пациентов моложе 50 лет и с пероральным ацикловиром у пациентов старше 50 лет. Все пациенты получали лечение в течение 72 ч после появления опоясывающей сыпи. У пациентов в возрасте до 50 лет среднее время до прекращения образования новых очагов поражения составляло 2 дня для тех, кто получал валацикловир, по сравнению с 3 днями для тех, кто получал плацебо. У пациентов старше 50 лет среднее время до прекращения появления новых поражений составляло 3 дня у пациентов, получавших валацикловир или пероральный ацикловир. У пациентов в возрасте до 50 лет не было обнаружено различий в продолжительности боли после заживления (постгерпетическая невралгия) между теми, кто получал валацикловир и плацебо. У пациентов старше 50 лет среди 83%, которые сообщили о боли после заживления (постгерпетическая невралгия), средняя продолжительность боли после заживления (95% ДИ) в днях составляла 40 (31, 51), 43 (36, 55) и 59 (41, 77) для 7-дневного приема валацикловира, 14-дневного приема валацикловира и 7-дневного перорального приема ацикловира соответственно.
Читайте также:

