Годков м а гепатит
Обновлено: 25.04.2024
Актуальность. Психиатрические стационары, где находятся пациенты с иммунодефицитными состояниями, часто не соблюдающие элементарных мер профилактики, а также получающие широкий спектр лечебных процедур, в том числе парентеральных, во всем мире являются учреждениями высокого риска распространения в них социально значимых инфекций.
Цель — изучить современные эпидемиологические особенности парентеральных гепатитов в крупном психиатрическом стационаре среди различных категорий душевнобольных (с туберкулезом легких и ВИЧ-инфекцией) и медицинского персонала.
Материал и методы. Определены серологические маркеры гепатита В (ГВ) и гепатита С (ГС) у 8352 больных и 542 сотрудников крупного психиатрического стационара с применением отечеств енных диагностических тест-систем.
Результаты. Маркеры ГВ и ГС среди больных выявлены у 7,3% лиц (ГС — 3,1%, ГВ — 2,8% и ГВ+ГС — 1,4%). Проведен анализ половых, возрастных и социальных характеристик пациентов с наличием маркеров вирусов ГВ и ГС. У ВИЧ-инфицированных пациентов значительно чаще были выявлены маркеры ГС (44,4% лиц); основные пути передачи ГВ и ГС — внутривенное употребление наркотиков и половой путь. Среди пациентов с туберкулезом легких обнаружено максимальное количество лиц с маркерами ГВ (44,3%) и ГВ+ГС (38,2%); основная клиническая форма туберкулеза легких представлена инфильтративной формой (60,4%); в 53,7% случаев выявлены бациллярные формы туберкулеза, представляющие серьезную эпидемиологическую опасность распространения туберкулеза в стационаре. Анализ социальной структуры показал, что ГВ+ГС+ВИЧ и туберкулез легких характерны для лиц с отягощенным социальным статусом. Наиболее частыми факторами инфицирования ГВ и ГС является длительная парентеральная нагрузка и внутривенное употребление наркотических веществ. Наибольший коэффициент парентеральной нагрузки отмечается у душевнобольных с ГВ+ГС и сопутствующим туберкулезом. Частота выявления маркеров ГВ и ГС среди медицинского персонала зависит от характера и стажа работы, частоты и степени контакта с кровью в процессе профессиональной деятельности.
Заключение. Установлен высокий уровень коморбидности психических расстройств и социально значимых инфекционных заболеваний (ВИЧ-инфекция, туберкулез, ГВ и ГС), что оказывает существ енное влияние на эпидемический процесс этих инфекций. Профилактические программы, создаваемые в стационарах и на обслуживаемых ими территориях, должны учитывать аспекты их коморбидности. Показана необходимость специфической и неспецифической профилактики вирусных гепатитов у пациентов и медицинского персонала психиатрических стационаров.
Ключевые слова
Актуальность
Психиатрические стационары во всем мире являются учреждениями высокого риска распространения в них социально значимых инфекций. В этих профильных стационарах находятся пациенты с иммунодефицитными состояниями, часто не соблюдающие элементарных мер профилактики, также они получают широкий спектр лечебных процедур, в том числе парентеральных 2. Психические расстройства наряду с вирусными гепатитами В (ГВ) и С (ГС), туберкулезом, ВИЧ-инфекцией, злокачественными новообразованиями входят в перечень социально значимых заболеваний, утвержденный постановлением Правительства РФ № 715 от 01.12.2004.
Вследствие традиционной закрытости информации эпидемиологические закономерности и особенности этих инфекций в лечебно-профилактических учреждениях данного профиля изучены недостаточно. Для обоснования адекватных мер их профилактики в данных стационарах необходимы дальнейшие научные исследования распространения серологических маркеров вирусов гепатитов, ВИЧ-инфекции среди пациентов и медицинского персонала, проявлений эпидемического процесса упомянутых инфекций, групп риска инфицирования, основных путей и факторов передачи возбудителей, доминирующих причин и условий распространения парентеральных вирусных гепатитов внутри психиатрических стационаров.
С учетом большого количества безжелтушных, скрытых, атипичных клинических форм ГВ и ГС выявлять маркеры инфицирования и изучать эпидемиологические особенности возможно только с помощью широкого применения адекватных лабораторных методов, которые должны быть доступны в стационарах [12].
Цель исследования — изучить современные эпидемиологические особенности парентеральных гепатитов в крупном психиатрическом стационаре среди различных категорий душевнобольных (с туберкулезом легких и ВИЧ-инфекцией) и медицинского персонала.
Материал и методы
С целью определения частоты выявления серологических маркеров ГВ и ГС проанализированы результаты обследований пациентов (8352 больных) и медицинского персонала лечебных отделений и параклинических служб (542 человека) крупного психиатрического стационара.
Сыворотки от пациентов психиатрического стационара были исследованы на наличие маркеров вирусов ГВ и ГС (MsAg, НВеАg, антитела классов М и G к НВs-, НВе-, НВсАg; анти-ВГС, спектр анти-ВГС IgM и G) методом ИФА отечественными диагностическими тест-системами.
Образцы сыворотки крови медицинского персонала исследованы на наличие HBsAg, анти-HBs, анти-HBc, анти-ВГС методом ИФА отечественными диагностическими тест-системами.
Для оценки достоверности и значимости различий сравниваемых относительных величин рассчитывали ошибку достоверности (p) на основании критерия Стьюдента (t). Определяли доверительные интервалы с расчетом средних ошибок сравниваемых показателей — m(o).
Результаты и обсуждение
Данные исследования сывороток крови на наличие серологических маркеров у 8352 пациентов (21,8 % пролеченных в стационаре) свидетельствуют о наличии маркеров ГВ и ГС у 604 пациентов (7,23% обследованных), при этом в форме моноинфекции — у 2,76% и 3,08% соответственно, в виде сочетанной инфекции — у 1,39%. Не исключается также наличие скрытых форм ГВ, как это было показано для стационаров другого профиля [13].
Среди душевнобольных пациентов, инфицированных ВИЧ (п = 179), маркеры вируса ГВ обнаружены у 1,9%, микст-инфекция вирусами ГВ и ГС — у 3,7%. Статистически значимо чаще были выявлены маркеры вируса ГС — у 44,4% лиц (p < 0,05).
Таким образом, заражение вирусными гепатитами у ВИЧ-инфицированных пациентов психиатрического стационара происходило преимущественно при внутривенном употреблении наркотиков и половым путем (до поступления в стационар).
Из 604 носителей вирусов ГВ и ГС у 212 был выявлен сопутствующий туберкулез легких (35%). Результаты выявления у них маркеров вирусов ГВ и ГС показали, что у 44,33% обнаружены маркеры вируса ГВ, у 17,45% — вируса гС, у 38,22% — ГВ+ГС.
Анализ структуры клинических форм туберкулеза показал, что на долю инфильтративного туберкулеза приходилось 128 (60,4%) случаев, очагового туберкулеза — 32 (15,1%), фиброзно-кавернозного — 17 (8,1%), диссеминированных форм туберкулеза — 35 (16,5%). Следует отметить, что среди этой группы пациентов 53,7% случаев (114 лиц) приходилось на бациллярные формы туберкулеза, что представляло серьезную эпидемиологическую опасность и способствовало распространению туберкулеза в данном стационаре.
Полученные данные свидетельствуют о высоком уровне коморбидности психических расстройств и социально значимых инфекционных заболеваний (вирусные ГВ и ГС, ВИЧ-инфекция, туберкулез). Очевидно, что оба этих вида патологии (психические расстройства и социально значимые инфекции) могут потенцировать друг друга и оказывать тем самым существенное влияние на эпидемический процесс этих инфекций. Поэтому профилактические программы, создаваемые в стационарах и на обслуживаемых ими территориях, должны учитывать аспекты их коморбидности.
Анализ половых, возрастных и социальных характеристик пациентов психиатрических стационаров Московского региона — носителей вирусов ГВ и ГС (п = 5407) позволил установить, что маркеры вирусов ГВ и ГС одинаково часто определялись как среди мужчин (48,28%), так и среди женщин (51,71%). При этом женщины чаще были инфицированы вирусом ГВ по сравнению с мужчинами, а мужчины — вирусом ГС и сочетанием вирусов ГВ и ГС (р < 0,02).
Маркеры вирусов ГВ и ГС были обнаружены наиболее часто у мужчин в возрастной группе 1925 лет, а у женщин — в возрастных группах 26-30, 31-40, 51-60 лет (р < 0,00001). В более старших возрастных группах различия в частоте выявления маркеров вирусов ГВ и ГС как среди мужчин, так и среди женщин были незначительными.
В целом тенденция вовлеченности в эпидемический процесс социально и репродуктивно активной части населения характерна и для пациентов психиатрических учреждений, как и для населения в целом.
Анализ социальной структуры пациентов психиатрических стационаров, инфицированных вирусами ГВ и ГС, показал, что, как правило, микст-инфекция (ГВ+ГС в сочетании с инфицированием ВИЧ и различными формами туберкулеза легких) характерна для социально дезадаптированных лиц: неработающих, лиц без определенного места жительства, с неудовлетворительными жилищными и социально-бытовыми условиями жизни, злоупотребляющих алкоголем, наркотиками и т.п. (см. рисунок). В группах пациентов с моноинфекцией (ГВ или ГС), напротив, превалируют социально адаптированные пациенты, что подчеркивает значимость социальных условий для возникновения психических заболеваний и проявлений сопутствующих инфекций.

Социальная структура пациентов психиатрических стационаров, инфицированных вирусами ГВ и ГС
The social structure of patients in psychiatric hospitals infected with hepatitis B (HB) and hepatitis C (HC) viruses
Эпидемиологический анализ позволил изучить структуру путей передачи вирусов ГВ и ГС у пациентов психиатрического стационара. Для этого среди пациентов, принадлежащих к возрастным группам, среди которых отмечено наибольшее распространение серологических маркеров вирусов ГВ и ГС, определяли коэффициент парентеральной нагрузки (КПН) — сумму эпидемиологических признаков анамнеза (частота половых контактов, кратность внутривенного использования наркотических и психоактивных веществ, наличие хирургических, стоматологических вмешательств, гемотрансфузий, парентеральных процедур):
Исследованием были охвачены 193 пациента, в том числе 88 с сопутствующим туберкулезом легких, 57 из которых имели микст-инфекцию (ГВ+ГС+ туберкулез), при этом 99 пациентов (51,29%) были лицами мужского пола, а 94 (48,7%) — женского.
В группе пациентов с микст-инфекцией ГВ+ГС и сопутствующим туберкулезом легких (КПН = 4,2 ± 0,87), а также в группе инфицированных вирусом ГС (КПН = 3,2 ± 0,72) КПН был достаточно высоким (>3 баллов). При ГВ он оценен как средний (КПН = 2,7 ± 0,57), что подтверждает ведущее значение парентерального пути передачи вирусов ГВ и ГС среди пациентов психиатрического стационара.
Кроме того, выявлена прямая корреляционная связь между КПН и частотой выявления маркеров ГВ и ГС у душевнобольных с сопутствующим туберкулезом легких (г = 0,81).
Одной из задач нашего исследования явилось выявление причин и частоты инфицирования вирусами ГВ и ГС медицинского персонала, который относится к группе повышенного риска инфицирования данными возбудителями в связи с профессиональной деятельностью [14, 15].
Обследовано на наличие серологических маркеров ГВи ГС-инфекции 542 медицинских работника 24 профильных учреждений, в том числе 5 фтизиопсихиатрических отделений крупного психиатрического стационара и 8 параклинических служб. Из них 27% были мужчинами и 73% — женщинами, средний возраст 36,7 ± 0,6 года. Скрининг проводился до массовой вакцинации против ГВ.
Выявлено широкое, но неравномерное распределение маркеров ГВи ГС-инфекции среди сотрудников различных лечебных отделений и параклинических служб психиатрического стационара (см. таблицу). Наивысшие показатели наличия маркеров ГВ выявлены в лабораторно-диагностическом отделении (27,3%), вторую группу по частоте обнаружения НВsAg составили сотрудники фтизиопсихиатрических отделений (18,34%), третья группа включала медицинский персонал острых психиатрических отделений и консультативной поликлиники (8,3-9,6%). В данных группах медицинского персонала установлены достоверные различия по частоте обнаружения НВsAg (р < 0,05).
Частота выявления маркеров вирусов ГВ и ГС у сотрудников различных подразделений психиатрического стационара
The frequency of detection of HB and HC virus markers in employees of various units of a psychiatric hospital
ВПП — внепеченочное поражение
ИК — иммунные комплексы
КГС — криоглобулинемический синдром
МКГН — мезангиокапиллярный гломерулонефрит
ПВТ — противовирусная терапия
РФ — ревматоидный фактор
СКГ — смешанная криоглобулинемия
СШ — синдром Шегрена
ТИН — тубулоинтерстициальный нефрит
УП — узелковый полиартериит
ФА — фиброзирующий альвеолит
ХГВ — хронический гепатит В
ХГН — хронический гломерулонефрит
ХГС — хронический гепатит С
ЦП — цирроз печени
ЩЖ — щитовидная железа
HBV — вирус гепатита В
HCV — вирус гепатита С
Изучение хронических вирусных поражений печени выявило широкий спектр внепеченочных проявлений хронического гепатита В (ХГВ), а впоследствии, при открытии вируса гепатита С, и хронического гепатита С (ХГС).
В России ведущая роль в изучении системности поражения при вирусных заболеваниях печени принадлежит исследованиям, проведенным в клинике им. Е.М. Тареева: изучение хронического активного гепатита как системного заболевания (З.Г. Апросина, 1974 г., 1981 г.), внепеченочных поражений при ХГС (Т.М. Игнатова, 2000 г.; А.В. Русских, 2004 г.; С.Ю. Милованова, 2005 г.; С.Ю. Карпов, 2005 г.) и ХГВ (А.А. Ильянкова, 2001 г.; Д.Т. Абдурахманов, 2003 г.; М.М. Ибрагимова, 2004 г.; П.Е. Крель, 1995 г.; С.В. Тэгай, 2003 г.; А.В. Русских, 2004 г.), поражения системы крови (Л.А. Гусейнова, 1981 г.), поражения легких (А.С. Дроздова, 1989 г.), синдрома Шегрена (Т.Н. Лопаткина, 1980 г.; О.В. Чернецова, 2004 г.), поражения почек (А.В. Потапова, 1989 г.; Е.Н. Косминкова, 1992 г.), системных васкулитов при вирусных гепатитах (Е.Н. Семенкова, 1994).
В развитии внепеченочных поражений основное значение имеют иммунные реакции, возникающие в ответ на репликацию вирусов гепатита В (HBV) или С (HCV) в печени, в тканях лимфоидного и нелимфоидного происхождения. Предположения о наличии внепеченочной локализации репликации HBV или HCV возникли в связи с наблюдением случаев быстро развивающегося острого гепатита у пациентов с вирусным циррозом печени (ЦП) после пересадки здоровой донорской печени, что объяснялось внепеченочной локализацией вирусов [1]. Помимо иммунных нарушений в возникновении системных поражений имеет значение прямое цитопатическое действие вирусов гепатита, при этом часто внепеченочное поражение (ВПП) служит единственным проявлением вирусной инфекции и может определять прогноз и тактику лечения заболевания.
Особенности ХГВ с ВПП. У 10—20% больных ХГВ [2]встречаются ВПП, которые включают широкий спектр поражений различных органов и систем.
Поражения кожи, наблюдаемые при острых и хронических болезнях печени, обусловленные HBV, весьма вариабельны и включают макулярные, макулопапулезные, папуловезикулярные высыпания, рецидивирующую крапивницу, петехии, пурпуру, узловатую эритему, скарлатиноподобную сыпь, гангренозную пиодермию, витилиго, гиперпигментацию и изъязвления в области нижних конечностей, аллергический капиллярит, пурпуру Шенлейна—Геноха [3—7].
Смешанная криоглобулинемия (СКГ) встречается у 3—17% больных ХГВ, может проявляться кожной пурпурой, артритами и/или артралгиями, поражением почек, синдромом Рейно [5, 6, 8, 9].
Поражение почек при ХГВ протекает в 3 формах — хронический гломерулонефрит (ХГН), тубулоинтерстициальный нефрит (ТИН), а также при HBV-ассоциированном узелковом полиартериите (УП) [10—16]. Частота поражения почек при ХГВ составляет 14%, в том числе ХГН 12,6%, ТИН 1,4% [11]. В клубочках выявляются депозиты различных антигенов HBV, у отдельных больных в ткани почки обнаружена ДНК HBV [13]. Иммунные комплексы (ИК) могут активировать комплемент и вызывать поражение клубочков путем формирования мембраноатакующих комплексов и дальнейшего каскада реакций, таких как индукция протеаз, оксидативное повреждение и разрушение цитоскелета нефрона [14].
УП—системный васкулит с поражением средних и мелких артерий. В патогенезе HBV-ассоциированной формы важную роль играют циркулирующие ИК, содержащие вирусные белки [15]. По данным Е.Н. Семенковой, инфицирование HBV выявляется в 56,9% случаев УП. [16] Отмечено, что почти все случаи УП, ассоциированного с HBV, связаны с инфекцией HBV дикого типа, характеризующейся HBe-антигенемией и выраженной репликацией HBV. Предположительно повреждение почек происходит в результате отложения вирусных ИК HBeAg-HBeAb [15].
В целом хроническая инфекция HBV вызывает широкий спектр ВПП, в генезе которых имеют значение как иммунокомплексные реакции, так и реакции гиперчувствительности замедленного типа. ВПП ХГВ могут длительно маскировать поражение печени, являясь ведущими клиническими признаками болезни и нередко определяющими прогноз заболевания. Однако с введением программ массовой вакцинации против HBV инфицированность населения начала снижаться. Открытие HСV в 1989 г. положило начало активному изучению обширного спектра ВПП при этой инфекции.
Особенности ХГС с ВПП. Согласно различным исследованиям у 40—74% пациентов, инфицированных HСV, может быть хотя бы одно ВПП за время течения болезни [17—19]. Более того, часто внепеченочные симптомы служат первыми проявлениями инфекции HCV в отсутствие у ряда больных признаков поражения печени. Для ХГС характерно развитие ВПП преимущественно иммунокомплексного генеза, в первую очередь обусловленных СКГ, которая наблюдается у 19—56% больных [18—21]. Только у небольшой группы больных ХГС с СКГ (менее 15%) имеются клинические проявления — криоглобулинемический синдром (КГС) [21, 22]. Распространенность СКГ повышается при более продолжительной персистенции HCV в организме и чаще наблюдается у женщин на 2—3-м десятилетии болезни. В некоторых исследованиях показано, что длительность инфекции HCV у больных ХГС со СКГ почти в 2 раза больше, чем у пациентов без СКГ [20], у 40% больных со СКГ выявляют признаки ЦП.
Установлено, что HCV имеет высокий тропизм к мононуклеарам периферической крови, которые могут служить его резервуаром и местом репликации. HCV связывается с лигандом CD81 на поверхности В-лимфоцитов через белок Е2, что приводит к их активации. На первом этапе продуцируются только поликлональные криоглобулины (КГ), затем доминирующий клон В-клеток начинает продуцировать моноклональные иммуноглобулины. СКГ является причиной системного васкулита с поражением сосудов мелкого и среднего калибра с возможным вовлечением в патологический процесс различных органов и систем [18, 23, 24]. Известно, что при ХГС васкулиты могут быть обусловлены не только СКГ, но и (со значительно меньшей частотой) — иммунными комплексами, не обладающими свойствами преципитировать на холоде, т.е. не содержащими ревматоидный фактор (РФ) класса IgM [18, 25, 26].
Поражение кожи в 95% случаев представлено васкулитом от пурпуры (лейкоцитокластический васкулит) и петехий на нижних конечностях до выраженных некротических язв. Биопсия кожи выявляет иммунокомплексный васкулит мелких сосудов с мононуклеарной инфильтрацией, в 40% случаев определяются антитела к HCV [19].
У больных ХГС без СКГ по сравнению с больным с СКГ пурпура характеризуется меньшей распространенностью и отсутствием язвенно-некротических изменений кожи [27]. Синдром Рейно при ХГС часто проявляется на ранней стадии КГС, некрозы фаланг пальцев, как правило, не наблюдаются [10]. Однако при высоком криокрите частота развития последних увеличивается [27].
Поражение почек при СКГ, связанной с инфекцией HCV, наблюдается в 35—60% случаев. Наиболее часто встречающийся тип гломерулонефрита, ассоциированного с СКГ, — мезангиокапиллярный гломерулонефрит (МКГН). РНК HCV определяется в сыворотке у 81% больных МКГН с СКГ против 25% случаев некриоглобулинемического МКГН. В почечной паренхиме экспрессируются рецепторы CD81 и SR-B1, с помощью которых HCV связывается с мембраной клетки и проникает внутрь путем эндоцитоза [29]. Поражение почек может наблюдаться в дебюте заболевания у 20% больных ХГС. У 25% пациентов при инфекции HCV развиваются протеинурия нефротического уровня (>3 г/сут), отеки, артериальная гипертония и гипокомплементемия; у 30% в дебюте отмечаются остронефритический синдром и острая почечная недостаточность (олигурическая в 5% случаев). У 55% больных наблюдаются только легкая гематурия, протеинурия и начальные стадии почечной недостаточности. При биопсии почки обнаруживаются иммунокомплексные депозиты IgG, IgM с активностью РФ и компонент С3-комплемента. Наиболее характерной гистологической картиной при световой микроскопии являются капиллярные тромбы, состоящие из преципитированных КГ. Менее часто HCV вызывает фокальный сегментарный гломерулярный склероз или мембранозный, или пролиферативный гломерулонефрит [30]. Картина ассоциированного с HCV некриоглобулинемического МКГН существенно не отличается по клиническим и морфологическим признакам от таковой при идиопатическом МКГН [31].
У 30% больных клиническое течение поражения почек при ХГС замедлено, и функция почек остается сохранной многие годы. В 20% случаев болезнь характеризуется рецидивирующими эпизодами остронефритического синдрома. Менее чем 15% больных требуется диализ в связи с развитием терминальной стадии почечной недостаточности [19, 30].
В основном это мононевропатия, а также поражение периферической нервной системы, ассоциированное с УП, которое обычно представлено асимметричной полиневропатией с ведущими моторными нарушениями [19, 27].
Поражение легких. Описано вовлечение сосудов легких (легочный васкулит) в рамках СКГ, проявляющееся легочными инфильтратами, альвеолярным кровотечением [18]. Имеется ряд наблюдений фиброзирующего альвеолита (ФА) у больных ХГС, в том числе с морфологическим подтверждением и обнаружением РНК HCV в ткани легкого [28]. В некоторых регионах мира (Италия, Япония) частота выявления инфекции HCV у больных ФА составляет 13—14%, что значительно выше, чем в целом в популяции [32]. Эти данные, а также результаты исследований бронхоальвеолярной жидкости у больных ХГС, выявляющих повышенное содержание лимфоцитов и эозинофилов, позволили обсуждать пусковую роль HCV в развитии альвеолита [18]. В то же время в Англии частота инфекции HCV у больных ФА оказалась невысокой (1,6%) и роль HCV в его патогенезе ставится под сомнение [33]. По данным Клиники им. Е.М. Тареева, частота поражения легких была выше у больных без СКГ (11,3%), чем с КГ (6,3%). В группе пациентов, у которых КГ не обнаруживались, поражение легких характеризовалось развитием ФА, у больных с КГ наблюдалась картина легочного васкулита [27].
Поражение сердца. Описаны наблюдения хронического миокардита на фоне инфекции HCV. Поражение миокарда, ассоциированное с инфекцией HCV, может быть обусловлено следующими причинами: 1) прямое (вирусное) воздействие на миокард; 2) непрямой (иммунологический) путь; 3) апоптоз клеток, вызванный внутренними и внешними сигналами [34]. Выявлена репликация HCV в миокарде. Кроме того, высказано предположение о прямом повреждающем действии на миокард core-белка HCV. Непрямой иммуноопосредованный путь повреждения миокарда осуществляется при участии В-, Т-клеток и макрофагов. Обнаружение цепей (+) и (–) РНК HCV в ткани миокарда у больных миокардитом, дилатационной миокардиопатией и цепи (+) РНК HCV в миокарде больных гипертрофической кардиомиопатией, сочетающихся с инфекцией HCV, позволяют обсуждать возможность репликации HCV в ткани миокарда, а также роль реакций клеточного иммунитета на тканевые антигены вируса и индуцированные им аутоантигены, роль иммунных комплексов в патогенезе поражения миокарда. Кроме того, не исключается роль цитокинов (продуцируемых активированными вирусом иммуноцитами), которые путем повышения продукции оксида азота вызывают отрицательный инотропный эффект и повреждение сердечной мышцы [35].
Поражение суставов. Артралгии и/или артриты встречаются у 21—74% больных ХГС [19, 24], могут наблюдаться как в рамках КГС, так и в отсутствие СКГ. Описано 2 вида поражения суставов: полиартрит мелких суставов, подобный ревматоидному артриту, который встречается очень редко и имеет мягкое течение, и неэрозивный олигоартрит с вовлечением средних и крупных суставов, часто интермиттирующего течения, как правило, связанный с криоглобулинемией. РФ в сыворотке крови выявляется в 50—80% случаев. Антитела к циклическому цитруллиновому пептиду обнаруживаются менее чем у 6% больных с артритом, ассоциированным с HCV, что можно использовать для дифференциальной диагностики ревматоидного артрита и поражения суставов в рамках инфекции HCV [19].
Синдром Шегрена (СШ). У 14—77% больных ХГС выявляются морфологические признаки лимфоцитарного сиалоаденита, а также поражение слезных желез (у 26—50%), морфологические изменения малых слюнных желез характеризовались небольшой воспалительной инфильтрацией и распространенным фиброзом [36, 37]. Клинически ксерофтальмия и ксеростомия протекают мягко или отсутствуют у 73,8% больных, наибольшая клиническая выраженность СШ отмечалась у больных ХГС с КГ [37]. Наличие СШ у больных с инфекцией HCV является фактором риска развития злокачественной В-клеточной лимфомы, особенно при сочетании со СКГ [38].
Поражение щитовидной железы (ЩЖ). Прямая связь между инфекцией HCV и заболеванием ЩЖ до конца не установлена, однако поражение ЩЖ (особенно гипотиреоз) у больных ХГС встречается чаще, чем в общей популяции. Примерно у 13% больных, инфицированных HCV, выявляется гипотиреоз и у 25% обнаруживаются антитиреоидные антитела. В 30% случаев поражение ЩЖ выявляется в ходе противовирусной терапии (ПВТ).
В связи с этим остается открытым вопрос, является ли нарушение функции ЩЖ индуцированным HCV или нежелательным эффектом ПВТ. Возможно, ПВТ вызывает развитие нарушения функции ЩЖ de novo или обостряет существующее субклиническое поражение ЩЖ [39, 40].
Инфекция HCV и неходжкинская В-клеточная лимфома. В настоящее время доказана этиологическая роль HCV в развитии КГ II типа, представляющей собой доброкачественное лимфопролиферативное заболевание, в основе которого лежит клональная (IgMκ) пролиферация В-лимфоцитов. У отдельных больных ХГС доброкачественная лимфопролиферация трансформируется в злокачественную. У 8—10% больных с СКГ II типа развивается В-клеточная лимфома. Показана высокая распространенность инфекции HCV и при моноклональной иммуноглобулинопатии, обусловленной пролиферацией других (не продуцирующих СКГ) клонов лимфоцитов, а также значительная (до 11%) частота обнаружения моноклональной иммуноглобулинопатии у больных ХГС. HCV персистирует в иммунокомпетентных клетках кроветворной системы, но не способен к интеграции в геном клетки хозяина. Процесс лимфомогенеза при инфекции HCV рассматривается как длительный многостадийный процесс, в основе которого лежит патологическая пролиферация клеток, сочетающаяся с повреждением их генома. Патологическая пролиферация связывается со снижением порога активации В-лимфоцитов, обусловленной взаимодействием HCV со специфическими рецепторами В-клеток (CD81), а также подавлением вирусом апоптоза. В В-лимфоцитах при инфекции HCV повышается экспрессия белка bcl-2 вследствие транслокации t(14;18), играющего важную роль в подавлении апоптоза. Показано также, что core-белок HCV регулирует транскрипцию с-myc и что bcl-2 и c-myc взаимодействуют друг с другом в процессе лимфомогенеза. Гистологически наиболее распространены фолликулярная лимфома, В-клеточная хроническая лимфоцитарная лейкемия/лимфома из малых лимфоцитов, лимфоплазмоцитарная лимфома и лимфома маргинальной зоны. Среди последних описана особая ассоциация инфекции HCV с MALT-лимфомой [18, 41, 42]
Таким образом, при ХГС многообразие ВПП инфекции обусловлено в первую очередь смешанной криоглобулинемией и характеризуется развитием у ряда больных КГС с поражением кожи, суставов, мышц, почек и других органов и систем. Особенностью доброкачественной лимфопролиферации, свойственной ХГС, является возможность трансформации в злокачественную с развитием В-клеточной лимфомы. Как и при ХГВ, внепеченочные проявления ХГС создают трудности при дифференциальном диагностике ХГС, определяя у отдельных больных неблагоприятный прогноз криоглобулинемического васкулита, поражения почек, В-клеточной лимфомы.
Лечение больных ХГВ и ХГС с системными проявлениями. Адекватный подход к лечению хронических вирусных гепатитов с ВПП включает две независимые, но тесно связанные цели. Первая — эрадикация вируса или снижение вирусной нагрузки с помощью этиотропной ПВТ. Вторая — патогенетическое лечение аутоиммунных нарушений с использованием иммуносупрессивной терапии и/или плазмафереза с целью контроля образования иммунных комплексов.
По мнению большинства исследователей, для лечения инфекции хронической HBV оптимальна комбинированная терапия: использование препаратов, различающихся по механизму действия, — сочетание α-интерферона (ИФН-α) с аналогами нуклеоз(т)идов, сочетание нескольких аналогов нуклеоз(т)идов. Преимуществом ИФН-α является более низкая частота рецидивов после отмены препарата, а аналогов нуклеоз(т)идов — отсутствие нежелательных эффектов, в том числе иммуностимулирующего действия, что обусловливает его применение у больных с выраженными ВПП и декомпенсированным ЦП. В ряде случаев при выраженных системных поражениях оправданно применение иммуносупрессивной терапии, несмотря на активирующее влияние глюкокортикостероидов на репликацию HВV [6, 43—46].
Лечение больных ХГС со СКГ направлено на подавление вирусной репликации и угнетение В-клеточной пролиферации. Эрадикация HCV при ПВТ приводит к исчезновению СКГ и регрессу клинических проявлений, но некоторые больные ХГС не отвечают на ПВТ, у ряда пациентов отмечаются выраженные нежелательные эффекты лечения. Применение глюкокортикостероидов при хроническом вирусном гепатите с аутоиммунными нарушениями может приводить к увеличению вирусной нагрузки. В то же время известно, что интерферонотерапия может вызывать усугубление таких ВПП инфекции HCV, как периферическая невропатия, миокардит, тубулоинтерстициальный нефрит, полимиозит. Недавно предложено использовать ритуксимаб (химерные моноклональные антитела к CD20) в качестве анти-В-клеточной терапии у больных ХГС с криоглобулинемией, не отвечающих на ПВТ [47, 48]. Его действие связано с быстрым, но обратимым, угнетением CD20+ В-клеток в периферической крови [49, 50]. Ряд исследований свидетельствуют об эффекте ритуксимаба у больных ХГС с периферической невропатией и комбинации ритуксимаба и плазмафереза у больных ХГС с криоглобулинемическим васкулитом [47, 51], а также об эффективности ритуксимаба и ПВТ у больных ХГС с криоглобулинемическим гломерулонефритом и сосудистой пурпурой [23, 52].
Таким образом, лечение больных хроническими вирусными гепатитами с ВПП не разработано, представляет серьезные проблемы и нуждается в дальнейшем изучении и определении тактики.
1. Годков М.А., Ветошкин А.И., Кудряшов С.А., Кривякова Е.Е., Олейник В.А., Абрикосов Е.В., Хватов В.Б. Организационно-методические принципы оптимизации деятельности лаборатории клинической иммунологии многопрофильных стационаров медицинской помощи // В сб.: Актуальные вопросы организации и медицинских технологий в службе скорой медицинской помощи, Москва, 1992, стр. 45-52
3. Годков М.А., Зернова Е.В., Сорокина А.А. Медико-экономическая эффективность лабораторного обследования населения муниципальным учреждением // Конгресс: «Национальные дни лабораторной медицины России – 2001
4. Иванина Т.А., Евтеева Е.А., Годков М.А. Выявляемость ВИЧ и ВИЧ-ассоциированных инфекций для оценки эпидемиологической ситуации в Москве // Российский журнал гастроэнтерологии, гепатологии, клопроктологии, № 5, том 12, стр. 632, 2002
5. Годков М.А., Трифонов С.И. Фазность и сезонность в распространении ВИЧ и гепатитов В и С при долгосрочном мониторинге // Русский журнал ВИЧ/СПИД, Санкт-Петербург, 2002, т. 6, № 1
6. Годков М.А., Иванина Т.А., Евтеева Е.А. Выявляемость ВИЧ и ВИЧ-ассоциированных инфекций для оценки эпидемиологической ситуации в Москве // Русский журнал ВИЧ/СПИД, Санкт-Петербург, 2002, т. 6, № 1
7. Годков М.А., Зернова Е.В., Баженов А.И. Значимость анонимного лабораторно-диагностического обследования населения // Русский журнал ВИЧ/СПИД, Санкт-Петербург, 2002, т. 6, № 1
11. Годков М.А.. Завалишина З.Н., Николаева Э.И., Каракулова И.О. Сравнительный анализ групп ВИЧ-инфицированных пациентов клинических (неинфекционных) отделений НИИ скорой помощи им.Н.В.Склифосовского и ГКБ № 15 им.О.М.Филатова г.Москвы // Здравоохранение и медицинская техника, № 7 (21), стр. 56-57, 2005
12. Зинкин В.Ю., Годков М.А. Опыт организации внутренней логистики крупной многопрофильной лаборатории // Здравоохранение и медицинская техника, № 4 (18), стр. 32-33, 2005
13. Годков М.А. Оптимизация источников финансирования лабораторной службы в современных условиях // Клиническая лабораторная диагностика, 2005 - № 7, с. 53-55
14. Зенина Л.П., Баженов А.И., Годков М.А. Выявление гемоконтактных вирусных инфекций у доноров отделения переливания крови НИИ скорой помощи им.Н.В.Склифосовского // Материалы городского семинара: Актуальные вопросы профилактики гемотрансмиссивных инфекций в многопрофитльном стационаре, Москва, 2006, стр. 22-24
22. Ермолов А.С., Годков М.А., Байрамов Ш.А., Шевчук В.П. Частота выявления гемоконтактных вирусных инфекций в стационаре скорой медицинской помощи // Российский мед.журнал, 2007 г., № 2, с. 30-32
23. Баженов А.И., Годков М.А., Коноплева М.В., Эльгорт Д.А., Фельдшерова А.А., Будницкая П.З., Никитина Н.И., Хац Ю.С., Суслов А.П. Алгоритм серологического поиска и оценка распространенности серологически значимых HbsAg-мутаций у носителей вируса гепатита В // Журн. микробиологии, эпидемиологии и иммунологии, 2007, № 6, С. 30-37
25. Лаповок И.А., Казеннова Е.В., Кандрушин Е.В., Баженов А.И., Годков М.А., Ольшанский А.Я., Симонова И.А., Саламов Г.Г., Бобкова М.Р. Сравнительный анализ лабораторных методов дифференциальной диагностики ранней ВИЧ-инфекции // Вопросы вирусологии, 2008, № 5, с. 46-49
28. Баженов А.И., Годков М.А., Коноплева М.В., Фельдшерова А.А., Эльгорт Д.А., Хац Ю.С., Лапина Н.E., Суслов А.П. Оценка чувствительности коммерческих тест-систем для иммунодетекции HBsAg по их способности выявлять HBsAg-мутанты вируса гепатита В // Журнал микробиологии, эпидемиологии и иммунобиологии. – 2008. – №3. – С.49-53
29. Ермолов А.С., Годков М.А., Булава Г.В., Меньшиков Д.Д. Роль лабораторной службы при оказании экстренной медицинской помощи // Конгресс: «Национальные дни лабораторной медицины России – 2008
30. Станке А.А., Балакирев Э.М., Семененко Т.А., Червинко В.И., Таранов В.А., Годков М.А., Баженов А.И., Стенина И.И., Новоженов В.Г., Зубкин М.Л. Структура генотипов вируса гепатита С в популяции инфицированных больных, получающих лечение программным гемодиализом в г.Москве // Тезисы докладов IV Всероссийского Съезда трансплантологов, 2008, с. 150-151
31. Станке А.А., Балакирев Э.М., Семененко Т.А., Червинко В.И., Годков М.А., Баженов А.И., Стенина И.И., Новоженов В.Г., Зубкин М.Л. Влияние хронической HCV-инфекции на качество жизнибольных с терминальной стадией хронической почечной недостаточности в условиях лечения гемодиализом // Тезисы докладов IV Всероссийского Съезда трансплантологов, 2008, с. 151-152
32. Годков М.А., Дроздова Н.Е. Динамика выявляемости заносов гемоконтактных вирусных инфекций в стационаре скорой помощи // Материалы VI научно-практичес-кой конференции: Внутрибольничные инфекции в стационарах различного профиля, профилактика, лечении осложнений, М. 2008, с. 25
33. Годков М.А., Ольшанский А.Я. Частота обращений ВИЧ-инфицированных пациентов в ЛПУ г.Москвы // Справочник заведующего КДЛ – 2009 - № 1, с. 5-9
34. Зубкин М.Л., Червинко В.И., Хлопова И.Н., Семененко Т.А., Балакирев Э.М., Стаханова В.М., Годков М.А., Баженов А.И., Станке А.А., Стенина И.И., Репетий Н.Г. Сравнительная клинико-лабораторная характеристика хронических гепатитов В и С у больных, получавших заместительную почечную терапию // Вестник трансплантологии и искусственных органов (тезисы докладов на конференции: Инфекции в трансплантологии), декабрь 2009, с. 37-38
35. Годков М.А., Филина Е.А. Экономика лаборатории: источники финансирования // Труды научно-практ. конференции: Лабораторная медицина в свете Концепции развития здравоохранения России до 2020 года, Лабра, М. 2009, с. 251-252
36. Годков М.А., Брико Н.И. Частота выявления маркеров моно- и микст гемоконтактных вирусных инфекций у пациентов стационара скорой медицинской помощи // Журнал микробиологии, эпидемиологии и иммунобиологии. – 2009 – № 3 – С. 66-70
37. Годков М.А, Даниелян Ш.Н., Абакумов М.М. Повреждения и острые заболевания груди и живота на фоне гемоконтактных вирусных инфекций // Хирургия – 2010 - № 9 - С.24-29
38. Смирнов С.В., Годков М.А., Шахламов М.В., Смирнов К.С. Медико-социальные характеристики пациентов с термической травмой, полученной на фоне гемоконтактных вирусных инфекций // Хирургия – 2010 - № 10 – С. 27-31
39. Годков М.А., Захарова Н.М., Кукшина А.А., Чобану И.К. Психические расстройства и гемоконтактные вирусные инфекции, как сопутствующие виды патологии у пациентов стационара скорой медицинской помощи // Скорая помощь – 2010 - № 2 - С.70-75
40. Годков М.А. Диагностика ВИЧ-инфекции и вирусных гепатитов В и С в г.Москве: итоги и тенденции // Материалы городского семинара: Современные лабораторные технологии в диагностике неотложных состояний, М. 2010, с. 3-8
41. Годков М.А., Баженов А.И., Ольшанский А.Я., Панкова Г.Ю. ЛПУ различного профиля – как территории риска распространения гемоконтактных вирусных инфекций // Материалы VIII научно-практичес-кой конференции: Внутрибольничные инфекции в стационарах различного профиля, профилактика, лечении осложнений, М. 2008, с. 26-27
42. Годков М.А. Пациенты стационара скорой медицинской помощи – как группа риска распространения гемоконтактных вирусных инфекций // Материалы VIII научно-практичес-кой конференции: Внутрибольничные инфекции в стационарах различного профиля, профилактика, лечении осложнений, М. 2008, с. 28
Что такое гепатит А (болезнь Боткина)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
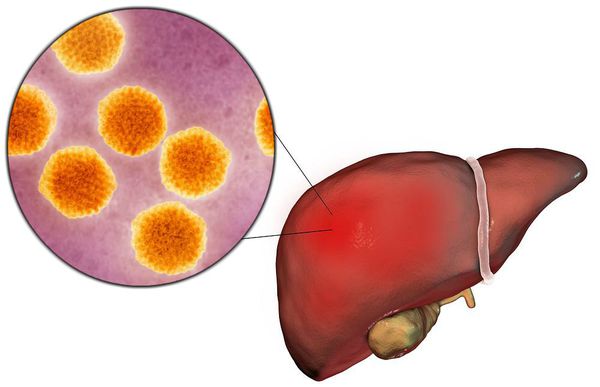
Вирусный гепатит А (Hepatitis A viruses, HAV) — острое инфекционное заболевание, вызываемое вирусом гепатита А, клинически характеризующееся синдромом общей инфекционной интоксикации, синдромом нарушения пигментного обмена, синдромами энтерита, холестаза, увеличением печени и в некоторых случая селезёнки, сопровождающееся нарушением функции печени, преимущественно доброкачественного течения.
Этиология
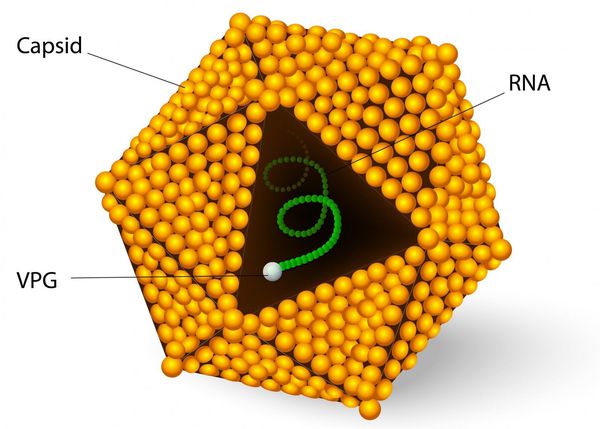
семейство — пикорнавирусы (Picornaviridae)
вид — вирус гепатита А (HAV)
Во внешней среде очень устойчив: при температуре окружающей среды около 4°C сохраняется несколько месяцев, при 2°C — несколько лет, при замораживании очень длительно, при комнатной температуре — несколько недель. В растворе хлорсодержащих средств (0,5-1 мг/л) гибнет в течение часа, при 2,0-2,5 мг/л — в течение 15 минут, ультрафиолетовое облучение приводит к гибели в течение минуты, при кипячении сохраняется до 5 минут. В кислой среде желудка не погибает.
Наиболее значимым маркером вирусного гепатита А являются антитела класса М (анти-HAV IgM), которые образуются в начальный период заболевания и выявляются до 5 месяцев. Появление анти-HAV IgG (маркера перенесённой ранее инфекции) начинается с 3-4 недели заболевания. Антиген вируса выявляется в каловых массах за 7-10 дней до начала манифестных (явно выраженных) проявлений болезни. [1] [2] [4]
Эпидемиология
Заражение гепатитом А происходит при контакте с источником инфекции — живым человеком (больной различными формами заболевания и вирусоноситель). Больные с типичными формами являются главным источником распространения вируса (от конца скрытого и всего желтушного периодов).
Ежегодно в мире регистрируется примерно 1,5 млн случаев заболевания (количество субклинических и бессимптомных форм сложно даже представить). Смертность по миру в 2016 г., по данным ВОЗ, составила 7134 человек [10] .
Условно существует территориальное распределение по уровням инфицирования населения: высокий, средний и низкий.
Районы с высоким уровнем инфицирования это преимущественно Юго-Восточная Азия, Средняя Азия, Африка, Центральная Америка (плохие санитарные условия и низкий доход) — большинство населения к периоду взросления уже переболели и имеют иммунитет, вспышки болезни встречаются редко.
Районы со средним уровнем инфицирования — страны с переходной экономикой, развивающиеся, имеющие различия в санитарно-гигиенических условиях на территории одного региона, например Россия (большая часть населения к периоду взросления не болела и не имеет иммунитета к вирусу, возможны большие вспышки болезни).
Районы с низким уровнем инфицирования — развитые страны с высоким уровнем дохода и хорошими санитарно-гигиеническими условиями, например США, Канада, Европа, Австралия. Большинство людей не имеет иммунитета и не болела, вспышки случаются редко и чаще среди групп риска [7] .
В окружающую среду вирус выделяется преимущественно с фекалиями.
Механизм передачи: фекально-оральный (пути — водный, контактно-бытовой, пищевой), парентеральный (редко при переливании крови), половой (орально-анальный контакт).
Восприимчивость населения высокая.
Факторы риска заражения:
- высокая скученность населения;
- несоблюдение правил личной гигиены и правил хранения, обработки и приготовления продуктов питания;
- неудовлетворительное состояние объектов водоснабжения;
- бытовой очаг заболевания.
Кто находится в группе риска
- путешественники (особенно в страны жаркого климата и с плохими социальными условиями);
- гомосексуалисты;
- люди, употребляющие наркотики (любые), алкоголики;
- медработники (непривитые и не болевшие);
- бездомные;
- люди, имеющие постоянные контакты (в силу профессии или иных причин) с мигрантами из неблагополучных по гепатиту А регионов.
Характерна осенне-весенняя сезонность, повышенная привязанность к жарким южным регионам.
Иммунитет после перенесённого заболевания стойкий, пожизненный, то есть повторно заболеть нельзя [1] [3] [4] [7] [10] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гепатита А
Заболевание начинается постепенно. Инкубационный период гепатита А протекает 7-50 дней.
Синдромы вирусного гепатита А:
- общей инфекционной интоксикации;
- нарушения пигментного обмена (желтуха);
- энтерита (воспаление слизистой тонкой кишки);
- холестаза (уменьшение количества желчи, поступающей в двенадцатиперстную кишку);
- гепатолиенальный (увеличение печени и селезёнки);
- отёчный;
- нарушения функции печени.
Типичное течение болезни — это желтушная форма болезни средней степени тяжести (устаревшее название — желтуха или болезнь Боткина).
Начальный период болезни (преджелтушный) имеет продолжительность от 2 до 15 дней и может протекать по нескольким вариантам:
При осмотре обнаруживается увеличение печени и, в меньшей степени, селезёнки, чувствительность края печени, повышение ЧСС (пульса), носовые кровотечения. В конце периода моча темнее, а кал становится светлее.
Следующий период (желтушный) длительностью около 7-15 дней характеризуется снижением выраженности симптомов предшествующего периода (то есть с появлением желтухи самочувствие улучшается). Усиливается желтушное окрашивание склер, кожных покровов и слизистой оболочки ротоглотки. Моча приобретает цвет тёмного пива, кал белеет. Присутствует общая слабость, недомогание, плохой аппетит, чувство тяжести и переполненности в правом подреберье, больной расчёсывает себя из-за зуда кожи (лихенификация), появляются петехии (мелкие кровоизлияния) на коже.
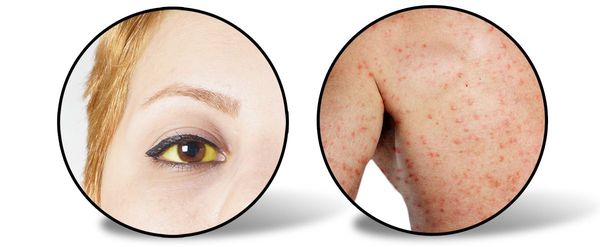
При врачебном исследовании выявляется увеличение печени и селезёнки, явственно положителен симптом Ортнера (болезненность при поколачивании ребром ладони по правой рёберной дуге), гипотония (может быть и нормотония), токсическая брадикардия (снижение ЧСС), появляются периферические отёки, возможны боли в суставах (артралгии).
Далее при благоприятном течении заболевания (которое наблюдается в большинстве случаев) происходит регресс клинической симптоматики, осветление мочи и потемнение кала, более медленное спадение желтушности кожи, склер и слизистых оболочек.
Под нетипичным течением болезни подразумеваются лёгкие безжелтушные формы гепатита А (отсутствие симптомов или лёгкая слабость без желтухи, тяжесть в правом подреберье), фульминантные формы.
Факторы, увеличивающие риск тяжёлого течения гепатита А:
Последствия для беременных
У беременных гепатит А протекает в целом несколько тяжелее, чем у небеременных. Примерно в 36 % случаев возможно развитие слабости родовой деятельности, преждевременные роды (31-37 неделя) и послеродовые кровотечения. Вирус не проникает через плаценту, то есть какого-то специфического действия на плод не оказывает. В грудном молоке вирус не содержится [1] [2] [4] [7] .
Патогенез гепатита А
Воротами для проникновения вируса является слизистая оболочка органов желудочно-кишечного тракта, где происходит его первичное размножение в эндотелиальной выстилке тонкого кишечника и мезентериальных лимфоузлах.
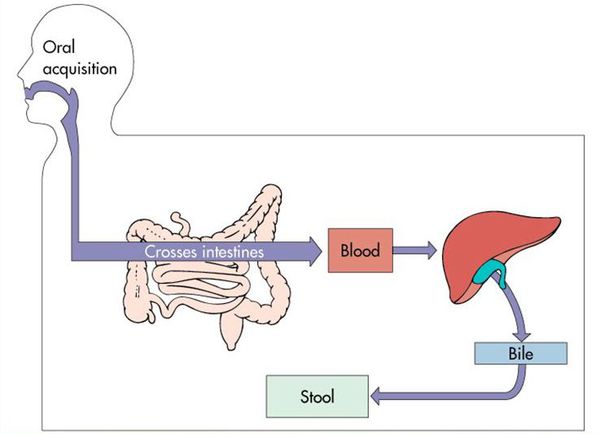
Далее происходит гематогенное распространение вирусных частиц и проникновение их в печень, где они локализуются в ретикулогистиоцитарных клетках Купфера и гепатоцитах. В результате этого происходит повреждение клеток:
- проникновение вируса в клетку;
- захват лизосомой;
- разрушение белковой оболочки вируса;
- сборка белков по программе вирусной РНК;
- встраивание этих белков в цитолемму клетки;
- образование патологических пор в оболочке клетки;
- поступление внутрь клетки ионов натрия и воды;
- баллонная дистрофия (разрушение ультраструктур клетки и образование крупных вакуолей) с последующим некрозом (его объём, как правило, ограничен);
- гибель клетки и лимфоцитарная иммунная реакция, приводящая к основному объёму поражения.
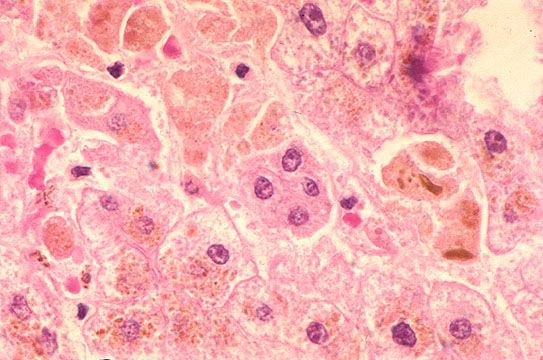
В дальнейшем вирус попадает в желчь, с ней он проникает в кишечник и выводится в окружающую среду с фекалиями. Вследствие компетентных реакций иммунной защиты размножение вируса заканчивается, и он покидает организм больного. [2] [3] [4]
Классификация и стадии развития гепатита А
По степени разнообразия проявлений выделяют две формы гепатита А:
- клинически выраженная (желтушная, безжелтушная, стёртая);
- субклиническая (инаппарантная).
По длительности течения также выделяют две формы гепатита А:
- острая циклическая (до трёх месяцев);
- острая затяжная (более трёх месяцев).
Степени тяжести гепатита А:
- лёгкая;
- среднетяжёлая;
- тяжёлая;
- фульминатная (молниеносная).
Согласно МКБ-10 (Международной классификации болезней десятого пересмотра), заболевание подразделяют на три вида:
- В15. Острый гепатит А;
- В15.0. Гепатит А с печёночной комой;
- В15.9. Гепатит А без печёночной комы. [2][4]
Осложнения гепатита А
Заболевание может привести к следующим осложнениям:
- печёночная кома (дисфункция центральной нервной системы, связанная с тяжёлым поражением печени — встречается крайне редко);
- холецистохолангит (выраженные боли в правом подреберье, нарастание желтухи и зуда кожи);
- гемолитико-уремический синдром, преимущественно у детей (гемолитическая анемия, тромбоцитопения, острая почечная недостаточность);
- развитие аутоиммунного гепатита I типа.
Гепатит А не приводит к формированию хронических форм, однако из-за выраженного воспалительного процесса возможно появление длительных резидуальных (остаточных) явлений:
- дискинезия (нарушение моторики) желчевыводящих путей;
- постгепатитная гепатомегалия (увеличение размеров печени из-за разрастания соединительной ткани);
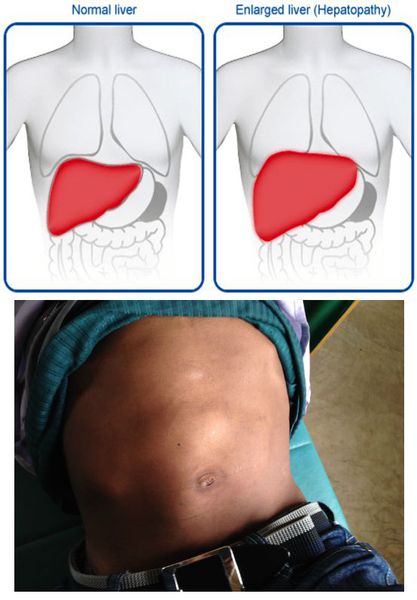
- постгепатитный синдром (повышенная утомляемость, аснено-невротические проявления, тошнота, дискомфорт в правом подреберье). [1][5]
Диагностика гепатита А
Методы лабораторной диагностики:
- Клинический анализ крови — нормоцитоз или лейкопения, лимфо- и моноцитоз, нейтропения, СОЭ в норме или снижена.
- Биохимический анализ крови — повышение общего билирубина и в большей степени его связанной фракции (реакция Эрлиха), повышение аланинаминотрансферазы и аспартатаминотрансферазы, снижение протромбинового индекса, повышение тимоловой пробы (снижение альбуминов и повышение гамма-глобулинов), повышение гамма-глутамилтранспептидазы, щелочной фосфатазы и другие показатели.
- Биохимический анализ мочи — появление уробилина и желчных пигментов за счёт прямого билирубина. Ранее, особенно в вооруженных силах, для выявления больных на начальной стадии практиковалось использование пробы Разина: утром производится опускание индикаторной полоски в мочу (при наличии уробилина она меняет цвет), и военнослужащий с подозрением на заболевание госпитализировался для углублённого обследования. Тест на уробилин становится положительным в самом начале заболевания — в конце инкубационного периода из-за болезни печёночной клетки.
- Серологические тесты — выявления анти-HAV IgM и анти-HAV IgG методом ИФА (иммуноферментного анализа) в различные периоды заболевания и HAV RNA с помощью ПЦР-диагностики (полимеразной цепной реакции) в острый период.
- Ультразвуковое исследование органов брюшной полости — увеличение печени и иногда селезёнки, реактивные изменения структуры печёночной ткани, лимфаденопатия ворот печени.
Обследование лиц, бывших в контакте с больным
Лица, контактирующие с больным вирусным гепатитом А, подлежат осмотру врачом-инфекционистом с последующим наблюдением до 35 дней со дня разобщения с больным. Наблюдение включает термометрию, осмотр кожных покровов, определение размеров печени и селезёнки, а также лабораторное обследование (АЛТ, общий билирубин, антитела классов М и G к вирусу гепатита А вначале и через три недели от первичного обследования).
Дифференциальная диагностика проводится со следующими основными заболеваниями:
- в начальный период: ;
- гастрит, гастроэнтероколит;
- полиартрит;
- энтеровирусная инфекция;
- в желтушный период: ;
- псевдотуберкулёз; ;
- желтухи другой этиологии (гемолитическая болезнь, токсические поражения, опухоли ЖКТ и другие заболевания);
- гепатиты другой этиологии (вирусные гепатиты В, С, Д, Е и другие, аутоиммунные гепатиты, болезнь Вильсона — Коновалова и т.п.) [1][2][3][4][9] .
Лечение гепатита А
Этиотропная терапия (направленная на устранение причины заболевания) не разработана.
Медикаменты
В зависимости от степени тяжести и конкретных проявлений назначается инфузионная терапия с глюкозо-солевыми растворами, обогащёнными витаминами. Показано назначение сорбентов, препаратов повышения энергетических ресурсов, при необходимости назначаются гепатопротекторы, в тяжёлых случаях — гормональные препараты, препараты крови, гипербарическая оксигенация и плазмаферез.
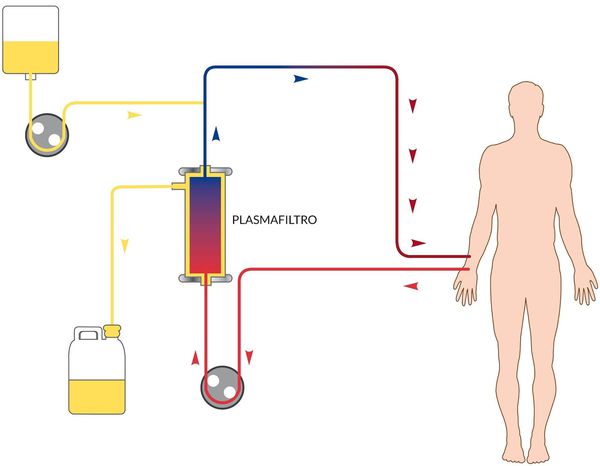
Нужна ли госпитализация
В случае лёгких форм гепатита А лечение может проводиться на дому (при наличии условий). Госпитализация потребуется, начиная со среднетяжёлых форм, лицам групп риска по тяжёлому течению, пациентам с осложнёнными формами, беременным и детям. Каких-либо особенностей при дальнейшем лечении вирусного гепатита А у детей нет.
Режим постельный или полупостельный. При гепатите А нарушаются процессы образования энергии в митохондриях, поэтому предпочтителен длительный отдых.
Лечение в стационаре и выписка
Лечение гепатита А проходит в инфекционном отделении больницы. Выписка пациентов происходит после появления стойкой и выраженной тенденции к клиническому улучшению, а также улучшения лабораторных показателей.
Критерии выписки больных:
- стойкая и выраженная тенденция к клиническому улучшению (отсутствие интоксикации, уменьшение размеров печени, регресс желтухи);
- стабильное улучшение лабораторных показателей (нормализация уровня билирубина, значительное снижение уровня АЛТ и АСТ).
При неосложнённых формах реконвалесценты (выздоравливающие больные) подлежат наблюдению в течении трёх месяцев с осмотром и обследованием не реже одного раза в месяц. [2] [3] [6]
Физиотерапия
В фазе реконвалесценции, особенно при затяжных формах болезни, возможно применение физиотерапевтических методов лечения:
- грязевых аппликаций на область правого подреберья;
- акупунктуры;
- массажа проекции области печени, желчного пузыря, желчевыводящих протоков.
Диета
Показана диета № 5 по Певзнеру — механически и химически щадящая, употребление повышенного количества жидкости и витаминов, запрет алкоголя. Исключается острое, жареное, копчёное, ограничивается кислое и соль. Все блюда готовятся на пару, тушатся, отвариваются и подаются только в тёплом виде.
Прогноз. Профилактика
Прогноз заболевания, как правило, благоприятный. Пациенты выздоравливают спустя 1-3 месяца после выписки из стационара. В редких случаях заболевание приобретает затяжной характер.
Критерии излеченности:
- отсутствие интоксикации;
- полная нормализация уровня билирубина, АЛТ и АСТ;
- нормализация размеров печени и селезёнки;
- появление в крови антител к вирусу гепатита А класса G (Anti-HAV-IgG).
Неспецифические мероприятия, позволяющие снизить количество случаев инфицирования:
- обеспечение условий и факторов потребления безопасной питьевой воды (водоснабжение);
- обеспечение и контроль за соблюдением утилизации сточных вод (канализационное хозяйство);
- контроль за качеством обследования персонала, связанного с пищевой промышленностью;
- контроль и соблюдение технологии хранения, приготовления и транспортировки пищевых продуктов и воды.
К личным профилактическим мерам относится тщательное мытьё рук после посещения туалета, смены подгузников, а также перед приготовлением или приёмом пищи.
Вакцинация
Специфическим профилактическим мероприятием является проведение иммунизации против гепатита А: практически у 100% привитых двукратно людей вырабатывается стойкий иммунитет, предотвращающий развитие заболевания. Вакцинация — это самый лучший способ предотвратить заражение.
Читайте также:

