Используется ли микроскопия для изучения вирусов
Обновлено: 05.05.2024
Почти все смертельные вирусные вспышки в последние два десятилетия были вызваны вновь появляющимися вирусами. Для изучения вирусов часто используют электронную микроскопию (ЭМ). Она позволяет получить новые данные о структуре вирусных частиц с высоким разрешением, что представляет интерес как для фундаментальной вирусологии, так и для практической фармацевтической нанобиотехнологии. Кроме того, ЭМ применяется в экологических исследованиях для определения наличия вирусов в окружающей среде, при анализе технологических процессов для производства вакцин и других биотехнологических компонентов, а также в диагностических целях. Несмотря на развитие более чувствительных методов, электронная микроскопия в диагностике остается рабочим методом. Главное преимущество ЭМ - отсутствие специфичности к какой-либо определенной группе вирусов, что способствует работе с неизвестным материалом. Однако основное ограничение метода - относительно высокий предел обнаружения (107 частиц/мл), в связи с чем необходимо концентрировать вирусный материал. Не существует какого-то одного наиболее эффективного метода. В зависимости от самого вируса и поставленной цели используются различные комбинации методов и подходов. В настоящее время концентрирование вируса включает операции осаждения, центрифугирования, фильтрации и хроматографии. В обзоре на примере разных вирусов описаны эти основные методы. Существует необходимость в разработке эффективных методик элюирования, которые могут нарушить связь между фильтрующими материалами и вирусами, чтобы повысить степень восстановления. Рассмотрены работы по созданию уникальных ловушек, магнитных шариков, композитных полианилиновых и углеродных нанотрубок и нанотрубок с изменяемым размером для концентрирования вирусных частиц. Приведен пример применения центрифужных концентраторов, в которых вирус осаждается на мембране из поли-эфирсульфона. Проанализированные данные указывают на то, что способ концентрирования вирусов или других наночастиц выбирается в каждом конкретном случае в зависимости от поставленной цели и оснащенности лаборатории.
Ключевые слова
Об авторах
Р. п. Кольцово, Новосибирская область
Р. п. Кольцово, Новосибирская область
Р. п. Кольцово, Новосибирская область
Список литературы
1. Abbaszadegan M., Alum A., Abbaszadegan H., Stout V Cell surface display of poliovirus receptor on Escherichia coli, a novel method for concentrating viral particles in water. Appl. Environ. Microbiol. 2011;77(15):5141-5148.
2. Ali A., Roossinck M.J. A simple technique for separation of Cow-pea chlorotic mottle virus from Cucumber mosaic virus in natural mixed infections. J. Virol. Methods. 2008;153:163-167.
3. Alonso M.C., Rodriquez J., Borrego J.J. Enumeration and isolation of viral particles from oligotrophic marine environments by tangential flow filtration. Int. Microbiol. 1999;2(4):227-232.
4. Bakhutashvili T.O., Gusev A.A., Dudnikov A.I., Mikhalishin V V, Shipilov V.I. A Method for Concentrating Viruses. Patent RF № 1834289, 2002. (in Russian)
5. Barth H.G., Jackson С., Boyes В.Е. Size exclusion chromatography. Anal. Chem. 1994;66(12):595-620.
7. Burova E., Loffe Е. Chromatographic purification of recombinant adenoviral and adeno-associated viral vectors: methods and implications. Gene Ther. 2005;12:5-17.
8. Dong H., Xiao K., Li X., Ren Y, Guo S. Preparation of PVDF/ Al2O3 hybrid membrane via the sol-gel process and characterization of the hybrid membrane. Desalin. Water Treat. 2013; 51(19-21):3685-3690.
9. Doodeji M.S., Zerafat M.M. A review on the applications of nano filtration in virus removal and pharmaceutical industries. Glob. J. Nanomed. 2018;3(5):555624. DOI 10.19080/GJN.2018.03.555624.
10. Falman J.C., Fagnant-Sperati C.S., Kossik A.L., Boyle D.S., Me-schke J.S. Evaluation of secondary concentration methods for poliovirus detection in wastewater. Food Environ. Virol. 2019; 11(1):20-31.
11. Flavigny E., Gaboyard M., Merel P., Fleury H. Magnetic particle-mediated virus concentration for clinical virology. In: 104th General Meeting of the American Society for Microbiology, New Orleans, American Society for Microbiology. May 22-27, 2004. Washington, DC, 2004.
12. Gentile M., Gelderblom H.R. Electron microscopy in rapid viral diagnosis: an update. New Microbiol. 2014;37:403-422.
15. Goldsmith C.S., Miller S.E. Modern uses of electron microscopy for detection of viruses. Clin. Microbiol. Rev. 2009;552-563.
16. Gutierrez-Aguirre I., Banjac M., Steyer A., Poljsak-Prijatelj M., Peterka M., Strancar A., Ravnikar M. Concentrating rotaviruses from water samples using monolithic chromatographic supports. J. Chromatogr. 2009;1216(13):2700-2704.
17. Havlik M., Marchetti-Deschmann M., Friedbacher G., Messner P., Winkler W., Perez-Burgos L., Tauer C., Allmaier C. Development of a bio-analytical strategy for characterization of vaccine particles combining SEC and nanoES GEMMA. Analyst. 2014; 139(6):1412-1419.
18. Hazelton P.R., Gelderblom H.R. Electron microscopy for rapid diagnosis of infectious agents in emergent situations. Emerg. Infect. Dis. 2003;9:294-303.
19. Ikner L.A., Gerba C., Bright K. Concentration and recovery of viruses from water: a comprehensive review. Food Environ. Virol. 2012;4(2):41-67.
20. Ismagambetov B.M., Koshemetov Zh.K., Bogdanova M.I., Na-khanova G.D., Nurabaev S.Sh., Seysenbaeva M.S., Sansyz-bai A.R., Kasenov M.M. Design of diagnostic products for influenza A subtypes. Mezhdunarodnyy Zhurnal Prikladnykh i Fundamental’nykh Issledovaniy. Seriya Biologicheskie Nauki = International Journal of Applied and Fundamental Research. Biological Series. 2017;10:260-264. (in Russian)
21. Ivanova V.T., Ivanova M.V., Sapurina I.Yu., Burtseva E.I., Trusha-kova S.V., Isaeva E.I., Kirillova E.S., Stepanova N.V., Oskerko T.A. A comparative study of carbon nanotubes and polymer composites containing silver nanoparticles as sorbents of influenza viruses A and B. Voprosy Virusologii = Problems of Virology. 2015;60(3):25-30. (in Russian)
22. Ko S.-M., Cho S.-Y, Oh M.-J., Vaidya B., Kim D. Application of concanavalin A-linked magnetic beads for the detection of hepatitis A virus. J. Food Prot. 2018;81(12):1997-2002.
23. Krajacic M., Ravnikar M., Strancar A., Gutierrez-Aguirre I. Application of monolithic chromatographic supports in virus research. Electrophoresis. 2017;38:22-23.
24. Kyzin A.A., Zagidullin N.V., Gelich L.V., Timerbaeva R.H., Isra-filov A.G. Purification and concentration of influenza virus by micro- and ultrafiltration. Vestnik Bashkirskogo Universiteta = Bulletin of Bashkir University. 2014;19(4):1223-1227. (in Russian)
27. Lu R., Li Q., Yin Z., Xagoraraki I., Tarabara V., Nguyen T. Effect of virus influent concentration on its removal by microfiltration: The case of human adenovirus 2. J. Membr. Sci. 2016;497: 120-127.
28. Maximous N., Nakhla G., Wan W., Wong K. Preparation, characterization and performance of Al2O3/PES membrane for wastewater filtration. J. Membr. Sci. 2009;341(1-2):67-75.
29. Mogi K., Hayashida K., Honda A., Yamamoto T. Development of virus concentration device by controlling ion depletion zone for ultra-sensitive virus sensing. Trans. Sens. Micromachines. 2016; 136(9):363-369.
30. Reid G.G., Milne E.W., Coggins L.W., Wilson N.J., Smith K.T., Shepherd A.J. Comparison of electron microscopic techniques for enumeration of endogenous retrovirus in mouse and Chinese hamster cell line used for production of biologics. J. Virol. Methods. 2003;108:91-96.
31. Roettger B.F., Myers J.A., Ladisch M.R., Regnier F.E. Аdsorption phenomena in hydrophobic interaction chromatography. Bio-technol. Prog. 1989;5(3):79-88.
32. Ruscic J., Gutierrez-Aguirre I., Znidaric M.T., Kolundzija S., Sla-na A., Barut M., Ravnikar M., Krajacic M. A new application of monolithic supports: The separation of viruses from one another. J. Chromatogr. A. 2015;1388:69-78.
33. Ryabinnikova A.I., Matraimov M.B., Shalgynbaev E.K., Rysta-eva R.A., Orynbaev M.B. Purification and concentration of horses rhinopneumonia virus. Nauka, Novye Tekhnologii i In-novatcii Kyrgyzstana = Science, New Technologies, and Innovations in Kyrgyzstan. 2015;4:129-131. (in Russian)
34. Sakudo A., Baba K., Ikuta K. Capturing and concentrating adenovirus using magnetic anionic nanobeads. Int. J. Nanomedicine. 2016;11:1847-1857.
36. Sakudo A., Baba K., Tsukamoto M., Sugimoto A., Okada T., Ko-bayashi T., Kawashita N., Takagi T., Ikuta K. Anionic polymer, poly(methyl vinyl ether-maleic anhydride)-coated beads-based capture of human influenza A and B virus. Bioorg. Med. Chem. 2009b;17(2):752-757.
37. Sakudo A., Ikuta K. Efficient capture of infectious H5 avian influenza virus utilizing magnetic beads coated with anionic polymer. Biochem. Biophys. Res. Commun. 2008;377(1):85-88.
38. Sakudo A., Ikuta K. A technique for capturing broad subtypes and circulating recombinant forms of HIV-1 based on anionic polymer-coated magnetic beads. Int. J. Mol. Med. 2012;30(2): 437-442.
40. Sakudo A., Tanaka Y., Ikuta K. Capture of infectious borna disease virus using anionic polymer-coated magnetic beads. Neurosci. Lett. 2011b;494(3):237-239.
41. Sanamyan A.G., Dmitrieva R.A., Doskina T.V., Lavrova D.V, Ne-dachin A.E. Use of a membrane module MPM 0142 for the concentration of viruses in the sanitary-virological surveillance of water objects. Gigiena i Sanitariya = Hygiene and Sanitation. 2006;6:74-76. (in Russian)
42. Schagen F.H.E., Rademaker H.J., Rabelink M., van Ormondt H., Fallaux F.J., van der Eb A.J., Hoeben R.C. Ammonium sulphate precipitation of recombinant adenovirus from culture medium: an easy method to increase the fetal virus yield. Gene Ther. 2000;7(18):1570-1574.
43. Segura M.M., Garnier А., Kamen А. Purification and characterization of retrovirus vector particles by rate zonal ultracentrifugation. J. Virol. Methods. 2006;133(1):82-91.
44. Sheets R.L. Opinion on adventitious agents testing for vaccines: Why do we worry so much about adventitious agents in vaccines? Vaccine. 2013;31(26):2791-2795.
45. Soto-Beltran M., Ikner L.A., Bright K.R. Effectiveness of poliovirus concentration and recovery from treated wastewater by two electropositive filter methods. Food Environ. Virol. 2013;5: 91-96.
46. Sun G., Xiao J., Wang H., Gong C., Pan U., Yan S., Wang Y Efficient purification and concentration of viruses from a large body of high turbidity seawater. MethodsX. 2014;1:197-206. DOI 10.1016/j.mex.2014.09.001.
48. Tarasov A.V., Fedotov Yu.A., Lepeshin S.A., Panov Yu.T., Oku-lov K.V., Vdovina A.I. The use of membranes with a positive surface charge for sanitary and virological control of water. Iz-vestiya Samarskogo Nauchnogo Tsentra Rossiyskoy Akademii Nauk = Proceedings of the Samara Research Center of the Russian Academy of Sciences. 2012;14(1-9):2372-2376. (in Russian)
49. Taylakova E.T., Chervyakova O.V., Sadikalieva S.O., Sultanku-lova K.T., Zaytsev V.L., Turganbaeva A.S., Sansyzbay A.R. Optimization of conditions for purification and concentration of equine influenza virus. Vestnik Nauki KazATU imeni S. Sejful-lina = Herald of Science of the Saken Seifullin Kazakh AgroTechnical University. 2011;4(71):14-23. (in Russian)
50. Transfiguracion J., Jorio H., Meghrous J., Jacob D., Kamen A. High yield purification of functional baculovirus vectors by size exclusion chromatography. J. Virol. Methods. 2007;142(1-2):21-28.
51. Trifonova E.A., Nikitin N.A., Kirpichnikov M.P., Karpova O.V., Atabekov I.G. A method of production and characterization of spherical particles, new biogenic platforms. Vestnik Moskov-skogo Universiteta. Seriya 16. Biology = Moscow University Bulletin. Series 16. Biology. 2015;4:46-50. (in Russian)
52. Vicente T., Roldao A., Peixoto C., Carrondo M.J.T., Alves P.M. Large-scale production and purification of VLP-based vaccines. J. Invertebr. Pathol. 2011;107:42-48.
53. Wickramasinghe S.R., Kalbfuss B., Zimmermann A., Thom V, Reichl U. Tangential flow microfiltration and ultrafiltration for human influenza A virus concentration and purification. Biotech-nol. Bioeng. 2005;92(2):199-208.
54. Yeh Y.T., Tang Y, Sebastian A., Dasgupta A., Perea-Lopez N., Albert I., Lu H., Terrones M., Zeng C.-Y Tunable and label-free virus enrichment for ultrasensitive virus detection using carbon nanotube arrays. Sci. Adv. 2016;2(10):e1601026. DOI 10.1126/sciadv.1601026.
55. Yousefi M.H., Zerafat M.M., Shokri-Doodeji M.D., Sabbaghi S. Investigation of dip-coating parameters effect on the performance of Alumina-Polydimethylsiloxane nanofiltration membranes for desalination. J. Water Environ. Nanotechnol. 2017; 2(4):235-242.
56. Zajtsev B.N., Taranov O.S., Rudometova N.B., Shcherbakova N.S., Il’ichev А.А., Karpenko L.I. Optimized method for counting viral particles using electron microscopy. Vavilovskii Zhurnal Ge-netiki i Selektsii = Vavilov Journal of Genetics and Breeding. 2019;23(3):237-242. DOI 10.18699/VJ19.498. (in Russian)
57. Zajtsev VP., Zolotykh D.S., Leonova V.D., Larskaya K.S., Krat I.P., Orobinskaya V.N., Konovalov D.A. The nanoparticles: methods of preparation and analysis, activity, and toxicity. Sovremennaya Nauka i Innovatsii = Modern Science and Innovation. 2016; 3(15):197-218. (in Russian)
Относящийся к данному классу атомно-силовой микроскоп оказался инструментом, подходящим для исследования биологических объектов и позволил не только визуализировать наноразмерные структуры, но и манипулировать ими. В частности, принципиально возможной оказалась манипуляция одиночными вирионами и прямое измерение сил, возникающих при их контакте с поверхностью клетки. Такие эксперименты позволяют получать подробные данные о самом первом и во многих случаях еще недостаточно исследованном этапе заражения клетки – адгезии вируса к ее поверхности. Данные исследования представляют и значительный практический интерес, т.к. могут дать ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
Вирусы являются чрезвычайно малыми объектами – их размеры лежат в диапазоне от нескольких десятков до нескольких сотен нанометров. Первым и на долгое время единственным методом прямой визуализации наноразмерных частиц стала электронная микроскопия (ЭМ), которая начала развиваться в 1930-е гг. Метод, оказавшийся очень информативным, позволил не только детально охарактеризовать структуру различных вирусов, но и исследовать процессы, происходящие в зараженной клетке.
Оказалось, что форма вирусных частиц отличается большим разнообразием: от правильных сфер до сложных структур, напоминающих кирпичи, обклеенные трубочками (вирус натуральной оспы), или щетинистых червей (вирус геморрагической лихорадки Эбола).
Вне клетки любой вирус является всего лишь молекулярным контейнером с генетическим материалом (ДНК или РНК) и вряд ли может считаться полноценным живым организмом, хотя по этому вопросу в научной среде до сих пор нет окончательной терминологической определенности.
Так, исследование репликации вируса методом просвечивающей электронной микроскопии на ультратонких срезах выглядит следующим образом: зараженные клетки обрабатывают фиксирующим раствором, обезвоживают спиртом и заливают специальной смолой. После отвердевания смолы с помощью специального прибора – ультратома – делают ультратонкие (≈ 50 нм) срезы, которые затем наносят на специальную сетку и обрабатывают растворами солей тяжелых металлов. Во время самого микроскопического исследования образец находится в вакуумной камере и подвергается действию пучка электронов с энергией в несколько десятков кэВ. Очевидно, что прижизненная визуализация в данном случае принципиально невозможна.
В течение почти полувека электронная микроскопия оставалась единственным методом визуализации наноразмерных объектов. Однако в начале 1980-х гг. эта монополия была нарушена появлением сканирующей зондовой микроскопии (СЗМ). Основным принципом СЗМ является сканирование – прецизионное (с высокой точностью) перемещение зонда вблизи исследуемой поверхности, сопряженное с отслеживанием определенного параметра, характеризующего взаимодействие между зондом и образцом. Результатом такого сканирования является топографическая карта рельефа поверхности образца.
Первым прибором СЗМ стал сканирующий туннельный микроскоп (СТМ), который мог лишь весьма ограниченно использоваться для визуализации биологических объектов, так как для его работы требовалась высокая электрическая проводимость исследуемой поверхности.
В 1986 г. швейцарский физик Г. Бинниг и его коллеги создали новый прибор семейства СЗМ – атомно-силовой микроскоп (АСМ). В основе его работы лежит силовое (Ван-дер-Ваальсово) взаимодействие атомов зонда и поверхности. АСМ не требуется электрическая проводимость поверхности образца, и он может осуществлять съемку в жидкой среде. Поэтому этот прибор оказался удобным инструментом для исследования биологических объектов.

С момента появления атомно-силового микроскопа было опубликовано огромное число работ, посвященных АСМ-визуализации самых разнообразных биологических образцов. Следует все же признать, что в большинстве случаев в плане визуализации АСМ не дает ничего принципиально нового в сравнении с обычной электронной микроскопией, поэтому зачастую данный метод воспринимается биологами как техническая экзотика, а не как полноценный исследовательский инструмент.
Однако важнейшим, пусть и почти единственным преимуществом визуализации биологических объектов при помощи АСМ по сравнению с электронной микроскопией является возможность выполнения исследований нативных, природных образцов без какой-либо фиксации и специальной пробоподготовки, при физиологических параметрах среды.
Помимо визуализации рельефа поверхности с субнанометровым разрешением АСМ позволяет осуществлять прямое измерение сил, возникающих при взаимо¬действии одиночных наноразмерных объектов.
Проводятся такие измерения следующим образом: один объект закрепляется на острие зонда АСМ, а второй фиксируется на подложке, после чего зонд подводится к поверхности подложки до достижения механического контакта, а затем возвращается обратно. В ходе этого перемещения отслеживается деформация упругой консоли (кантилевера). Зависимость этого параметра от расстояния между зондом и подложкой называется силовой кривой. С ее помощью можно определить величину силы, действующей между исследуемыми объектами. Этот метод, названный атомно-силовой спектроскопией (АСС), может использоваться для исследования силовых характеристик взаимодействия самых разнообразных малых объектов: от неорганических наночастиц до вирусов и живых клеток.
Начальным этапом заражения клетки вирусом является адгезия (прилипание) вирусной частицы (вириона) к клеточной поверхности с последующим проникновением генетического материала вируса внутрь клетки. Этот процесс, определяемый взаимодействием белковых рецепторов, расположенных на поверхности клетки, с поверхностными белками вириона, является критически важным для размножения вируса. И, надо отметить, в большинстве случаев изучен недостаточно.

Однако фиксация одиночной вирусной частицы на острие зонда атомно-силового микроскопа является весьма непростой задачей. Для успешного проведения эксперимента требуется большая подготовительная работа:
- получить как можно более чистый и концентрированный препарат вируса;
- подготовить на острие зонда площадку подходящего размера для посадки вириона;
- химически активировать поверхность зонда для образования ковалентных связей при контакте с белками вируса;
- убедиться в том, что на зонде закрепился действительно вирион, а не молекулы свободного белка или мелкие фрагменты клеток, всегда присутствующие в препаратах вирусов.
Оценка концентрации и степени чистоты препарата вируса обычно проводится методом просвечивающей электронной микроскопии. Площадку на острие АСМ-зонда, которое обычно изготавливают из кремния или его нитрида, формируют путем длительного сканирования кремниевой или сапфировой подложки при больших значениях развертки и силы прижатия зонда к поверхности. Наиболее наглядной иллюстрацией для этого процесса служит изменение формы острия карандаша в ходе интенсивного рисования.
По меркам микроскопии, клетка высших организмов является относительно крупным (≈ 10 мкм) объектом, поэтому хорошо видна в световом микроскопе, при помощи которого на нее наводится кантилевер атомно-силового микроскопа. Но как быть с самим зондом, на острие которого предполагается наличие вириона? Строго говоря, вместо вириона там может оказаться все, что угодно: монослой белковых молекул, фрагмент клетки или вириона, агрегат из нескольких вирионов, случайное загрязнение и т. д. Кроме того, в процессе измерения вирион может разрушиться или оторваться от зонда. Визуализация же зонда с вирусной частицей методом электронной микроскопии до силовых измерений недопустима, так как под воздействием высушивания, вакуума и пучка электронов вирион приобретет необратимые изменения.
Наиболее эффективным методом решения данной проблемы оказалась визуализация острия зонда АСМ с помощью электронной микроскопии, осуществляемая непосредственно после силовых измерений. Если на острие будет обнаружена вирусная частица, уцелевшая в ходе эксперимента, то все сомнения развеются.
В течение последних пятидесяти лет в результате поистине титанической работы, проделанной электронными микроскопистами всего мира, накоплен огромный багаж знаний в области ультраструктурных аспектов репликации различных вирусов. Создание атомно-силового микроскопа и техники силовой спектроскопии позволило вплотную приблизиться к произвольной механической манипуляции одиночными вирусными частицами. Это выводит изучение взаимодействия вируса с клеткой на принципиально другой уровень – от структурных исследований к функциональным.
При этом атомно-силовая спектроскопия не является конкурентом для электронной микроскопии, а открывает новое самостоятельное направление исследований – наномеханику взаимодействия вирусной частицы с поверхностью клетки. Весьма вероятно, что в самом ближайшем будущем в данном направлении будут совершены фундаментальные открытия, соизмеримые по значимости с достижениями электронной микроскопии в середине прошлого века.
Изучение механизмов связывания вирусных частиц с поверхностью клетки вызывает значительный интерес не только с позиции фундаментальной науки, но и в контексте практических приложений. Более детальное понимание этих механизмов на молекулярном уровне может дать человечеству ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
*Просвечивающая электронная микроскопия с использованием специальной жидкостной ячейки и сканирующая электронная микроскопия при атмосферном давлении позволяют исследовать биологические объекты без фиксации, но из-за ряда технических трудностей и относительно низкого пространственного разрешения эти методы не получили широкого распространения
Корнеев Д. В., Бессуднова Е. В., Зайцев Б. Н. Изучение взаимодействия наночастиц TiO2 и поверхности эритроцитов человека методом атомно-силовой спектроскопии // УНЖ. 2012. № 4. С. 73—77.
Alsteens D., Pesavent E., Cheuvart G. et al. Controlled manipulation of bacteriophages using single-virus force spectroscopy // ACSNANO. 2009. V. 3(10). P. 3063—3068.
Alsteens D., Trabelsi H., Soumillion P., Dufrene Y. F., Multiparametric atomic force microscopy imaging of single bacteriophages extruding from living bacteria // Nature Communications. V. 4. Article number: 2926.
Binnig G., Quate C. F., Gerber Ch. Atomic force microscope // Phys. Rev. Lett. 1986. V. 56(9). P. 930—933.
Cappella B., Dietler G. Force-distance curves by atomic force microscopy // Surf. Sci. Rep. 1999. V. 34. P. 1—104.
Malkin A.J., Plomp M., McPherson A. Unraveling the architecture of viruses by high-resolution atomic force microscopy // Methods Mol. Biol. 2005. V. 292. P. 85—108.
Отличительные черты методов исследования вирусов. Сущность, значение и применение электронной и иммуноэлектронной микроскопии, специфика иммунофлюоресцентного метода. Описание метода молекулярной гибридизации. Схема действия электронного микроскопа.
| Рубрика | Биология и естествознание |
| Вид | курсовая работа |
| Язык | русский |
| Дата добавления | 23.04.2015 |
| Размер файла | 268,4 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
Факультет естественных наук
Кафедра ботаники и генетики
Методы исследования вирусов
Выполнила: Евтеева Д.С
МЕТОДЫ ИССЛЕДОВАНИЯ ВИРУСОВ
ЭЛЕКТРОННАЯ МИКРОСКОПИЯ ВИРУСОВ
МЕТОД МОЛЕКУЛЯРНОЙ ГИБРИДИЗАЦИИ
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
Вирусы как облигатные внутриклеточные паразиты не способны расти на искусственных питательных средах. Они могут размножаться только в организмах восприимчивых хозяев или в живых чувствительных к вирусу клетках.
Организм восприимчивого хозяина для исследования вирусов используется в тех случаях, когда нет экспериментальных систем для изучения патогенеза вирусных инфекций, при тестировании безопасности вирусных вакцин или специфической безвредности вирусных препаратов. Кроме очевидных достоинств, методы имеют недостатки и ограничения, связанные с трудностями стандартизации и воспроизводимости результатов, а также из за относительно высокой стоимости экспериментов.
Культуры клеток, введенные в исследовательскую практику в 1940 х годах, кардинально изменили методический арсенал вирусоло гии.
В настоящее время культуральные методы являются основными в экспериментальной и практической вирусологии.
Методы исследования, применяемые в вирусологии отличаются значительной сложностью, что связано прежде всего с абсолютным внутриклеточным паразитизмом вирусов и их малыми размерами.
МЕТОДЫ ИССЛЕДОВАНИЯ ВИРУСОВ
Методы исследования, применяемые в вирусологии отличаются значительной сложностью, что связано прежде всего с абсолютным внутриклеточным паразитизмом вирусов и их малыми размерами.
При исследовании материалов, полученных от больных вирусными инфекциями, с целью лабораторной диагностики этих заболеваний применяются различные методы:
· Методы электронной и иммуноэлектронной микроскопии;
· Метод молекулярной гибридизации;
· Метод иммунофлюоресценции;
· Выявление антител класса lgM.
ЭЛЕКТРОННАЯ МИКРОСКОПИЯЭлектронная микроскопия -- это метод исследования структур, находящихся вне пределов видимости светового микроскопа и имеющих размеры менее одного микрона (от 1 мк до 1--5 A).
Действие электронного микроскопа (Прил.1.рис.1) основано на использовании направленного потока электронов, который выполняет роль светового луча в световом микроскопе, а роль линз играют магниты (магнитные линзы).
Вследствие того, что различные участки исследуемого объекта по-разному задерживают электроны, на экране электронного микроскопа получается черно-белое изображение изучаемого объекта, увеличенное в десятки и сотни тысяч раз. В биологии и медицине в основном используются электронные микроскопы просвечивающего типа.
Электронная микроскопия возникла в 30-х годах, когда были получены первые изображения некоторых вирусов (вируса табачной мозаики и бактериофагов). В настоящее время электронная микроскопия нашла наиболее широкое применение в цитологии, микробиологии и вирусологии, обусловив создание новых отраслей науки. При электронной микроскопии биологических объектов применяют специальные методы приготовления препаратов. Это необходимо для выявления отдельных компонентов изучаемых объектов ( вируса ), а также для сохранения их структуры в условиях высокого вакуума под пучком электронов.
При помощи электронной микроскопии изучается внешняя форма объекта, молекулярная организация его поверхности, с помощью метода ультратонких срезов исследуется внутреннее строение объекта.
Электронная микроскопия в сочетании с биохимическими, цитохимическими методами исследования, иммунофлюоресценцией, а также рентгеноструктурным анализом позволяют судить о составе и функции структурных элементов клеток и вирусов.
Электронная микроскопия вирусов, окрашенных методом негативного контрастирования, позволяет дифференцировать вирусы и определять их концентрацию. Применение электронной микроскопии в диагностике вирусных инфекций ограничивается теми случаями, когда концентрация вирусных частиц в клиническом материале достаточно высокая (105в 1 мл и выше).
Недостатком метода является невозможность отличать вирусы, принадлежащие к одной таксономической группе. Этот недостаток устраняется путем использования иммунной электронной микроскопии.
Метод основан на образовании иммунных комплексов при добавлении специфической сыворотки к вирусным частицам, при этом происходит одновременная концентрация вирусных частиц, позволяющая идентифицировать их. Метод применяют также для выявления антител. В целях экспресс-диагностики проводят электронно-микроскопическое исследование экстрактов тканей, фекалий, жидкости из везикул, секретов из носоглотки.
Электронную микроскопию широко используют для изучения морфогенеза вируса, ее возможности расширяются при применении меченых антител.
ИММУНОЭЛЕКТРОННАЯ МИКРОСКОПИЯ
Представляет собой непосредственную визуализацию взаимодействия антигена и антител методом электронной микроскопии, была впервые предложена для вирусологических исследований Дж. Альмейда и А. Ватерсоном в 1969г.
Методически тест ИЭМ выполняется в следующей последовательности:
1. Материал, в котором предполагается наличие искомого вируса, смешивается и инкубируется со стандартной иммунной сывороткой;
2. Комплекс вирус-антитело осаждается центрифугированием в подходящих для него режимах;
3. К ресуспендированному осадку добавляется контрастирующее вещество, и полученный препарат исследуется под электронным микроскопом.
В случае положительной реакции выявляются характерные агрегаты, состоящие из вирусных частиц, соединенных между собой мостиками из антител. Порог чувствительности ИЭМ невысок: надежное выявление вируса осуществимо, когда его концентрация в исходном материале составляет 10^4 -- 10^6 частиц в мл.
Преимуществом метода является возможность оценивать не только исход серологической реакции, но и идентифицировать ее морфологический субстрат, т. е. определить форму и размер вирусных частиц. При наличии препаратов вируса с известным содержанием частиц ИЭМ может применяться и для количественного определения антител в сыворотках, для чего предложена специальная система учета интенсивности взаимодействия вируса и антител.
Серологические методы в вирусологии основаны на классических иммунологических реакциях :Реакции связывания комплемента, торможения гемагглютинации, биологической нейтрализации, иммунодиффузии, непрямой гемагглютинации, радиального гемолиза, иммунофлюоресценции, иммуноферментного, радиоиммунного анализа. Разработаны микрометоды многих реакций, техника их непрерывно совершенствуются.
Эти методы используют для идентификации вирусов с помощью набора известных сывороток и для серодиагностики с целью определения нарастания антител во второй сыворотке по сравнению с первой (первую сыворотку берут в первые дни после заболевания, вторую -- через 2--3 нед.). Диагностическое значение имеет не менее чем четырехкратное нарастание антител во второй сыворотке. Если выявление антител класса lgM свидетельствует о недавно перенесенной инфекции, то антитела класса lgC сохраняются в течение нескольких лет, а иногда и пожизненно. Для идентификации индивидуальных антигенов вирусов и антител к ним в сложных смесях без предварительной очистки белков используют иммуноблоттинг.
Метод сочетает фракционирование белков с помощью электрофореза в полиакриламидном геле с последующей иммуноиндикацией белков иммуноферментным методом. Разделение белков снижает требования к химической чистоте антигена и позволяет выявлять индивидуальные пары антиген -- антитело. Такая задача актуальна, например, при серодиагностике ВИЧ-инфекции, где ложноположительные реакции иммуноферментного анализа обусловлены наличием антител к клеточным антигенам, которые присутствуют в результате недостаточной очистки вирусных белков.
Идентификация антител в сыворотках больных к внутренним и наружным вирусным антигенам позволяет определять стадию заболевания, а при анализе популяций -- изменчивость вирусных белков.
Иммуноблоттинг при ВИЧ-инфекции применяют как подтверждающий тест для выявления индивидуальных вирусных антигенов и антител к ним. При анализе популяций метод используют для определения изменчивости вирусных белков.
Большая ценность метода заключается в возможности анализа антигенов, синтезируемых с помощью технологии рекомбинантных ДНК, установлении их размеров и наличия антигенных детерминант.
вирус молекулярный гибридизация микроскоп
Иммунофлюоресцентный метод, или реакция иммунофлюоресценции (РИФ), используется в микробиологических лабораториях, оборудованных люминесцентным микроскопом.
В исследовании применяются прямая и непрямая реакции иммунофлюоресценции.
При использовании для диагностики прямой реакции иммунофлюоресценции на предметное стекло наносят зафиксированный этанолом клинический материал.
Затем в него добавляют люминесцентную сыворотку. Проводят осмотр препарата под люминесцентным микроскопом.
Иммунологическая реакция антиген-антитело происходит непосредственно на предметном стекле. Например, гриппозный антиген, который соединился с меченым иммуноглобулином, под микроскопом имеет вид ярких светящихся частиц, размещенных в ядре и цитоплазме зараженных клеток. Метод простой, но для его выполнения необходимы люминесцентные сыворотки к каждому типу антигенов.
Суть непрямой реакции иммунофлюоресценции заключается в том, что сначала на предметном стекле антиген связывается со специфической (немеченой) сывороткой. К образованному на стекле комплексу антиген-антитело добавляют люминесцентную сыворотку.
Конечным этапом является микроскопия, которая выявляет меченые комплексы.
При этом методе расходуется небольшое количество люминесцентных сывороток, поэтому он широко используется для выявления бактериальных, риккетсиозных, пневмоцистных инфекций.
Он позволяет легко идентифицировать вирусы гриппа, парагриппа, аденовирусы, респираторно-синцитиальный вирус, цитомегаловирус. Диагностику легионеллезной и хламидийной инфекции следует также производить с помощью реакции иммунофлюоресценции на определение соответствующего антигена.
МЕТОД МОЛЕКУЛЯРНОЙ ГИБРИДИЗАЦИИ
Метод молекулярной гибридизации, основанный на выявлении вирусоспецифических нуклеиновых кислот, позволяет обнаружить единичные копии генов и по степени чувствительности не имеет себе равных.
Реакция основана на гибридизации комплементарных нитей ДНК или РНК (зондов) и формировании двунитчатых структур. Наиболее дешевым зондом является клонированная рекомбинантная ДНК. Зонд метят радиоактивными предшественниками (обычно радиоактивным фосфором). Перспективно использование колориметрических реакций.
Существует несколько вариантов молекулярной гибридизации: точечная, блот-гибридизация, сэндвич-гибридизация, гибридизация in situ и др.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1) Лабораторная диагностика вирусных инфекций, Н.Н. Носик, В.М. Стаханова2) Институт вирусологии им. Д . И . Ивановского РАМН , Москва ; Laboratory Diagnosis of Viral Infections , N.N. Nosik, V.M. Stachanova
3) Атлас анатомии и онтогенеза вирусов человека и животных, А. А. Авакян, А. Ф. Быковский, 1970Относящийся к данному классу атомно-силовой микроскоп оказался инструментом, подходящим для исследования биологических объектов и позволил не только визуализировать наноразмерные структуры, но и манипулировать ими. В частности, принципиально возможной оказалась манипуляция одиночными вирионами и прямое измерение сил, возникающих при их контакте с поверхностью клетки. Такие эксперименты позволяют получать подробные данные о самом первом и во многих случаях еще недостаточно исследованном этапе заражения клетки — адгезии вируса к ее поверхности. Данные исследования представляют и значительный практический интерес, т.к. могут дать ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
Об авторе
Вирусы являются чрезвычайно малыми объектами — их размеры лежат в диапазоне от нескольких десятков до нескольких сотен нанометров. Первым и на долгое время единственным методом прямой визуализации наноразмерных частиц стала электронная микроскопия (ЭМ), которая начала развиваться в 1930-е гг. Метод, оказавшийся очень информативным, позволил не только детально охарактеризовать структуру различных вирусов, но и исследовать процессы, происходящие в зараженной клетке.
Оказалось, что форма вирусных частиц отличается большим разнообразием: от правильных сфер до сложных структур, напоминающих кирпичи, обклеенные трубочками (вирус натуральной оспы), или щетинистых червей (вирус геморрагической лихорадки Эбола).
Вне клетки любой вирус является всего лишь молекулярным контейнером с генетическим материалом (ДНК или РНК) и вряд ли может считаться полноценным живым организмом, хотя по этому вопросу в научной среде до сих пор нет окончательной терминологической определенности.
Так, исследование репликации вируса методом просвечивающей электронной микроскопии на ультратонких срезах выглядит следующим образом: зараженные клетки обрабатывают фиксирующим раствором, обезвоживают спиртом и заливают специальной смолой. После отвердевания смолы с помощью специального прибора — ультратома — делают ультратонкие (≈ 50 нм) срезы, которые затем наносят на специальную сетку и обрабатывают растворами солей тяжелых металлов. Во время самого микроскопического исследования образец находится в вакуумной камере и подвергается действию пучка электронов с энергией в несколько десятков кэВ. Очевидно, что прижизненная визуализация в данном случае принципиально невозможна.
В течение почти полувека электронная микроскопия оставалась единственным методом визуализации наноразмерных объектов. Однако в начале 1980-х гг. эта монополия была нарушена появлением сканирующей зондовой микроскопии (СЗМ). Основным принципом СЗМ является сканирование — прецизионное (с высокой точностью) перемещение зонда вблизи исследуемой поверхности, сопряженное с отслеживанием определенного параметра, характеризующего взаимодействие между зондом и образцом. Результатом такого сканирования является топографическая карта рельефа поверхности образца.
Первым прибором СЗМ стал сканирующий туннельный микроскоп (СТМ), который мог лишь весьма ограниченно использоваться для визуализации биологических объектов, так как для его работы требовалась высокая электрическая проводимость исследуемой поверхности.
В 1986 г. швейцарский физик Г. Бинниг и его коллеги создали новый прибор семейства СЗМ — атомно-силовой микроскоп (АСМ). В основе его работы лежит силовое (Ван-дер-Ваальсово) взаимодействие атомов зонда и поверхности. АСМ не требуется электрическая проводимость поверхности образца, и он может осуществлять съемку в жидкой среде. Поэтому этот прибор оказался удобным инструментом для исследования биологических объектов.
Принципиальная схема работы атомно-силового микроскопа (АСМ). Чувствительным элементом АСМ является упругая консоль (кантилевер), на конце которой закреплен острый зонд. Силы, возникающие между атомами острия зонда и исследуемой поверхностью приводят к деформации кантилевера, которая в свою очередь фиксируется при помощи оптической системы, реализованной в большинстве современных АСМ на основе полупроводникового лазера и четырехсекционного фотоприемника. Размер кантилевера — 100÷300 × 20÷40 мкм при толщине около 2 мкм. Высота зонда — около 10 мкм
С момента появления атомно-силового микроскопа было опубликовано огромное число работ, посвященных АСМ-визуализации самых разнообразных биологических образцов. Следует все же признать, что в большинстве случаев в плане визуализации АСМ не дает ничего принципиально нового в сравнении с обычной электронной микроскопией, поэтому зачастую данный метод воспринимается биологами как техническая экзотика, а не как полноценный исследовательский инструмент.
Однако важнейшим, пусть и почти единственным преимуществом визуализации биологических объектов при помощи АСМ по сравнению с электронной микроскопией является возможность выполнения исследований нативных, природных образцов без какой-либо фиксации и специальной пробоподготовки, при физиологических параметрах среды.
Помимо визуализации рельефа поверхности с субнанометровым разрешением АСМ позволяет осуществлять прямое измерение сил, возникающих при взаимодействии одиночных наноразмерных объектов.
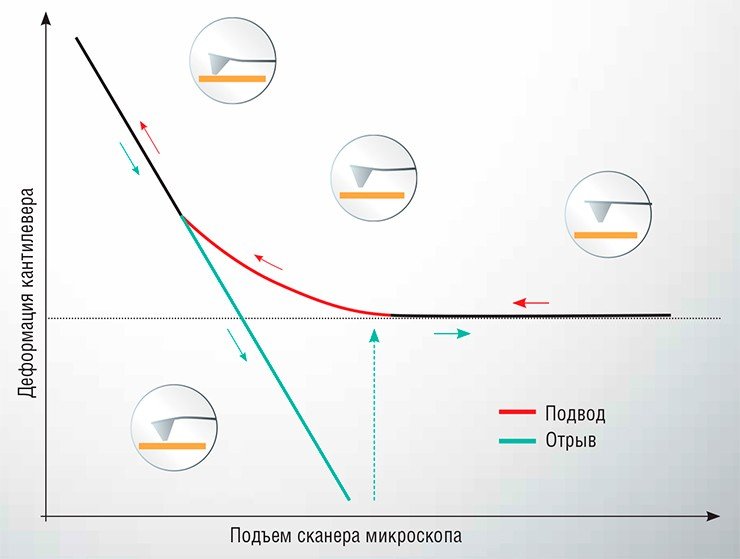
Проводятся такие измерения следующим образом: один объект закрепляется на острие зонда АСМ, а второй фиксируется на подложке, после чего зонд подводится к поверхности подложки до достижения механического контакта, а затем возвращается обратно. В ходе этого перемещения отслеживается деформация упругой консоли (кантилевера). Зависимость этого параметра от расстояния между зондом и подложкой называется силовой кривой. С ее помощью можно определить величину силы, действующей между исследуемыми объектами. Этот метод, названный атомно-силовой спектроскопией (АСС), может использоваться для исследования силовых характеристик взаимодействия самых разнообразных малых объектов: от неорганических наночастиц до вирусов и живых клеток.
Метод атомно-силовой спектроскопии позволяет определить величину силы, действующей между исследуемыми объектами. Для этого один объект закрепляется на острие зонда АСМ, а второй фиксируется на подложке. Зонд подводится к поверхности подложки и затем поднимается обратно. Зависимость деформации кантилевера от расстояния между зондом и подложкой называется силовой кривой
Начальным этапом заражения клетки вирусом является адгезия (прилипание) вирусной частицы (вириона) к клеточной поверхности с последующим проникновением генетического материала вируса внутрь клетки. Этот процесс, определяемый взаимодействием белковых рецепторов, расположенных на поверхности клетки, с поверхностными белками вириона, является критически важным для размножения вируса. И, надо отметить, в большинстве случаев изучен недостаточно.
Однако фиксация одиночной вирусной частицы на острие зонда атомно-силового микроскопа является весьма непростой задачей. Для успешного проведения эксперимента требуется большая подготовительная работа:
- получить как можно более чистый и концентрированный препарат вируса;
- подготовить на острие зонда площадку подходящего размера для посадки вириона;
- химически активировать поверхность зонда для образования ковалентных связей при контакте с белками вируса;
- убедиться в том, что на зонде закрепился действительно вирион, а не молекулы свободного белка или мелкие фрагменты клеток, всегда присутствующие в препаратах вирусов.
Оценка концентрации и степени чистоты препарата вируса обычно проводится методом просвечивающей электронной микроскопии. Площадку на острие АСМ-зонда, которое обычно изготавливают из кремния или его нитрида, формируют путем длительного сканирования кремниевой или сапфировой подложки при больших значениях развертки и силы прижатия зонда к поверхности. Наиболее наглядной иллюстрацией для этого процесса служит изменение формы острия карандаша в ходе интенсивного рисования.
Адекватным методом контроля геометрических параметров зонда атомно-силового микроскопа (а) при создании площадки для посадки вириона, является электронная микроскопия, как сканирующая, так и просвечивающая: б — площадка на острие зонда для посадки крупной вирусной частицы; в — вирусоподобная частица, закрепленная на острие зонда. Просвечивающая электронная микроскопия (JEM 1400, Jeol, Япония)
По меркам микроскопии, клетка высших организмов является относительно крупным (≈ 10 мкм) объектом, поэтому хорошо видна в световом микроскопе, при помощи которого на нее наводится кантилевер атомно-силового микроскопа. Но как быть с самим зондом, на острие которого предполагается наличие вириона? Строго говоря, вместо вириона там может оказаться все, что угодно: монослой белковых молекул, фрагмент клетки или вириона, агрегат из нескольких вирионов, случайное загрязнение и т. д. Кроме того, в процессе измерения вирион может разрушиться или оторваться от зонда. Визуализация же зонда с вирусной частицей методом электронной микроскопии до силовых измерений недопустима, так как под воздействием высушивания, вакуума и пучка электронов вирион приобретет необратимые изменения.
Наиболее эффективным методом решения данной проблемы оказалась визуализация острия зонда АСМ с помощью электронной микроскопии, осуществляемая непосредственно после силовых измерений. Если на острие будет обнаружена вирусная частица, уцелевшая в ходе эксперимента, то все сомнения развеются.
В течение последних пятидесяти лет в результате поистине титанической работы, проделанной электронными микроскопистами всего мира, накоплен огромный багаж знаний в области ультраструктурных аспектов репликации различных вирусов. Создание атомно-силового микроскопа и техники силовой спектроскопии позволило вплотную приблизиться к произвольной механической манипуляции одиночными вирусными частицами. Это выводит изучение взаимодействия вируса с клеткой на принципиально другой уровень — от структурных исследований к функциональным.
При этом атомно-силовая спектроскопия не является конкурентом для электронной микроскопии, а открывает новое самостоятельное направление исследований — наномеханику взаимодействия вирусной частицы с поверхностью клетки. Весьма вероятно, что в самом ближайшем будущем в данном направлении будут совершены фундаментальные открытия, соизмеримые по значимости с достижениями электронной микроскопии в середине прошлого века.
Изучение механизмов связывания вирусных частиц с поверхностью клетки вызывает значительный интерес не только с позиции фундаментальной науки, но и в контексте практических приложений. Более детальное понимание этих механизмов на молекулярном уровне может дать человечеству ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
В публикации использованы фото автора
* Просвечивающая электронная микроскопия с использованием специальной жидкостной ячейки и сканирующая электронная микроскопия при атмосферном давлении позволяют исследовать биологические объекты без фиксации, но из-за ряда технических трудностей и относительно низкого пространственного разрешения эти методы не получили широкого распространения.
Вот уже два года, как я наблюдаю за микромиром у себя дома, и год, как снимаю его на фотокамеру. За это время собственными глазами увидел, как выглядят клетки крови, чешуйки, опадающие с крыльев бабочек, как бьётся сердце улитки. Конечно, многое можно было бы узнать из учебников, видеолекций и тематических сайтов. Но при этом не было бы ощущения присутствия, близости к тому, что не видно невооружённым глазом. Что это не просто слова из книжки, а личный опыт. Опыт, который сегодня доступен каждому.
Что купить
Театр начинается с вешалки, а микросъёмка с покупки оборудования, и прежде всего — микроскопа. Одна из основных его характеристик — набор доступных увеличений, которые определяются произведением увеличений окуляра и объектива.

Детёныш улитки. Увеличение 40×
Не всякий биологический образец хорош для просмотра при большом увеличении. Связано это с тем, что чем больше увеличение оптической системы, тем меньше глубина резкости. Следовательно, изображение неровных поверхностей препарата частично будет размыто. Поэтому важно иметь набор объективов и окуляров, позволяющий вести наблюдения с увеличением от 10–20 до 900–1000×. Иногда бывает оправданно добиться увеличения 1500× (окуляр 15 и объектив 100×). Большее увеличение бессмысленно, так как более мелкие детали не позволяет видеть волновая природа света.

Лист клевера. Увеличение 100×. Некоторые клетки содержат тёмно-красный пигмент

Лист земляники. Увеличение 40×
Наблюдение при больших увеличениях требует хорошего освещения в силу небольшой апертуры объективов. Световой пучок от осветителя, преобразованный в оптическом устройстве — конденсоре, освещает препарат. В зависимости от характера освещения существует несколько способов наблюдения, самые распространённые из которых — методы светлого и тёмного поля. В первом, самом простом, знакомом многим ещё со школы, препарат освещают равномерно снизу. При этом через оптически прозрачные детали препарата свет распространяется в объектив, а в непрозрачных он поглощается и рассеивается. На белом фоне получается тёмное изображение, отсюда и название метода. С тёмнопольным конденсором всё иначе. Световой пучок, выходящий из него, имеет форму конуса, лучи в объектив не попадают, а рассеиваются на непрозрачном препарате, в том числе и в направлении объектива. В итоге на тёмном фоне виден светлый объект. Такой метод наблюдения хорош для исследования прозрачных малоконтрастных объектов. Поэтому, если вы планируете расширить набор методов наблюдения, стоит выбирать модели микроскопов, в которых предусмотрена установка дополнительного оборудования: конденсора тёмного поля, тёмнопольной диафрагмы, устройств фазового контраста, поляризаторов и т. п.
Иногда следует обратить внимание на устройство предметного столика и рукояток для управления им. Стоит выбрать и тип осветителя, которым может быть как обычная лампа накаливания, так и светодиод, который ярче и греется меньше. Микроскопы тоже имеют индивидуальные особенности. Каждая дополнительная опция — это добавка в цене, поэтому выбор модели и комплектации остаётся за потребителем.
Сегодня нередко покупают недорогие микроскопы для детей, монокуляры с небольшим набором объективов и скромными параметрами. Они могут послужить хорошей отправной точкой не только для исследования микромира, но и для ознакомления с основными принципами работы микроскопа. После этого ребёнку уже стоит купить более серьёзное устройство.
Как смотреть
Можно купить далеко не дешёвые наборы готовых препаратов, но тогда не таким ярким будет ощущение личного участия в исследовании, да и наскучат они рано или поздно. Поэтому следует позаботиться и об объектах для наблюдения, и о доступных средствах для подготовки препаратов.
Наблюдение в проходящем свете предполагает, что исследуемый объект достаточно тонок. Даже кожура ягоды или фрукта слишком толста, поэтому в микроскопии исследуют срезы. В домашних условиях их делают обычными бритвенными лезвиями. Чтобы не смять кожуру, её помещают между кусочками пробки или заливают парафином. При определённой сноровке можно достигнуть толщины среза в несколько клеточных слоёв, а в идеале следует работать с моноклеточным слоем ткани — несколько слоёв клеток создают нечёткое сумбурное изображение.

Крыло жучка бибиониды. Увеличение 400×
При выезде на природу следует запастись баночками для набора воды из ближайшего водоёма и маленькими пакетиками для листьев, высохших остатков насекомых и т. п.
Что смотреть
Микроскоп приобретён, инструменты закуплены — пора начинать. И начать следует с самого доступного — например, кожуры репчатого лука. Тонкая сама по себе, подкрашенная йодом, она обнаруживает в своём строении чётко различимые клеточные ядра. Этот опыт, хорошо знакомый со школы, и стоит провести первым. Луковую кожуру нужно залить йодом на 10–15 минут, после чего промыть под струёй воды.

Кожица лука. Увеличение 1000×. Окраска йодом. На фотографии видно клеточное ядро

Кожица лука. Увеличение 1000×. Окраска азур-эозином. На фотографии в ядре заметно ядрышко
Кроме того, йод можно использовать для окраски картофеля. Срез необходимо сделать как можно более тонким. Буквально 5–10 минут его пребывания в йоде проявят пласты крахмала, который окрасится в синий цвет.

Картофель. Синие пятна — зёрна крахмала. Увеличение 100×. Окраска йодом

Плёнка на спине таракана. Увеличение 400×

Чешуйки с крыльев моли. Увеличение 400×
Кроме того, с помощью микроскопа можно изучить строение конечностей насекомых и пауков, рассмотреть, например, хитиновые плёнки на спине таракана. И при должном увеличении убедиться, что такие плёнки состоят из плотно прилегающих (возможно, сросшихся) чешуек.

Крыло бабочки боярышницы. Увеличение 100×
Не менее интересный объект для наблюдения — кожура ягод и фруктов. Однако либо её клеточное строение может быть неразличимым, либо её толщина не позволит добиться чёткого изображения. Так или иначе, придётся сделать немало попыток, прежде чем получится хороший препарат: перебрать разные сорта винограда, чтобы найти тот, у которого красящие вещества кожуры имели бы интересную форму, или сделать несколько срезов кожицы сливы, добиваясь моноклеточного слоя. В любом случае вознаграждение за проделанную работу будет достойным.

Кожура сливы. Увеличение 1000×
Ещё более доступны для исследования трава, водоросли, листья. Но, несмотря на повсеместную распространённость, выбрать и приготовить из них хороший препарат бывает непросто. Самое интересное в зелени — это, пожалуй, хлоропласты. Поэтому срез должен быть исключительно тонким.

Хлоропласты в клетках травы. Увеличение 1000×
Приемлемой толщиной нередко обладают зелёные водоросли, встречающиеся в любых открытых водоёмах. Там же можно найти плавучие водоросли и микроскопических водных обитателей — мальков улитки, дафний, амёб, циклопов и туфелек. Маленький детёныш улитки, оптически прозрачный, позволяет разглядеть у себя биение сердца.

Хлоропласты в клетках водоросли. Увеличение 1000×
Сам себе исследователь
После изучения простых и доступных препаратов захочется усложнить технику наблюдения и расширить класс исследуемых объектов. Для этого понадобится и специальная литература, и специализированные средства, свои для каждого типа объектов, но всё-таки обладающие некоторой универсальностью. Например, метод окраски по Граму, когда разные виды бактерий начинают различаться по цвету, можно применить и для других, не бактериальных, клеток. Близок к нему и метод окраски мазков крови по Романовскому. В продаже имеется как уже готовый жидкий краситель, так и порошок, состоящий из его компонентов — азура и эозина. Их можно купить в специализированных магазинах либо заказать в интернете. Если раздобыть краситель не удастся, можно попросить у лаборанта, делающего вам анализ крови в поликлинике, стёклышко с окрашенным её мазком.

Мазок крови. Окраска азур-эозином по Романовскому. Увеличение 1000×. На фотографии: эозинофил на фоне эритроцитов
Продолжая тему исследования крови, следует упомянуть камеру Горяева — устройство для подсчёта количества клеток крови и оценки их размеров. Методы исследования крови и других жидкостей с помощью камеры Горяева описаны в специальной литературе.

Мазок крови. Окраска азур-эозином по Романовскому. Увеличение 1000×. На фотографии: слева — моноцит, справа — лимфоцит
В современном мире, где разнообразные технические средства и устройства находятся в шаговой доступности, каждый сам решает, на что ему потратить деньги. Это может быть дорогостоящий ноутбук или телевизор с запредельным размером диагонали. Находятся и те, кто отводит свой взор от экранов и направляет его далеко в космос, приобретая телескоп. Микроскопия может стать интересным хобби, а для кого-то даже и искусством, средством самовыражения. Глядя в окуляр микроскопа, проникают глубоко внутрь той природы, часть которой мы сами.
Словарик к статье
Читайте также:

