Можно ли вылечить герпес навсегда в интимных
Обновлено: 06.05.2024
Что такое вагинальный кандидоз (молочница)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Соснина А. С., гинеколога со стажем в 15 лет.
Над статьей доктора Соснина А. С. работали литературный редактор Вера Васина , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Вагинальный кандидоз (кандидозный вагинит) — поражение слизистой оболочки влагалища дрожжеподобными грибами рода Candida. В быту эту болезнь называют молочницей .
Краткое содержание статьи — в видео:
Candida — это условно-патогенные микроорганизмы, факультативные анаэробы (организмы, способные жить как в присутствии кислорода, так и без него). Они обладают тропизмом — направлением роста на клетки богатые гликогеном, в частности клетки слизистой оболочки влагалища. Самый распространённый вид возбудителя, который встречается в 70—90 % случаев, — Candida albicans.
В последние годы растёт заболеваемость кандидозом, вызванным другими представителями рода Candida. Наиболее часто выявляются:
- С. glabrata (15 %);
- C. dubliniensis (6 %);
- C. tropicalis (3—5 %);
- C. parapsilosis (3 %);
- C. krucei (1—3 %).
Распространение новых видов микроорганизмов связано в первую очередь с бесконтрольным самолечением пациенток, приводящем к возрастающей устойчивости грибов к препаратам [3] [4] .
Частота кандидозного вагинита среди инфекционных заболеваний влагалища и вульвы составляет 30—45 %. Патология занимает второе место среди всех инфекционных заболеваний влагалища и является крайне распространённым поводом для обращения женщин за медицинской помощью. По данным J. S. Bingham (1999):
- к 25 годам около 50 % женщин репродуктивного возраста сталкивались с хотя бы одним диагностированным врачом эпизодом вагинального кандидоза;
- к началу периода менопаузы — около 75 % [17] .
Кандидозный вагинит редко наблюдается в постменопаузе, за исключением тех пациенток, которые получают гормональную заместительную терапию.
Предрасполагающими факторами заболевания являются:
- Механические — ношение синтетического белья, первый половой контакт, травматическое повреждение тканей влагалища, длительное применение внутриматочной спирали.
- Физиологические — беременность, менструация.
- Эндокринные — гипотиреоз, сахарный диабет.
- Иммунодефицитные состояния.
- Ятрогенные (приём антибиотиков, кортикостероидов, иммуносупрессоров, лучевая терапия, химиотерапия, онкологические заболевания, оральные контрацептивы).
- Прочие (авитаминоз, аллергические заболевания, хронические патологии гениталий и желудочно-кишечного тракта).
Заболевание, как правило, не передаётся половым путём, но установлено, что оно связано с характером половых контактов: анально-вагинальным и орогенитальным. Также не исключается вероятность развития кандидозного баланопостита у половых партнёров пациенток с вагинальным кандидозом.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы вагинального кандидоза
Основные симптомы при вагинальном кандидозе:
- жжение и зуд в области влагалища и вульвы;
- творожистые выделения из влагалища;
- расстройства мочеиспускания;
- боль при половом акте.
Зуд может усиливаться после водных процедур, полового акта, ночью во время сна и в период менструации [1] .
В целом симптомы вагинального кандидоза нарастают перед менструацией. При беременности проявление болезни также усугубляется, это связано со снижением иммунитета у беременных женщин.
Объективные признаки вагинального кандидоза:
- отёк и гипермия слизистой оболочки влагалища и наружных половых органов;
- белые или зеленовато-белые наложения на стенках влагалища;
- покраснение слизистой влагалища.
При осложнённом кандидозе на коже наружных половых органов появляются везикулы — пузырьки, возвышающиеся над уровнем кожи или слизистой и заполненные прозрачным или мутным содержимым, которые могут вскрываться и образовывать эрозии. При вагинальном кандидозе также могут наблюдаться трещины слизистой вульвы, задней спайки и перианальной области [2] .
Патогенез вагинального кандидоза
Грибы рода Candida относятся к условно-патогенной микрофлоре, которая присутствует как в окружающей среде, так и на поверхности кожных покровов и слизистых оболочках здорового человека (в полости рта, кишечнике, влагалище). При снижении защитных сил организма возможно повышение адгезивных свойств (способности прилипать) грибов с прикреплением их к клеткам эпителия влагалища, колонизацией слизистой оболочки и развитием воспалительной реакции [7] .
Вагинальный кандидоз зачастую затрагивает только поверхностные слои эпителия влагалища без проникновения возбудителя в более глубокие слои слизистой оболочки. Однако в редких случаях эпителиальный барьер преодолевается и происходит инвазия в подлежащую ткань с последующей гематогенной диссеминацией (распространением возбудителя инфекции из первичного очага заболевания по всему органу или организму посредством кровотока) [8] [9] .
Основные этапы патогенеза:
- Адгезия (прилипание) грибов на слизистой и колонизация.
- Инвазия (проникновение) в эпителий.
- Преодоление эпителиального барьера.
- Проникновение в соединительную ткань.
- Преодоление защитных механизмов ткани.
- Попадание в сосуды.
- Гематогенная диссеминация.
При вагинальном кандидозе воспаление происходит в верхних слоях эпителия влагалища. Причина состоит в том, что поддерживается динамическое равновесие между грибом, который не может проникнуть в более глубокие слои, и организмом, который сдерживает его распространение. Соответственно инфекция может долго развиваться в одном месте, проявляясь творожистыми выделениями из влагалища. Обострение заболевания происходит при сдвиге равновесия между развитием грибов и защитными силами организма.
Классификация и стадии развития вагинального кандидоза
Согласно национальным клиническим рекомендациям [18] , выделяют две формы вагинального кандидоза:
- острую — до трёх обострений в год;
- хроническую (рецидивирующую) — не менее четырёх обострений в год.
По классификации, предложенной D.A. Eschenbach, вагинальный кандидоз подразделяют на два типа:
У женщин различают три формы заболевания:
- вагинит (воспаление влагалища); (воспаление влагалища и вульвы); (воспаление шейки матки).
У мужчин выделяют:
- баланит (воспаление головки полового члена);
- баланопостит (воспаление крайней плоти и головки полового члена); (воспаление мочеиспускательного канала).
Для острой формы вагинального кандидоза характерны выраженные симптомы: обильные выделения из влагалища, жжение и зуд во влагалище и наружных половых органах. На фоне таких симптомов нередко снижается трудоспособность пациентки и развиваются неврозы. Острая форма вагинального кандидоза встречается наиболее часто и формируется в результате увеличения количества грибов рода Candida во влагалище на фоне снижения иммунитета пациентки.
Рецидивирующий вагинальный кандидоз — встречается у 10—15 % женщин репродуктивного возраста и проявляется четырьмя и более обострениями за год [11] .
Неосложнённая форма заболевания предполагает впервые выявленный или возникающий менее четырёх раз в год вагинальный кандидоз с умеренными проявлениями вагинита у пациенток без сопутствующих факторов риска (сахарный диабет, приём глюкокортикоидов, цитостатиков и др.).
При осложнённом вагинальном кандидозе наблюдаются яркие объективные симптомы: покраснение, отёк, образование язв, трещин слизистых оболочек и кожи перианальной области. Также характерны рецидивы четыре и более раз в год. Заболевание часто возникает на фоне сахарного диабета, ВИЧ-инфекции, терапии глюкокортикоидами и цитостатиками. Возбудителем заболевания в данном случае являются как C. albicans, так и другие грибы рода Candida.
Осложнения вагинального кандидоза
К осложнениям вагинального кандидоза у женщин относятся:
- стеноз влагалища;
- воспалительные патологии органов малого таза — сальпингит, оофорит и другие;
- заболевания мочевыделительной системы — цистит, уретрит[2] .
Стеноз влагалища развивается при воспалении стенок влагалища. При этом просвет влагалища сужается, а стенки влагалища становятся плохо растяжимы. Пациентки испытывают боль при половом акте.
Сальпингит — инфекционно-воспалительное заболевание фаллопиевой (маточной) трубы. Возникает при переходе инфекции восходящим путем из влагалища, не исключен также и гематогенный путь передачи. Сальпингит чаще всего протекает в сочетании с оофоритом — воспалением яичника. Поражение может быть как односторонним, так и двусторонним. Пациентки испытывают боль в области придатков, внизу живота слева или справа, повышается температура тела, возникает общее недомогание, слабость, а иногда и тошнота со рвотой. При несвоевременном лечении данного осложнения высок риск бесплодия, наступления внематочной беременности, возникновения спаечного процесса, приводящего к оперативному вмешательству, инфицированию органов брюшины и малого таза. Сальпингит особенно опасен в случаях, когда с кандидозом сочетаются другие инфекции [1] .
Уретрит — воспаление слизистой мочеиспускательного канала. Проявляется болезненным мочеиспусканием, чувством жжения в области уретры, выделением с мочой крови или гноя, дискомфортом при соприкосновении с бельём, слипанием краёв уретры, покраснением области вокруг мочеиспускательного канала.
Цистит — воспаление мочевого пузыря. Патология возникает при попадании возбудителя восходящим путём через уретру в мочевой пузырь. Симптомы цистита схожи с симптомами уретрита, однако есть некоторые отличия: частые позывы к мочеиспусканию при небольшом количестве мочи, чувство неполного опорожнения мочевого пузыря, боль, резь в конце мочеиспускания, помутнение мочи, повышение температуры тела, боли внизу живота.
На фоне вагинального кандидоза возрастает частота осложнений при беременности, а также увеличивается риск инфицирования плода.
Кандидоз плода может вызвать его внутриутробную гибель или приводить к преждевременным родам. После родов у женщин возможно развитие кандидозного эндометрита — воспалительного процесса в тканях, выстилающих внутреннюю полость матки.
Диагностика вагинального кандидоза
Диагностика вагинального кандидоза основывается на характерных жалобах пациентки, данных анамнеза, клинических проявлениях, выявленных при гинекологическом осмотре. В зеркалах видна гиперемия, отёк слизистой, белые налёты на стенках влагалища.
Независимо от этих признаков, подтверждение диагноза должно основываться на лабораторных данных:
- Микроскопия мазков вагинального отделяемого — позволяет выявить споры и мицелий гриба.
- Культуральный метод — посев влагалищного содержимого на искусственные питательные среды. Метод определяет количество, видовую принадлежность, чувствительность к противогрибковым препаратам, а также характер и степень заселения другими микроорганизмами. Культуральный метод дополняет микроскопию.
- Серологическая диагностика (РСК). Определяет антитела против антигенов грибов рода Candida. Такая диагностика имеет значение при генерализации процесса.
- Молекулярно-биологические методы. Направлены на обнаружение специфических фрагментов ДНК Candida spp. Применяют метод полимеразной цепной реакции (ПЦР).
- Иммунофлюоресцентная диагностика (Candida Sure Test) проводится в случае рецидивирующего течения вагинального кандидоза [15] .
К дополнительным методам диагностики относятся: изучение микробиоценоза кишечника, обследование на инфекции, передаваемые половым путём, внутривенный тест на толерантность к глюкозе [16] .
Дифференциальную диагностику проводят со следующими заболеваниями:
- генитальным герпесом; ;
- аэробным вагинитом;
- кожными заболеваниями (экземой, красным плоским лишаём, склеродермией, болезнью Бехчета и др.).
Лечение вагинального кандидоза
Показаниями к назначению терапии вагинального кандидоза являются жалобы пациентки, клинические проявления и лабораторное подтверждение наличия грибов рода Candida. Лечение не требуется при обнаружении грибов без каких-либо клинических проявлений (кандидозоносительство). Это правило обусловлено тем, что грибы рода Candida могут содержаться в небольшом количестве во влагалище и являются частью нормальной микрофлоры, если их количество не превышает пороговое значение 10 4 .
Механизм действия противогрибковых препаратов — нарушение синтеза эргостерола (вещества в составе клеточных мембран грибов), что приводит к образованию дефектов в мембране микроорганизма. В зависимости от дозы антимикотики проявляют фунгистатическое (замедление роста) или фунгицидное (полное уничтожение) действие [15] .
Существуют различные группы препаратов для лечения вагинального кандидоза:
- антибиотики (пимафуцин, амфотерицин В, нистатин, леворин);
- имидазолы (клотримазол, сертаконазол, кетоконазол, гино-певарил, миконазол);
- триазолы (итраконазол, флуконазол);
- комбинированные препараты ("Тержинан", "Полижинакс", "Пимафукорт", "Клион Д", "Макмирор комплекс");
- препараты разных групп (флуцитозин, гризеофульвин, дафнеджин, нитрофунгин, йодат поливинилпирролидон).
Лечение подбирается гинекологом индивидуально для каждой пациентки, учитывая клиническую картину, форму заболевания и степень выраженности симптомов. Но важно отметить, что при лечении молочницы при беременности флуконазол противопоказан, так как он может негативно повлиять на развитие плода [19] [20] .
При лечении острых форм вагинального кандидоза назначают местное лечение. Препарат не всасывается в системный кровоток, а действует в области влагалища и слизистой. Примеры схем лечения:
-
150 мг в виде вагинальных свечей один раз в сутки в течение трёх дней; один аппликатор крема на ночь вагинально в течение трёх дней; одна свеча на ночь один раз в сутки в течение восьми дней; одна таблетка на ночь в течение 10 дней.
При хроническом кандидозе наряду с местным лечением применяют системные антимикотики:
-
150 мг один раз внутрь; 200 мг внутрь два раза с интервалом 12 часов в течение одного дня или 200 мг в сутки в течение трёх дней.
При рецидивирующей форме заболевания (более четырёх эпизодов в год) применяют схему:
-
150 мг внутрь три раза с интервалом 72 часа в 1,4 и 7 день лечения.
Для купирования рецидивов препарат применяют в дозировке 150 мг один раз в неделю в течение шести месяцев.
В последние годы всё больше исследуется способность C. albicans формировать биоплёнки — вещества на поверхности колонии микроорганизмов, которые служат барьером для проникновения лекарственных средств и обеспечивают выживание. Основным полисахаридом, определяющим развитие резистентности к антибиотикам, является глюкан. Его рассматривают как одну из причин формирования резистентности к антимикотическим препаратам. Этим объясняется отсутствие эффекта при лечении у некоторых больных. Таким пациенткам можно порекомендовать препарат фентиконазол 600 мг в сутки с интервалом в три дня. Лекарство отличается от других способностью преодолевать биоплёнки, тем самым повышая эффективность лечения при резистентности к другим препаратам.
Прогноз. Профилактика
При своевременном обращении пациентки к врачу, лабораторном обследовании и отсутствии самолечения прогноз благоприятный. Самолечение опасно из-за риска рецидива заболевания, его хронизации и возникновения резистентности к препарату, неверно выбранному пациенткой или при неадекватной дозе.
Чтобы повысить эффективность терапии пациентки должны следовать схеме лечения, индивидуально назначенной гинекологом. Во время лечения и диспансерного наблюдения необходимо соблюдать половой покой или применять барьерные методы контрацепции. Повторно обратиться к врачу для контроля анализов следует через 7-10 дней [12] .
Что такое папилломавирусная инфекция (ВПЧ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Борисова Э. В., гинеколога со стажем в 35 лет.
Над статьей доктора Борисова Э. В. работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Папилломавирусная инфекция — это состояние, развивающееся при заражении какой-либо разновидностью вируса папилломы человека (ВПЧ). Возбудители данной группы могут существовать только в человеческом организме, поражая кожу и слизистые оболочки, приводя к появлению папиллом, бородавок, плоских и остроконечных кондилом. [1] [2] [4]
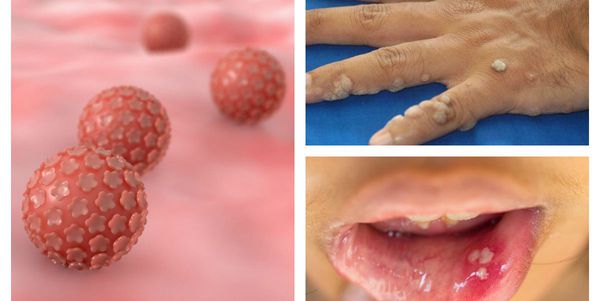
ВПЧ довольно широко распространён в человеческой популяции, особенно среди сексуально активных людей, а это свыше 80% всего населения. До недавнего времени вирусы этой группы считались относительно безобидными, вызывающими лишь косметические дефекты, но последние научные исследования показывают, что проблема гораздо серьёзнее. [9]
На сегодняшний день науке известно несколько сотен штаммов (типов) папилломавирусов . Около 40 из них преимущественно поражают аногенитальную область и передаются половым путём. Особую опасность представляют штаммы высокого онкогенного риска, так как они могут спровоцировать развитие онкологических заболеваний, в том числе рака шейки матки.
Чаще всего заражение происходит в молодом возрасте, как правило, с началом половой жизни, при этом возможно неоднократное инфицирование. Наиболее уязвимой группой в плане вероятности заражения ВПЧ и развития неблагоприятных последствий являются молодые женщины в возрасте 15-30 лет.
Помимо этого ВПЧ может перейти от инфицированной матери к ребёнку, например, при родах. Не исключается и контактно-бытовой способ передачи возбудителя, например, при соприкосновениях и даже при совместном использовании предметов личной гигиены.
К факторам риска, способствующим заражению ВПЧ, развитию хронической папилломавирусной инфекции и её переходу в предраковые состояния с потенциальным перерождением в злокачественную опухоль, относятся:
- иммунодефицит любого происхождения, в том числе вследствие ВИЧ-инфекции, лучевых поражений, применения иммунодепрессантов при трансплантации органов и тканей, лечения цитостатиками и других причин;
- подавленное состояние иммунитета во время беременности;
- раннее начало половой жизни;
- частая смена половых партнёров, незащищённый секс;
- инфицированность высокоонкогенными штаммами ВПЧ;
- заражение одновременно несколькими типами ВПЧ;
- наличие других инфекций, передающихся половым путём, например, герпесвирусной и цитомегаловирусной инфекции, вируса Эпштейна — Барр, гепатитов В и С, гонореи и трихомониаза;
- стресс, истощение, гиповитаминоз, гормональный дисбаланс;
- многократные роды и аборты;
- тяжёлые хронические заболевания, в том числе сахарный диабет;
- вредные привычки (курение, злоупотребление спиртным);
- низкий социальный статус, плохие условия жизни, неудовлетворительная интимная гигиена;
- пренебрежение регулярными профилактическими обследованиями (один из важнейших факторов риска);
- низкий уровень развития медицины в регионе проживания.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы папилломавирусной инфекции
Далеко не всегда человек догадывается о наличии в своём организме папилломавирусной инфекции, оставаясь при этом источником заражения для потенциальных партнёров. [1] [2] Дело в том, что заболевание может долгое время протекать бессимптомно: вирус скрыто существует в организме от нескольких месяцев до нескольких лет, никак себя не проявляя. Кроме того, уже имеющиеся проявления инфекции не всегда доступны для наружного обзора. Например, если папилломы, бородавки и кондиломы на открытых участках тела и поверхности гениталий ещё можно заметить самостоятельно, то патологические изменения, локализующиеся на шейке матки, сможет обнаружить только специалист в ходе осмотра с применением соответствующих инструментов.
И всё же существует несколько симптомов, которые прямо или косвенно могут указывать на наличие папилломавирусной инфекции и её неблагоприятных последствий. [3] К ним относятся:
- появление на коже и/или слизистых оболочках каких-либо разрастаний различных форм (на тонкой ножке или с широким основанием, нитевидной, округлой или плоской конфигурации, в форме цветной капусты или петушиного гребня) и размеров (от образований в несколько миллиметров до разрастаний, занимающих всю промежность);
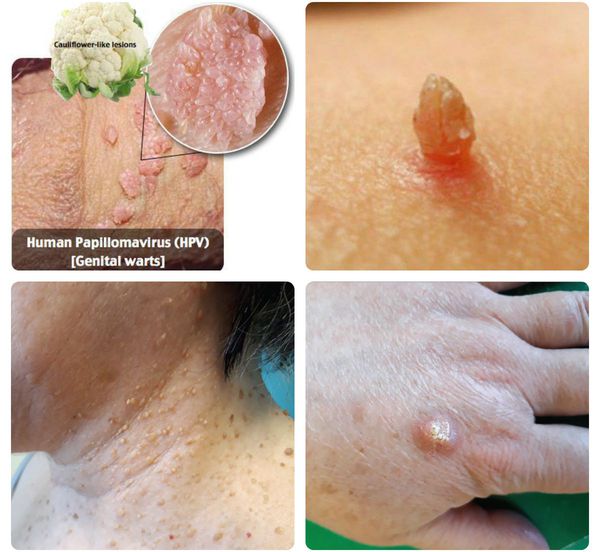
- отёчность и воспалительная инфильтрация папилломатозных разрастаний (остроконечных кондилом), их ранимость и кровоточивость, что приводит к присоединению вторичной инфекции с появлением гнойного отделяемого с неприятным запахом;
- зуд, жжение, мокнутие в области промежности, появление обильных белей, даже при отсутствии видимых патологических образований;
- межменструальные кровянистые выделения, в том числе появляющиеся в результате полового контакта:
- дискомфорт во время полового акта.
Наиболее тревожными признаками заболевания являются:
- постоянные боли в области спины и таза;
- слабость;
- беспричинная потеря веса;
- опухание одной или обеих ног.
Патогенез папилломавирусной инфекции
Заражение папилломавирусной инфекцией происходит при попадании вирусных частиц на кожу или слизистую оболочку. [1] [2] Излюбленная локализация инфекции на теле женщины — промежность, большие и малые половые губы, вульва, влагалище и шейка матки, у мужчин — половой член. Может также произойти поражение слизистой полости рта, пищевода, мочевого пузыря, трахеи, конъюнктивы и других органов и тканей.
Заражению способствуют микротравмы и потёртости. Особенно благоприятные для инфицирования условия создаются при половом акте. В 60–80% случаев достаточно однократного сексуального контакта с больным папилломавирусной инфекцией или бессимптомным носителем ВПЧ. К развитию заболевания может привести попадание в организм буквально единичных вирусных частиц.
При наличии предрасполагающих факторов (микроповреждения, слабого иммунитета и других) возбудитель проникает в эпителиальную ткань до её базального слоя. Там он прикрепляется к оболочке незрелой клетки и внедряется сначала в её цитоплазму, а затем и в ядро, где повреждает генетический аппарат. После этого начинается деление клеток с изменённым геномом, что приводит к появлению в месте внедрения вируса генитальных кондилом (образований, которые постепенно разрастаются), а, например, на шейке матки — к развитию диспластических процессов различной степени тяжести (дисплазия шейки матки).
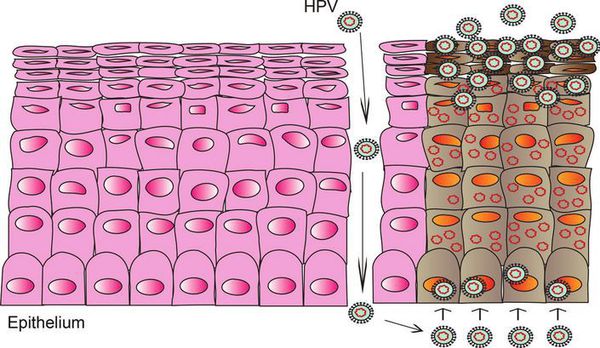
В случае ВПЧ высокого онкогенного риска определённые гены в вирусной ДНК кодируют синтез специфических белков-онкопротеинов (Е6 и Е7), которые подавляют противораковую защиту клеток. Под действием онкопротеинов нарушается стабильность генома клеток, стимулируется их размножение и снижается способность к дифференцировке — всё это со временем может привести к онкопатологии. [12]
Формирование новых полноценных вирусных частиц, способных инфицировать другого человека, происходит уже не в базальном, а в самых поверхностных слоях поражённого эпителия. Возбудитель может содержаться в слущивающихся отмирающих клетках, которые отделаются слизистой оболочкой. Таким образом они переходят к новому хозяину при тесном (сексуальном или бытовом) контакте.
Классификация и стадии развития папилломавирусной инфекции
По способности индуцировать развитие злокачественных новообразований ВПЧ подразделяют на четыре группы: [8]
- неонкогенные штаммы ВПЧ (типы 1-5);
- ВПЧ низкого онкогенного риска (типы 6, 11, 40, 42-44, 54, 61, 70, 72, 81);
- ВПЧ среднего онкогенного риска (типы 26, 31, 33, 35, 51-53, 58, 66);
- ВПЧ высокого онкогенного риска (типы 16, 18, 39, 45, 56, 59, 68, 73, 82).
Клинические формы папилломавирусной инфекции: [5]
- латентная — скрытая форма, не имеющая клинических и морфологических признаков, но обнаруживаемая иммунохимическими и молекулярно-биологическими методами;
- субклиническая — возникает у лиц с нормальным иммунитетом, определяется только специальными диагностическими методами (пробы с растворами-индикаторами, гистологические и цитологические исследования);
- манифестная — появляется у лиц с временным или стойким снижением иммунитета, в случае генитальной папилломавирусной инфекции характеризуется появлением кондилом.
Латентная инфекция может переходить в субклиническую и манифестную форму в случае возникновения предрасполагающих условий (факторов риска), но чаще всего она протекает бессимптомно, не манифестируя.
Клинические проявления папилломавирусной инфекции:
- кожные поражения: подошвенные, плоские и обычные (вульгарные) бородавки, бородавчатая эпидермодисплазия, бородавки Бютчера и небородавчатые поражения кожи;
- поражения слизистых оболочек гениталий: кондиломы, некондиломатозные поражения, карциномы;
- поражения слизистых вне гениталий: папилломатоз гортани, карциномы шеи, языка и другое.
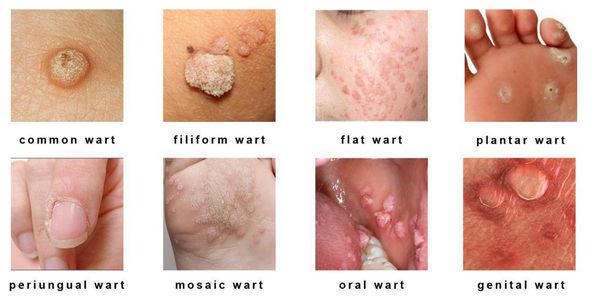
Разновидности поражений:
- экзофитные — видимые разрастания в виде папиллом и бородавок;
- эндофитные — образования, располагающиеся в толще ткани, которые не видны невооружённым глазом.
Осложнения папилломавирусной инфекции
Основными наиболее опасными осложнениями папилломавирусной инфекции являются злокачественные новообразования. Но возможны и другие серьёзные последствия:
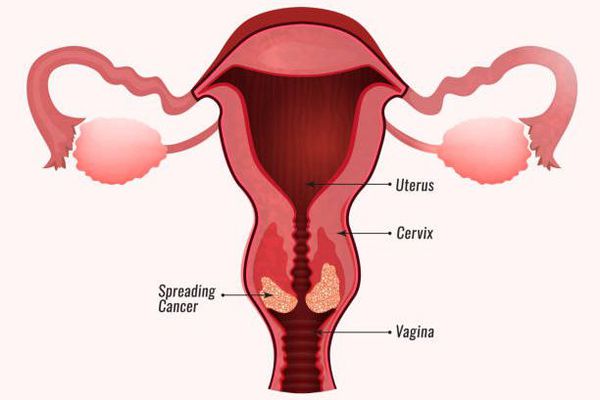
- Злокачественные новообразования заднего прохода, вульвы, полового члена и ротоглотки. Повышение риска их развития также связывают с высокоонкогенными штаммами ВПЧ. [6]
- Остроконечные кондиломы на гениталиях, папилломатоз верхних дыхательных путей (рецидивирующий респираторный папилломатоз, веррукозный ларингит). Причиной возникновения могут стать 6-й и 11-й типы вируса, несмотря на свой низкий онкогенный риск. В случае папилломатоза есть вероятность полной потери голоса, обструкции (перекрытия) гортани с развитием асфиксии. Это довольно редкое заболевание может возникать у детей, рождённых женщинами с папилломавирусной инфекцией. По разным данным, заражение может происходить как во время родов, так и внутриутробно. Как правило, респираторный папилломатоз начинает проявляться в детском и подростковом возрасте, он склонен к неоднократным рецидивам после удаления множественных папиллом, перекрывающих дыхательные пути.
- Гнойно-септические осложнения. Папилломатозные разрастания на слизистых оболочках очень ранимы, легко травмируются, и через участки мокнутия, расчёсов и потёртостей может проникать вторичная инфекция, которая в свою очередь и вызывает нагноение.
Диагностика папилломавирусной инфекции
Основные цели диагностических мероприятий: [3]
- ранняя диагностика папилломавирусной инфекции для динамического наблюдения и лечения;
- своевременное обнаружение и лечение предраковых изменений, что позволяет на 80% предотвратить развитие злокачественных новообразований;
- выявление онкологических новообразований на ранних стадиях, что в большинстве случаев даёт хороший прогноз эффективного излечения;
- решение вопроса о целесообразности вакцинации.
Для выявления папилломавирусной инфекции на сегодняшний день существует целый комплекс диагностических процедур:
- Гинекологический осмотр в зеркалах — позволяет увидеть папилломатозные разрастания (аногенитальные кондиломы) и другие изменения.
- Классический тест Папаниколау (мазки с поверхности шейки матки и стенок влагалища для цитологического исследования) — обнаруживает ранние признаки дисплазии и злокачественного перерождения.
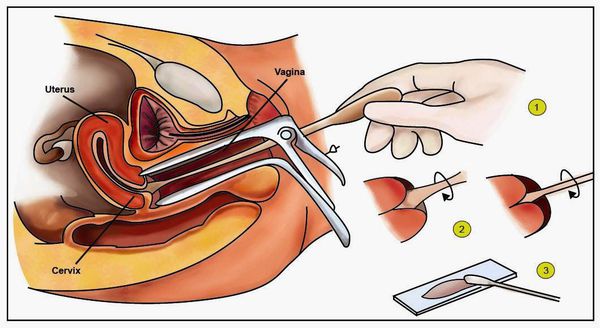
- Пробы с уксусной кислотой и раствором Люголя — выявляют участки поражения слизистой шейки матки.
- Кольпоскопия, в том числе с биопсией подозрительных участков и их гистологическим исследованием, — определяет характер имеющегося новообразования.
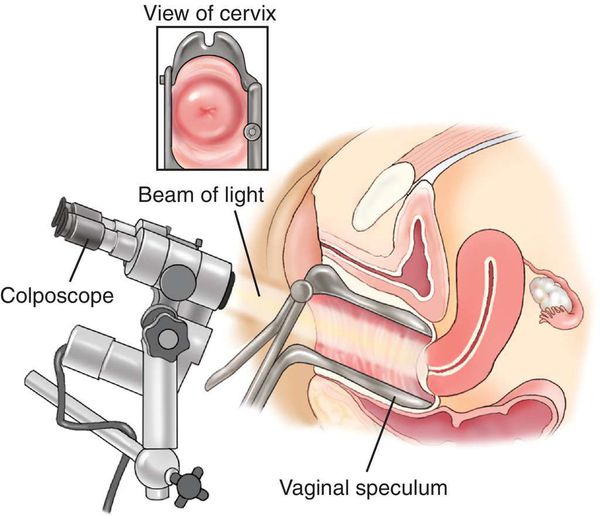
- Иммунофлюоресцентный анализ (ИФА) обнаруживает в цервикальном соскобе онкопротеины (Е7 и Е6). Этот метод достаточно новый, с его помощью можно различить носительство ВПЧ и первые признаки злокачественного перерождения в клетках, [12] оценить агрессивность данного процесса, сделать предположения относительно прогноза заболевания.
- Полимеразная цепная реакция (ПЦР) находит вирусную ДНК в биологическом материале (соскоб со слизистой), определяет тип ВПЧ, степень его онкогенности, а также количество вирусных частиц, что косвенно позволяет судить о характере течения папилломавирусной инфекции у данного пациента, возможности спонтанного излечения или высокого риска прогрессирования. Обнаружение ВПЧ с помощью этого возможно даже при латентном течении болезни, когда цитологические и гистологические методы не эффективны.
Целесообразно дополнительное обследование пациента на наличие других инфекций, передающихся половым путём, так как папилломавирус в 90% случаев с ними сочетается, и это может осложнять течение заболевания.
Лечение папилломавирусной инфекции
Лечение папилломавирусной инфекции должно быть комплексным и включать следующие составляющие: [3] [5]
- деструкцию (удаление) видимых проявлений (аногенитальных кондилом и др.);
- иммуномодулирующую терапию;
- противовирусную терапию;
- лечение сопутствующих инфекций, передающихся половым путём.
Деструктивные методы делятся на две основные группы:
- химические — с применением трихлоруксусной кислоты, а также таких препаратов, как "Солкодерм", "Колломак", "Ферезол" и др.;
- физические — хирургическое удаление, электрокоагуляция, криодеструкция, радиоволновая и плазменная коагуляция, лазеротерапия.
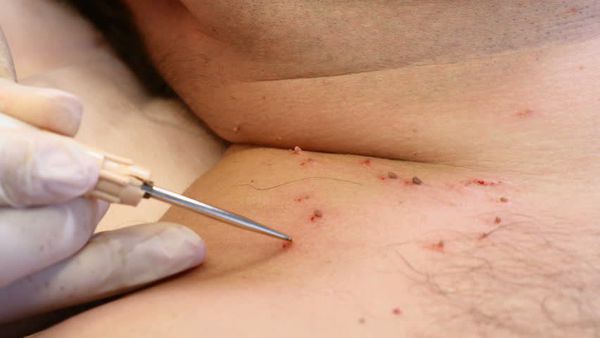
Лечение сопутствующих половых инфекций проводят до начала деструктивной терапии на фоне адекватной иммунокоррекции.
Удаление видимых проявлений папилломавирусной инфекции должно сочетаться с противовирусной терапией — как с общей, так и с применением препаратов местного действия после удаления кондилом.
Следует помнить, что успешно проведённое лечение не исключает развитие рецидивов в дальнейшем, особенно у пациентов с нарушениями иммунитета. Поэтому за ними устанавливается динамическое наблюдение в течение как минимум 1-2 лет.
Прогноз. Профилактика
В 90% случаев здоровая иммунная система человека справляется с папилломавирусной инфекцией самостоятельно за период от полугода до двух лет с момента инфицирования, после чего происходит полное выздоровление с исчезновением вируса из организма. При этом не формируется напряжённого пожизненного иммунитета, то есть человек может заразиться повторно.
В других случаях, при наличии предрасполагающих факторов, заболевание приобретает хроническую форму, склонную к длительному скрытому течению с периодическими рецидивами и возможным развитием тяжёлых осложнений.
От момента попадания вируса в организм до развития предраковых состояний и тем более возникновения рака может пройти достаточно много времени, иногда десятки лет. Поэтому регулярные профилактические обследования, своевременное выявление и лечение предраковых состояний — вполне реальный и эффективный способ избежать самого неблагоприятного варианта развития событий. [13] С этой целью Всемирная организация здравоохранения рекомендует всем женщинам старше 30 лет при первичном скрининге проходить не только “рутинное” цитологическое исследование, но и делать тест на наличие ВПЧ. [10]
Регулярное посещение гинеколога (при отсутствии каких-либо жалоб — раз в год) с проведением теста Папаниколау позволяет своевременно обнаружить начальные признаки дисплазии и предпринять все необходимые меры для предотвращения прогрессирования процесса и его перехода в онкологическое заболевание.
Использование методов барьерной контрацепции хоть и не полностью защищает от инфицирования, но несколько снижает его вероятность.
Главным методом первичной профилактики папилломавирусной инфекции считается вакцинация. [11] Современные вакцины разработаны с целью защиты от наиболее опасных, высокоонкогенных штаммов ВПЧ, ответственных за 70-80% случаев развития рака шейки матки. Стандартный курс, состоящий из трёх прививок, даёт вполне надёжную защиту.
При наличии герпетической инфекции следует проводить адекватную терапию с учетом характера поражения (локальная, генерализованная форма), первичного или рецидивирующего течения заболевания.
- купирование клинических симптомов, ускорение разрешения клинических проявлений, уменьшение площади поражения, снижение общей интоксикации;
- предупреждение развития острого процесса или рецидива,
- уменьшение частоты рецидивов, укорочение их длительности, увеличение временного периода между рецидивами заболевания, а также облегчение их течения;
- улучшение качества жизни пациентов;
- предупреждение развития осложнений;
- предупреждение дальнейшего распространения возбудителя, снижение риска инфицирования полового партнера или новорожденного.
Половые партнеры пациентов с герпетической инфекцией (ГИ) урогенитального тракта подлежат активному выявлению. Лечение необходимо прово дить у них при клинических проявлениях герпеса. Следует рекомендовать воздерживаться от половой жизни или использовать презервативы во время обострений. Лечение должно проводиться с учетом образа жизни и потребности в подавлении, связанной с влиянием физических и психосоциальных факторов.
Важно при этом учитывать, что достижение положительного результата при лечении генитального герпеса (ГГ) сопряжено с рядом сложностей. Полная элиминация возбудителя – вируса простого герпеса (ВПГ) – невозможна. Несмотря на достигнутые успехи в лечении ГГ, существующие методы не обеспечивают полной элиминации вирусов из организма.
Методы лечения герпетической инфекции
- применяют эффективные противовирусные химиопрепараты
- применяют средства, повышающие специфическую и неспецифическую резистентность организма (интерферон и его индукторы, иммуномодуляторы, вакцины);
- проводят серотерапию и серопрофилактику (лечение и профилактику иммунными сыворотками) с использованием специфических иммуноглобулинов человека или иммунизированных животных;
- применяют местные и антисептические средства для купирования кожно-слизистых поражений.
Противовирусная терапия генитального герпеса
- лечение первичного эпизода ГГ;
- эпизодическая противовирусная терапия (для купирования каждого отдельного эпизода обострения ГИ);
- профилактическая (превентивная или супрессивная) терапия (непрерывное лечение на протяжении определенного времени для предупреждения рецидивов и предотвращения передачи инфекции другим лицам).
Существует ряд противовирусных препаратов, способные быстро и эффективно купировать острые проявления генитального герпеса. В адекватной дозировке большинство этих препаратов одинаково эффективно уменьшают тяжесть и продолжительность обострений генитального герпеса. Однако клинический опыт их применения показал, что, облегчая выраженность симптомов болезни, они не предотвращают наступление рецидивов и, в большинстве случаев, не снижают их частоту.
Профилактическая (супрессивная) противовирусная терапия
В многочисленных исследованиях показано, что продолжительная профилактическая терапия противовирусными препаратами значительно уменьшает бессимптомное и субклиническое (в продромальный период) выделение вируса.
Изученные в настоящее время иммунопатогенетические особенности рецидивирующей герпетической инфекции убедительно указывают на нарушения клеточного иммунного ответа у данной категории больных. При герпесе развиваются иммунодефицитные состояния, обусловленные недостаточностью различных звеньев иммунной системы. Чтобы добиться нормализации иммунологических показателей у больных с данной патологией, необходимо продолжать лечение и в межрецидивный период для коррекции остаточных иммунологических нарушений.
Важным благоприятным эффектом профилактической терапии является снижение психологического давления на пациентов.
Вакцина от герпеса
Вакцино-профилактика ГГ находится в стадии научных и экспериментальных разработок. До настоящего времени не получено ни одной эффективной профилактической вакцины против ВПГ. Природа ВПГ-инфекции, заключающаяся в локальном поражении с последующим латентным периодом без системной вирусемии, приводит к тому, что даже успешная выработка специфических антител не предохраняет от последующего рецидива.
Разработанные вакцины (живые, убитые и рекомбинантные) не нашли широкого применения из-за отсутствия надежных методов оценки эффективности курсов вакцинации, критериев продолжительности вакцинации и дальнейшей реабилитации больных.
Генитальный герпес можно и нужно лечить
Лечение генитального герпеса - это многоплановая задача, сложный и длительный процесс. Правильное лечение и назначение лекарственных средств может проводиться только квалифицированным специалистом с учетом проведенной диагностики и истории болезни. Для каждого пациента терапия должна подбираться индивидуально. При тяжелом течении заболевания показано лечение в стационаре.
Результат лечения в значительной мере зависит от опыта врача, а также от терпения и тщательного выполнения пациентом рекомендаций врача. Существующий сегодня арсенал противовирусных и иммунных препаратов позволяет решить очень многие проблемы, возникающие у лиц, страдающих рецидивирующими формами ГГ с поражением гениталий, ягодиц и другими более редкими локализациями. Раннее начало лечения имеет большое значение для получения значительного противовирусного эффекта.

Генитальный герпес (ГГ) у мужчин выявляют в несколько раз реже, чем у женщин; кроме того, инфекция у них часто протекает в малосимптомной или бессимптомной форме. Поэтому истинная роль вируса простого герпеса (ВПГ) в развитии патологии органов мужской мочеполовой системы (МПС) часто недооценивается. Однако, у мужчин, страдающих хроническими воспалительными заболеваниями органов малого таза, в 50-60% случаев удается выявить ВПГ в отделяемом мочеполовой системой.
ВПГ может являться причиной затянувшихся уретритов, протекающих без явных симптомов, рецидивирующих циститов, а также обострения хронических простатитов.
Инфицирование гениталий происходит при тесном физическом контакте с больным или вирусоносителем при генитальном, оро-генитальном, ректальном и орально-анальном контактах. В большинстве случаев первичное инфицирование протекает бессимтомно. В дальнейшем формируется носительство вируса простого герпеса (ВПГ) или рецидивирующая форма заболевания. Частота рецидивов у мужчин и женщин одинакова, однако у мужчин они более длительны.
Многообразие клинических проявлений урогенитального герпеса, наличие атипичных, субклинической и бессимптомной форм болезни, вовлечение в инфекционный процесс многих систем организма нередко мешают дифферинцировать это заболевание от других инфекций мочеполовой системы.
Предположить герпетическую природу поражения урогенитального тракта при отсутствии типичных проявлений на коже и слизистых оболочках позволяют жалобы на зуд, жжение, скудные слизистые выделения из уретры, сукровичные выделения из прямой кишки, указания на болевой синдром. Также признаком вирусного герпеса может служить рецидивирующий характер заболевания органов малого таза (ОМТ) или резистентность заболевания к ранее проводимой терапии антибиотиками.
Кроме того, больные часто отмечают склонность к простудным заболеваниям, боязнь сквозняков, периодически возникающую общую слабость, недомогание, субфебрильную температуру, депрессивные состояния. У больных ГГ нередко встречаются болевые ощущения, которые пациенты не всегда связывают с обострениями герпеса.
Герпес наружных гениталий у мужчин
Клинически герпес наружных половых органов может протекать в типичной, атипичной и субклинической (малосимптомной) формах. Манифестной или типичной называется форма заболевания, при которой инфекционный процесс протекает с клиническими проявлениями.
Считается, что атипичная и бессимптомная (нераспознанная) форма герпеса связаны с изменениями в вирусном геноме и более опасны, т.к. бессимптомные вирусоносители являются основным источником заболевания в популяции. Отсутствующие или слабовыраженные симптомы не мешают им вступать в половые контакты, что способствует заражению ими партнера в наиболее контагиозный период заболевания.
- половой член (поражается область наружного и внутреннего листков крайней плоти, венечной борозды, ладьевидной ямки, реже головка и ствол полового члена)
- мошонку,
- кожу лобковой области,
- промежность,
- бедра,
- ягодицы,
- перианальную область
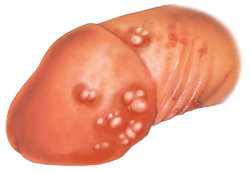
- Гиперемия и отечность кожных покровов и слизистых оболочек в области поражения.
- Единичные или множественные везикулезные элементы (пузырьки), локализующиеся в области поражения.
- После вскрытия везикулезных элементов образуются небольшие изъязвления, заживающие в течение несколько дней. При присоединении вторичной инфекции отмечается появление гнойников;
- Иногда возникает увеличение и болезненность паховых лимфатических узлов.
- Ухудшение общего состояния (головная боль, озноб, недомогание, субфебрильная температура);
- Зуд, жжение, саднение, боль в области поражения;
- Болезненность во время половых контактов;
- При локализации высыпаний в области уретры - зуд, жжение, болезненность при мочеиспускании (дизурия).
При манифестной форме заболевания у мужчин, развитие выраженных клинических проявлений (клиническая манифестация) часто протекает более доброкачественно, чем у женщин.
Герпес уретры (герпетический уретрит)
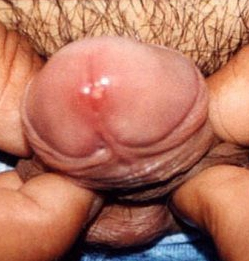
Герпетический уретрит (ГУ) — это уретрит, вызываемый вирусом простого герпеса. Работы последних лет показали, что герпетические уретриты выявляются в 42 – 46% случаев у мужчин, страдающих рецидивирующим генитальным герпесом.
Вирус простого герпеса 1-го и 2-го типов в уретре обнаруживают более чем у 1/3 мужчин с уретритами, возникшими после незащищенных орально-генитальных контактов. Вирусные уретриты у мужчин, развившиеся как результат проникающего орального секса, характеризуются достоверно более частой ассоциацией с ВПГ 1-го типа.
При герпетическом уретрите доминируют общие симптомы и выявляются как генитальные, так и экстрагенитальные проявления инфекции.
Субъективно герпес уретры проявляется болями в виде жжения, ощущения жара, обостренной чувствительностью по ходу уретры в состоянии покоя и при мочеиспускании, резями в начале мочеиспускания.
Инкубационный период в развитии ГУ остается неясным, но, вероятно, составляет несколько месяцев, реже – недель или дней.
При клиническом обследовании определяется гиперемия и отечность губок уретры, периодически появляется скудное слизистое отделяемое из наружного отверстия уретры.
Течение ГУ подострое или вялое с периодическими ремиссиями и рецидивами. В отделяемом уретры обычно преобладают эпителиальные клетки и слизь, периодически появляется лейкоцитоз. При смешанной инфекции отделяемое уретры становится более обильным, непрозрачным. При двухстаканной пробе моча в первой порции прозрачная, но содержит продукты воспаления в виде плавающих нитей и хлопьев.
Диагноз ГУ ставится на основании выделения ВПГ из материала, взятого из отделяемого уретры в культуре клеток или выявления антигена ВПГ методом ПЦР. Такого рода лабораторные исследования необходимы, чтобы дифференцировать вирусные уретриты от бактериальных.
Органы МПС у мужчин взаимосвязаны анатомически и физиологически, поэтому результаты лабораторного исследование необходимо оценивать комплексно. Так, например, если в моче или отделяемом уретры выявлен ВПГ, это позволяет предположить, что в инфекционный процесс вовлечена предстательная железа, даже если ВПГ в соке простаты не обнаружен, но имеются клинические данные о длительно протекающем простатите.
Герпес мочевого пузыря (герпетический цистит)
Ведущими симптомами герпетического цистита являются появление болей в конце мочеиспускания, дизурические явления и гематурия (кровь в моче). У больных отмечается расстройство мочеиспускания: изменяются частота, характер струи, количество мочи. Герпетический цистит у мужчин, как правило, вторичен и развивается, как осложнение при обострении хронического герпетического уретрита или простатита.
Герпес анальной области и прямой кишки
Герпетическое поражение анальной области встречается как у гетеросексуальных мужчин, так и у гомосексуалистов. Очаг поражения обычно представляет собой рецидивирующую трещину.
При поражении сфинктера и слизистой оболочки ампулы прямой кишки (герпетический проктит) больных беспокоят зуд, чувство жжения и болезненность в очаге поражения, возникают мелкие эрозии в виде поверхностных трещин с фиксированной локализацией, кровоточащие при дефекации. Появление высыпаний может сопровождаться резкими распирающими болями в области сигмы, метеоризмом и тенезмами, что является симптомами раздражения тазового нервного сплетения. Поставить диагноз герпетического проктита можно только на основании результатов вирусологического обследования больного.
Герпес простаты (герпетический простатит)
В современной классификации простатитов вирусные простатиты расцениваются как инфекционные осложнения вирусных уретритов. В клинической практике диагноз хронического герпетического простатита ставится урологами редко. Причина, по-видимому, в том, что вирусологические методы диагностики не входят в стандарт обследования больных с хроническим простатитом, и пациентам традиционно проводится обследование на половые инфекции невирусной природы. Однако, по оценкам разных авторов, простатит вызывается или поддерживается ВПГ в 3-20% случаев.
В развитии вирусных простатитов чаще наблюдается уретрогенный путь передачи, а нисходящий (урогенный) путь встречается редко – при проникновении вирусов из инфицированной мочи при циститах через выводные протоки предстательной железы (ПЖ).
В клиническом течении простатитов отмечаются функциональные сдвиги - репродуктивные изменения (снижение полового влечения), болевой синдром (с иррадиацией в наружные половые органы, промежность, поясницу) и дизурия.
Хронический герпетический простатит отличается частым и упорно рецидивирующим характером. В большинстве случаев обострению хронических простатитов предшествует появление герпетических высыпаний в области гениталий. Появление везикулезно–эрозивных элементов (пузырьков и изъязвлений) может совпадать с появлением жалоб со стороны ПЖ.
Нередко у больных рецидивирующим генитальным герпесом (РГГ) простатит протекает скрыто. У этих пациентов диагноз простатита ставится на основании появления лейкоцитоза в секрете простаты и уменьшения числа лецитиновых зерен.
Необходимо помнить, что герпетический простатит может существовать, как изолированная форма герпетической инфекции. В этом случае отсутствуют симптомы РГГ и ВПГ не определяется в отделяемом уретры. Этиологический диагноз основывается на обнаружении вируса простого герпеса в секрете предстательной железы, при этом патогенная флора в секрете и в третьей порции мочи отсутствует.
Герпетический простатит приводит к формированию иммуносупрессии, в результате чего формируется синдром вторичной иммунной недостаточности Это позволяет считать его не только вирусным, но и в значительной мере иммуноопосредованным заболеванием.
Герпетическая инфекция органов малого таза
Особенностью ГГ является многоочаговость. В патологический процесс нередко вовлекаются нижний отдел мочеиспускательного канала, слизистая оболочка ануса и прямой кишки, что может происходить вторично, вслед за возникновением герпеса наружных гениталий, а может протекать как изолированное поражение.
По особенностям клинических проявлений герпетические поражения органов малого таза у мужчин целесообразно разделить на:
- герпес нижнего отдела урогенитального тракта, анальной области и ампулы прямой кишки;
- герпес верхнего отдела полового тракта.
Герпес нижнего отдела урогенитального тракта проявляется в двух клинических формах: очаговой, характеризующейся появлением типичных для простого герпеса слизистых оболочек везикулезно–эрозивных элементов, и диффузной, при которой патологический процесс протекает по типу неспецифического воспаления. При этом могут поражаться уретра, мочевой пузырь, анус, ампула прямой кишки.
- Типичная клиническая картина герпетической инфеции органов верхнего отдела мочеполового тракта проявляется симптомами неспецифического воспаления. Установить реальную частоту поражения внутренних половых органов у мужчин очень сложно, так как в 40–60% случаев заболевание протекает без субъективных ощущений.
- При субклинической форме герпеса внутренних гениталий жалобы у больного отсутствуют; при клиническом обследовании симптомы воспаления не выявляются. При динамическом лабораторном исследовании мазков отделяемого уретры в секрете простаты периодически выявляется повышенное количество лейкоцитов (до 30–40 и выше в поле зрения), свидетельствующее о наличии воспалительного процесса.
- Бессимптомная форма герпеса внутренних гениталий (бессимптомное вирусовыделение) характеризуется отсутствием у больных каких–либо жалоб и объективных клинических симптомов воспаления. При лабораторном исследовании отделяемого урогенитального тракта выделяется ВПГ, в то время как в мазках признаков воспаления (лейкоцитоза) нет.
ВПГ и мужское бесплодие
ВПГ является агентом, нарушающим сперматогенез и обладающим способностью поражать мужские половые клетки (сперматозоиды). Исследования показали, что ВПГ присутствует не только в семенной жидкости или на поверхности клеток, но и внутри самих сперматозоидов. При этом в эякуляте ВПГ-инфицированных пациентов наблюдают снижение концентрации сперматозоидов, а также увеличение частоты встречаемости аномальных гамет — сперматозоидов с микроголовками и с цитоплазматической каплей на шейке. Таким образом, ВПГ может приводить к нарушению формирования и дифференциации сперматозоидов и развитию патоспермии. Показано, что ВПГ в эякуляте пациентов с бесплодием выявляется чаще, чем в сперме мужчин без нарушений репродукции. Ряд исследований доказывают, что бессимптомно протекающая ГИ может приводить к снижению фертильности у мужчин как следствие негативного влияния вируса на сперматогенез.
Лечение генитального герпеса у мужчин
Комплексное лечение мужчин, страдающих герпесом мочеполовой системы, включает в себя общую противовирусную и иммуностимулирующую терапию в сочетании с местным лечением. Это приводит к регрессу клинических признаков хронического уретрита и простатита, уменьшению или разрешению болевого и дизурического синдромов, нормализации лабораторных показателей и в большинстве случаев — стойкой положительной динамике течения рецидивирующего ГГ.
Вы можете получить консультацию и лечение в нашем Медицинском центре. Мы всегда рады помочь нашим пациентам, квалифицированный врач высшей категории подберет для вас методику лечения генитального герпеса. При обращении в кабинет №5 первичная консультация специалиста - бесплатно.
Читайте также:

