Мутантные формы вируса гепатита в
Обновлено: 06.05.2024
Как известно, при хронической вирусной инфекции для персистирования вирусы используют различные механизмы, среди которых наиболее важными являются нецитопа тический способ репликации в клетках организма хозяина и возможность формирования латентного состояния, позволяющего вирусу избегать иммунного надзора [5]. В последние годы благодаря достижениям молекулярной биологии латентная вирусная инфекция привлекает все большее внимание. Классическим примером латентной инфекции является вирус простого герпеса, который, как установлено, может длительное время сохраняться в клетках нервной системы, не экспрессируя свои антигены, что делает его недоступным для иммунной системы [36]. В настоящее время возможность формирования латентной инфекции установлена и для вируса гепатита В (HBV). Клинико-биологическое значение и механизмы формирования латентной HBV инфекции, а также трудности ее диагностики изучаются в настоящее время достаточно интенсивно и являются предметом дискуссий. В данном обзоре мы попытались представить современное состояние этой проблемы.
До настоящего времени хроническая HBV инфекция определялась как наличие в сыворотке крови поверхностного антигена HBV (HBsAg) в течение более 6 мес. после инфицирования, при этом термин "хроническая инфекция" включает в себя различные варианты сосуществования микро- и макроорганизмов. При HBV инфекции спектр и выраженность клинических проявлений зависят от взаимоотношений вируса и иммунной системы хозяина, варьируя от бессимптомного носительства вируса до тяжелого поражения различных органов и систем, прежде всего печени, но при всех формах хронической HBV инфекции обязательным ее условием являлось наличие в сыворотке крови HBsAg. Исчезновение HBsAg и появление антител к нему рассматривалось как признак освобождения организма от вируса, т.е. прекращения инфекции.
Однако в последние годы установлено, что у ряда больных, несмотря на отсутствие HBs-антигенемии и наличие anti-HBs, в ткани печени и сыворотке крови может обнаруживаться ДНК вируса (HBVDNA) [6, 30, 31, 39]. При этом в сыворотке либо выявляли маркеры перенесенной HBV инфекции (антитела к антигенам вируса, прежде всего "изолированные" anti-HBc), которые, как теперь считают, могут быть признаком хронической латентной HBV инфекции, либо имело место отсутствие всех маркеров HBV (серонегативная инфекция) [8, 24, 31]. Клинико-морфологические исследования более ранних лет свидетельствовали об идентичности активности и стадии печеночного процесса у больных хроническими заболеваниями печени с наличием "изолированных" anti-HBc и у больных с HBs-антигенемией [1]. Отсутствие сывороточных маркеров персистирования вирусной инфекции (HBsAg и/или HBeAg) при сохранении вируса в организме объясняют двумя основными причинами: очень низкой репликативной активностью вируса, вследствие чего экспрессия вирусных антигенов значительно подавлена [23]; и наличием мутаций в геноме вируса, ведущих к нарушению синтеза вирусных антигенов, а также изменению их структуры, прежде всего HBsAg (HBsAg-мутантный штамм), что препятствует выявлению антигенов в крови доступными тест-системами [9]. Механизмы развития низкоуровневой репликации HBV остаются неизученными, хотя известно, что суперинфекция вирусом гепатита D и/или С может оказывать ингибирующее влияние на репликацию HBV, что приводит к снижению уровня виремии HBV и клиренсу HBeAg, а в случае с HCV клиренсу не только HBeAg, но и HBsAg [2, 21, 32, 34]. Также отмечено, что алкоголь может вмешиваться в механизмы репликации вируса, и у лиц, злоупотребляющих алкоголем, часто единственным маркером хронической HBV инфекции являются anti-HBc [25]. Аналогичное влияние на HBV характерно, в ряде случаев, и для вируса иммунодефицита человека (HIV). Так, в одном из исследований у 43% HIV-инфицированных в крови выявлялись anti-HBc, как единственный маркер сопутствующей HBV инфекции, при этом у 90% из них в сыворотке определялась HBVDNA [17].
В отсутствие других факторов большое значение в формировании низкоуровневой репликации HBV отводят мутациям в различных участках генома вируса, прежде всего в области перекреста С и Х генов, ответственных за репликацию вируса [28, 29].
В связи с этим возникает вопрос о роли латентной HBV инфекции в развитии хронических диффузных поражений печени. Ряд авторов отмечают, что наличие латентной HBV инфекции у больных хроническим гепатитом С связано с более тяжелым течением болезни и низким ответом на противовирусную терапию [7, 15, 40]. Улиц с алкогольным поражением печени наличие "изолированных" anti-HBc обусловливает неблагоприятный прогноз вследствие повышенного риска развития цирроза печени и гепатоцеллюлярной карциномы [3].
Несомненным фактом является то, что больные латентной HBV инфекцией могут быть источниками вируса и отвечать за развитие посттрансфузионного гепатита и инфицирование реципиентов донорских органов, особенно печени. Так, отмечены случаи, когда переливание крови и трансплантация органов от anti-HBc/anti-HBs позитивных доноров приводит к инфицированию реципиентов [10, 14, 18, 38]. Это связано с тем, что скрининг на HBV основывается на выявлении HBsAg, который не обнаруживается в случаях латентной инфекции, а также с тем, что обычные методы ПЦР не способны выявлять низкий уровень виремии. Широко обсуждается роль латентной HBV инфекции в развитии цирроза печени и гепатоцеллюлярной карциномы. Установлено, что, несмотря на клиренс HBsAg, возможно прогрессирование болезни вплоть до гепатоцеллюлярной карциномы [19, 26, 27, 33]. Если развитие гепатоцеллюлярной карциномы объясняют интеграцией генома вируса в геном клеток печени с последующей активацией про-онкогенов и подавлением опухоль-супрессорных генов, главным образом р53 (один из возможных механизмов развития рака печени), то патогенез повреждений печени при латентной вирусной инфекции остается неясным. В ряде исследований у больных с поражением печени неизвестной этиологии, имеющих признаки умеренной и высокой активности воспалительного процесса и далеко зашедшего фиброза в отсутствие серологических маркеров HBV инфекции, при использовании высокочувствительных методов ПЦР - "nested" PCR - в сыворотке выявлялась HBVDNA, а при иммунногистохимическом исследовании в ткани печени - антигены HBV [11]. Это позволяет обсуждать роль латентной HBV инфекции в развитии криптогенных поражений печени, хотя сами авторы не исключают этиологическое значение еще неизвестных гепатотропных вирусов.
Известно, что длительная иммунносупрессивная терапия (химиотерапия опухолей, лечение аутоиммунных заболеваний, профилактика реакции отторжения трансплантата), прежде всего применение глюкокортикостероидов, может привести к реактивации латентной HBV инфекции, вплоть до развития фульминантного гепатита с летальным исходом [16, 20, 22, 35]. В патогенезе реактивации латентной HBV инфекции на фоне иммунносупрессивной терапии основное значение придают действию глюкокортикостероидов. Так, известно, что геном HBV содержит глюкокортикоид-чувствительные участки, активация которых усиливает репликацию вируса, продукцию и экспрессию вирусных антигенов на поверхности гепатоцитов [12,37]. При этом поражение печени в ходе терапии глюкокортикостероидами обусловлено прямым цитопатическим действием вируса - усиленный синтез вирусных антигенов, прежде всего HBsAg, приводит к их избыточному накоплению в цитоплазме клеток печени, с последующей дистрофией, некрозом гепатоцитов и развитием тяжелого холестатического поражения печени. В качестве примера можно привести особую клиническую форму хронического гепатита В - фиброзирующий холестатический гепатит, развивающийся у лиц, которым после трансплантации печени длительно проводят иммунносупрессивную терапию глюкокортикостероидами [4,13]. Эта форма хронического" гепатита В по своим клинико-морфологическим признакам похожа на поражение печени при дефиците а l-антитрипсина, что, по-видимому, связано с общностью генеза поражения гепатоцитов: в первом случае в клетке накапливается HBsAg, во втором а l-антитрипсин. Поражение печени возможно и при резкой отмене глюкокортикостероидов, когда на фоне прекращения иммунносупрессивного действия глюкокортикостероидов и в ответ на повышенную экспрессию вирусных антигенов на поверхности гепатоцитов, прежде всего HBcAg, происходит иммунноопосредованный цитолиз гепатоцитов цитотоксическими лимфоцитами - так называемый синдром "рикошета".
"HBsAg-мутантная" инфекция (при которой в крови циркулирует структурно-измененный поверхностный антиген) представляет серьезную опасность для населения. Во-первых, она является потенциальным источником заражения реципиентов крови и донорских органов, так как во многих странах мира HBsAg является основным и единственным скрининговым маркером HBV-инфекции. Во-вторых, "HBsAg-мутантный" штамм является серьезной проблемой для программ вакцинации, так как вакцин-индуцированные антитела не обеспечивают иммунитет от инфицирования HBsAg-мутантным штаммом ("вакцин-ускользающий штамм"). У таких пациентов, несмотря на наличие в сыворотке anti-HBs, инфицирование такими штаммами может вызвать гепатит В. Данный штамм может также привести к реинфицированию печени в посттрансплантационном периоде, несмотря на профилактику специфичным иммуноглобулином (HBIg), который представляет собой поликлональные антитела к основным эпитопам поверхностного антигена HBV. Вследствие изменения структуры поверхностного антигена у HBsAg-мутантного штамма, антитела неспособны нейтрализовать вирус и предотвратить развитие инфекции.
Таким образом, анализ результатов исследований, посвященных этой проблеме, позволяет охарактеризовать латентную HBV инфекцию как гепатит В с наличием показателей репликации вируса (обнаружение HBV DNA в сыворотке крови и/или ткани печени) при отсутствии других серологических маркеров, указывающих на персистирование вируса (прежде всего негативный результат выявления HBsAg). Можно выделить два варианта латентной HBV инфекции. При первом, низкий уровень репликации HBV и, как следствие, пониженный синтез и экспрессия вирусных антигенов обусловлены влиянием ряда факторов: адекватного ответа иммунной системы; ингибирующего влияния на HBV других вирусов /HCV, HDV, HIV/; мутаций в определенных участках генома вируса, ответственных за его репликативную активность. При втором варианте репликация вируса не подавлена, HBsAg синтезируется и экспрессируется, но не выявляется современными коммерческими тест-системами вследствие мутаций, изменяющих структуру его основных детерминант.
В настоящее время можно считать установленными следующие факты, имеющие значение для клинической практики:
До настоящего времени остаются неясными патогенетические механизмы развития поражений печени при латентной HBV инфекции. Каким образом столь низкая репликативная активность вируса может вызывать воспалительные изменения в печени? Служит ли выявление латентной HBV инфекции у больных с криптогенными заболеваниями печени доказательством ее этиологической роли или она лишь фон, пусть и неблагоприятный, на котором реализует свое действие какой-либо еще неизвестный агент? Кроме того, требует своего изучения и возможная триггерная роль латентной HBV инфекции в развитии аутоиммунного гепатита, при котором могут выявляться антитела к HBV, в том числе "изолированные" anti-HBc.
Учитывая возросшее значение и роль латентной HBV инфекции в развитии поражений печени, весьма актуальной становится разработка доступных, воспроизводимых и чувствительных способов ее диагностики. Появление в широкой клинической практике диагностических препаратов, способных выявлять мутантные формы вируса гепатита В и его антигены, способствовало бы более углубленному изучению патогенетических механизмов формирования латентной HBV инфекции и ее роли в развитии болезней печени.
Современная диагностика гепатита В. Выявление HBsAg
Серологическая диагностика гепатита В в настоящее время строится на основании определения маркеров НВ-вирусной инфекции, как правило, с помощью имуноферментного анализа, то есть антигенов вируса гепатита В или антител к ним в биологических субстратах, главным образом, в сыворотке крови. В качестве основных маркеров гепатита В, имеющих самостоятельное значение для серологической диагностики, сегодня признаны:
HBsAg (поверхностный антиген вируса гепатита В) — основной маркер, свидетельствующий о наличии вируса гепатита В. При остром гепатите В HBsAg можно обнаружить еще в продромальном периоде, и длительность его персистенции при неосложненном течении составляет до 10 недель;
HBeAg — показатель высокой степени активности инфекционного процесса. Маркер репликации HBeAg определяется, как правило, при наличии HBsAg, однако циркулирует в крови менее продолжительное время — в среднем 4 недели;
anti-HBc класса IgM — показатель острого инфекционного процесса или, при хронических формах гепатита В, косвенный показатель активной репликации HBV. Возможна их длительная циркуляция;
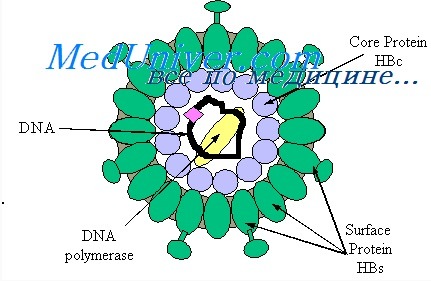
anti-HBe — не являются показателем, характеризующим какое-либо конкретное состояние при гепатите В. Эти антитела могут быть и в конце острого гепатита В и при хроническом гепатите и в случаях, так называемого здорового носительства HBsAg.
Хронический гепатит В: в фазу обострения наблюдается следующий профиль маркеров: HBsAg, HBeAg, DNA HBV, anti-HBc IgM и суммарные. В период стихания процесса обнаруживаются HBsAg, anti-HBc IgG (суммарные), возможна сероконверсия HBeAg на anti-HBe.
В основе всей серологигеской диагностики гепатита В: как острых, так и хронигеских форм—лежит определение HBsAg. Современные иммуноферментные тест-системы позволяют выявлять HBsAg в концентрациях до 0,1 нг/мл. Схема определения у разных тест-систем, как правило, одна и та же. В качестве иммуносорбента используются антитела к HBsAg. Как правило, применяются моноклональные антитела.
Именно они обеспечивают строгую специфичность применяемых в настоящее время диагностических наборов.
ПЦР (полимеразная цепная реакция) в диагностике гепатита В
Метод полимеразной цепной реакции используют для подтверждения НВ-вирусной инфекции, наличия репликации вируса при остром и хроническом гепатите В, а также определения эффективности курса лечения. Наибольшей чувствительностью обладает двойной нестед-метод, который предполагает использование двух пар праймеров. Чувствительность нестедметода весьма высока и позволяет выявлять несколько копий DNA HBV в образце, что существенно превосходит возможности ИФА.
Сегодня разработаны соответствующие технологии производства отечественные тест-системы для детекции DNA HBV с помощью ПЦР, которые активно применяются в практическом здравоохранении. Высокая чувствительность ПЦР-диагностики при гепатите В расширила возможности раннего определения вируса гепатита В при острой инфекции. Длительность инкубационного периода при гепатите В достигает 6 месяцев, а в ряде случаев и больше. В это время вирус попадает в кровь, проникает в клетки печени, запускается механизм репликации, и в результате размножение приобретает устойчивый характер.
Эти процессы не затрагивают в значительной степени жизнедеятельность печени и других органов в течение длительного времени. В этот период эффекторные реакции иммунной системы организма не задействованы. Число вирусных частиц резко возрастает к концу инкубационного периода и становятся максимальными. В этот период методом ПЦР можно обнаружить в крови вирус гепатита В, тогда как остальные маркеры НВ-вирусной инфекции, главным образом серологические, ещё отсутствуют. Таким образом, с помощью полимеразной цепной реакции стала возможной более ранняя диагностика острого гепатита В.
Варианты HBsAg гепатита В и их распространение
Серологическая гетерогенность вируса гепатита В установлена в 1971 году G. L. Le Bouvier, когда им были описаны две взаимоисключающие субдетерминанты d и у. В 1972 году W. Н. Bancroft et al. выявили еще две дополнительные субдетерминанты — w и r.
Наличие общей детерминанты a HBsAg и двух пар взаимоисключающих детерминант d или у и w или r приводит к существованию 4 серотипов или, как их еще называют, субтипов: adw, ayw, adr, ayr. Общеизвестные серотипы вируса иногда ошибочно называют генотипами.
Между тем, генетический анализ вирусов четырех вышеупомянутых серотипов не выявил четкого соответствия между определенными генотипами и серотипами. В настоящее время известно 6 генотипов (A-F) и 9 серотипов HBV.
Сегодня, с учетом данных о ряде аминокислотных замен, приводящих к образованию нескольких минорных субдетерминант, выделено девять основных субтипов HBsAg — ayw1, ayw2, ayw3, ayw4, ayr, adw2, adw4, adrq-v, adrq-. В различных регионах мира структура циркулирующих субтипов HBsAg неодинакова.
В Северной и Южной Америке, Европе и значительной части Азии преобладают субтипы adw2, ayw3, ayr. Субтипы ayw2, ayw4, adw2 часто встречаются в Африке, adrq+ широко распространен в Юго-Восточной Азии, adrq- — в Австралии. К. Madalinski et al., 1977 показали преимущественное распространение субтипа adw, который был обнаружен в Польше и Венгрии соответственно в 80,7% и 72,2% случаев.
Исследования, проведенные в Финляндии, зафиксировали у 77-100% лиц с HBs-антигенемией субтип ау. По данным G. Gerna et al., 1976, на севере Италии субтип ayw преобладает (83,1%). Представляют значительный интерес данные К. Katsuki et al., 1980 о различиях в частоте обнаружения одного и того же субтипа в различных этнических группах Японии.
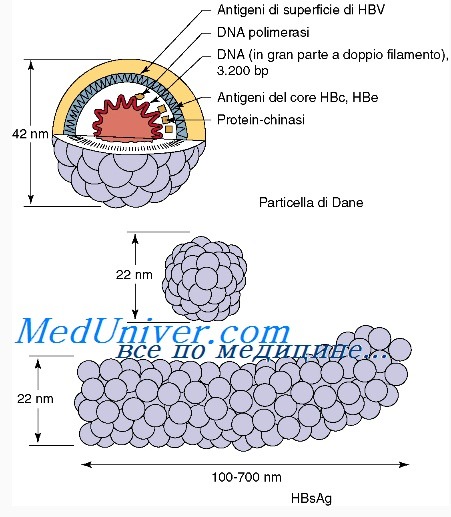
В качестве антигена важнейшее значение имеет детерминанта a HBsAg, которая является доминирующим кластером эпитопов HBV, обеспечивает выработку протективного иммунитета и взаимодействует с подавляющим большинством антител к HBV, присутствующих в гипериммунной сыворотке. Кроме того, детерминанта а весьма консервативная структура у всех серотипов HBV, что делает HBsAg важнейшим компонентом всех ныне применяемых вакцин.
Детерминанта а представляет собой часть большого гидрофильного региона HBsAg. Антигенность а детерминанты обусловлена ее третичной структурой. Детерминанта состоит из 23 аминокислотных остатков, локализованных в положении 124-147 пептидной цепочки HBsAg, и образует 2 петли, выступающие над наружной поверхностью вируса.
Большинство антител, вырабатываемых в ответ на вакцинацию, взаимодействует с участком, состоящим из 9 аминокислотных остатков в положении 139-147. С другой стороны, показано, что детерминанта а является конформационным кластером эпитопов, включающим область 120-124 аминокислотных остатков. Так, замены аминокислотных остатков в позициях 139-147 способны влиять на связывание антител с эпитопом в позиции 122, а замены аминокислотных остатков в позициях 120-124 в свою очередь влияют на связывание антител с эпитопом в позиции 139-147. Диагностические методы, разработанные для выявления HBsAg, основаны на применении антител, полученных к удлиненной детерминанте а.
Поверхноcтный белок вируса гепатита В (HBsAg), кодируемый S-геном, играет ключевую роль в диагностике, изучении этиологии, патогенеза, клиники и профилактики гепатита В. HBsAg обладает высокой иммуногенностью и индуцирует сильный иммунный ответ с образованием нейтрализующих антител. Этот ответ направлен преимущественно против "а"-детерминанты, которая расположена в главной гидрофильной петле HBsAg между 124 и 147 а.к.о. В "а"-детерминанте, несмотря на высокий консерватизм S-гена, возможны антигенные вариации. Вариабельность вируса гепатита В (ВГВ) "дикого" типа обусловлена естественной изменчивостью, что отражается в существовании генотипов или субтипов. Кроме того, изменчивость "а"-детерминанты может быть результатом селекции HBsAg-мутантов ВГВ, имеющих преимущество перед "диким" типом. Такого рода селекция возникает при специфическом иммунном ответе у хронических носителей инфекции ВГВ в ходе специфической иммунопрофилактики или в результате неспецифической противовирусной терапии. Мутации в S-гене ВГВ могут сопровождаться конформационными изменениями "а"-детерминанты и, как следствие, изменением серологических свойств HBsAg. Вирусы, несущие такие мутации, получили наименование "ускользающих" HBsAg-мутантов (escape mutants), поскольку они способны уходить от иммунологического, вакцинального или диагностического контроля.
Существование "ускользающих" HВsAg-мутантов ВГВ приводит к возникновению диагностических ошибок при тестировании образцов крови на наличие HBsAg. Такого рода ошибки обусловлены, прежде всего, широким использованием в современных диагностических тест-системах моноклональных антител (мАТ) к HBsAg. Применение в тест-системах мАТ, по сравнению с использованием поликлональных антител, повышает специфичность иммунодетекции HBsAg "дикого" типа. Однако, с другой стороны, их относительно узкая специфичность способна ограничивать возможности выявления мутантного HBsAg.
Проведено сравнительное испытание коммерческих иммуноферментных тест-систем для выявления HBsAg, широко представленных на российском рынке. Для исследования была разработана панель сывороточных образцов, содержащих мутантные формы HBsAg. Исследование показало, что только 2 из 7 испытуемых тест-систем выявляют мутантные формы HBsAg с той же чувствительностью, что и HBsAg "дикого" типа. Тест-системы, основанные только на моноклональных антителах, не выявляли HBsAg с заменой G145R в концентрации 5 нг/мл. Исследование подтверждает актуальность проблемы выявления HBsAg-мутантов для иммунодиагностики гепатита В. (См. статью: Баженов А.И. с соавт. "Оценка чувствительности коммерческих тест-систем для иммунодетекции HBsAg по их способности выявлять HBsAg-мутанты вируса гепатита В").
Читайте также:

