Нобелевская премия за герпес
Обновлено: 25.04.2024
Ацикловир — один из самых известных препаратов, используемых для лечения таких вирусных заболеваний как герпес простой, опоясывающий лишай, ветряная оспа и многих других. В течение десятилетий этот препарат не только широко используется в терапии, но и служит базой для создания новых, более эффективных средств. Изобретение и внедрение ацикловира в медицинскую практику без всяких сомнений является одним из самых важных достижений химиотерапии.
Смотреть препараты для лечения герпеса
Создание Ацикловира
Как действует Ацикловир?
Ацикловир — искусственный аналог нуклеозида дезоксигуанозина, который является важным компонентом ДНК. Ацикловир обладает подавляющим действием против вирусов герпеса 1, 2 типа, а также против герпеса Зостер. Препарат позволяет остановить воспроизводство вируса в клетках зараженного организма; однако он не способен полностью удалить вирус.
Одной из самых удивительных и загадочных особенностей ацикловира является избирательность его действия. Во время исследований Гертруда Элайон обнаружила, что вещество остается абсолютно инертным до того момента, когда встречается с вирусом герпеса. Ацикловир не воздействует на здоровые клетки организма; он обладает минимальной токсичностью и отлично переносится большинством пациентов. К его преимуществам также можно отнести безопасность для беременных и практически полное отсутствие риска нежелательного взаимодействия с другими лекарственными препаратами.
Коммерческое использование препарата
В период с 1974 по 1977 исследователи держали препарат в секрете; первые сведения о его свойствах появились только через четыре года после синтезирования. В 1982 году ацикловир получил одобрение FDA и поступил в продажу под коммерческим названием Зовиракс. Впервые ацикловир был выпущен в виде мази, хотя сегодня не менее распространенной формой являются таблетки на его основе.
Очень скоро исследователи начали использовать ацикловир в качестве основы для создания новых противовирусных препаратов. Так появились три основных аналога препарата:
Обладает более высокой биодоступностью при пероральном приеме по сравнению с ацикловиром. Препарат можно применять реже, чем ацикловир, что делает его удобнее в использовании.
Обеспечивает лечение вируса герпеса тех типов, которые устойчивы к действию ацикловира. Обладает сравнимой с ацикловиром эффективностью при более низких дозировках. Широко применяется при лечении постгерпетических осложнений невралгического характера.
Используется при лечении цитомегаловирусной инфекции и других герпесвирусных инфекции. Употребляется как инъекционно, так и перорально.
Предназначен для перорального употребления; в организме быстро превращается в ганцикловир. Обладает высоким уровнем биодоступности при пероральном приеме.

Дэвид Джулиус (David Julius) родился в Нью-Йорке в 1955 году, степень бакалавра получил в Массачусетском технологическом институте, а степень доктора философии (Ph. D.) — в Калифорнийском университете в Беркли. С 1990 года работает в Калифорнийском университете в Сан-Франциско. Ардем Патапутян (Ardem Patapoutian), рожденный в Ливане в 1967 году, переехал в США в 1986 году. Он окончил Калифорнийский университет в Лос-Анджелесе, а докторскую степень получил в Калтехе в 1996 году. С 2000 года работает в Научно-исследовательском институте Скриппса (Scripps Research). Таким образом, все отмеченные премией работы обоих лауреатов проводились на территории США.

Рис. 2. Коллеги по Калифорнийскому университету в Сан-Франциско (University of California San Francisco, UCSF) поздравляют Дэвида Джулиуса с присуждением Нобелевской премии. Фото с сайта ucsf.edu
Собственно, нервные пути, по которым распространяются те или иные ощущения, проделывая путь от кожи или иных участков тела, где находятся чувствительные нервные окончания, к спинному мозгу (и далее в головной мозг — где формируются уже осознанные ощущения), были в основном более или менее известны физиологам уже в 1980-х. И уже тогда было хорошо известно, что возбуждение начинается с изменения электрического потенциала на цитоплазматической мембране чувствительных нейронов, а значит, с открывания каких-то ионных каналов, встроенных в мембраны этих клеток. Так что целью Джулиуса и Патапутяна было выяснить, какие именно белки обеспечивают определенные формы чувствительности, какими свойствами они обладают, какими генами обеспечивается их синтез и насколько широки их функции в организме.

Этот белок, как и все прочие члены семейства TRP (в сумме их у млекопитающих обнаружилось аж 28), формирует ионный канал, который в открытом состоянии пропускает разнообразные моновалентные и дивалентные неорганические катионы (в первую очередь это Na + и Ca 2+ ), а также способен пропускать и органические катионы, в том числе довольно крупные. Ионный канал формируется четырьмя молекулами белка. Каждая отдельная белковая молекула имеет шесть гидрофобных участков, которые пронизывают мембрану, заякоривая в ней белок. Концы белковых молекул выходят на противоположные стороны от мембраны, формируя внеклеточный и внутриклеточный домены. Через них рецептор может взаимодействовать с другими молекулами экзогенного или эндогенного происхождения, которые могут влиять на работу канала.
TRPV1, будучи терморецептором, изменяет свою конформацию при воздействии повышенной температуры таким образом, что канал переходит в открытое состояние. Аналогичные изменения в конформации белка возникают и при взаимодействии с капсаицином красного перца, некоторыми пептидами (токсинами паука), а также с продуктами гидролиза мембранных фосфолипидов ферментом фосфолипазой — фосфоинозитидами. Открытие канала приводит к деполяризации мембраны нервного окончания и возникновению потенциала действия, направляемого далее в ЦНС. Возникающие при этом ощущения — это то самое чувство ожога, то есть боли, которая заставляет нас отдергивать руку от горячего, и заливать холодной водой пожар во рту после обеда в индийском ресторане.
Через два года после пионерской работы Джулиуса. вышла публикация о еще одном похожем рецепторе. Его сначала назвали VRL-1, теперь же он обозначается TRPV2. Его активация требует более высоких температур (от 52°C), и он не реагирует ни на капсаицин, ни на кислотность среды. Сходство по аминокислотной последовательности для двух мышиных белков — 49%. Оба белка имеют ортологи и у человека.
Следующим на очереди стал рецептор холода. Сложно сказать, насколько это удивительно или закономерно, но один и тот же рецептор был описан в двух статьях, вышедших практически одновременно в начале 2002 года в двух престижнейших журналах: статья Дэвида Джулиуса — в журнале Nature (D. D. McKemy et al., 2002. Identification of a cold receptor reveals a general role for TRP channels in thermosensation), а статья Ардема Патапутяна — в журнале Cell (A. M. Peier et al., 2002. A TRP channel that senses cold stimuli and menthol). Новооткрытый белок Джулиус назвал CMR1, а Патапутян TRPM8 — это название и было оставлено в итоге, поскольку снова это был белок из семейства TRP. Поиски рецептора опять велись при помощи вещества-агониста. Только на этот раз эту роль выполнял ментол — вещество из мяты перечной. Да-да, этот холодок от мятной жвачки вовсе неспроста — ментол действительно активирует те же самые нервные окончания, которые сообщают мозгу о прикосновении к чему-то прохладному, — причем, через взаимодействие с теми же самыми рецепторными каналами.
В течение следующего года в лаборатории Патапутяна были открыты еще два терморецептора из семейства TRP. Один из них, TRPA1, реагирует на очень низкие температуры — такие, при взаимодействии с которыми может даже ощущаться боль. Кроме того, позднее было установлено, что канал из этого белка может активироваться при взаимодействии с широким спектром летучих веществ и ядов, вызывая раздражение в слизистых оболочках (кашель, слезоточивость) и чувство боли и зуда (например, при укусах некоторых насекомых, скорпионов и т. д.). С мутациями этого белка связаны некоторые синдромы хронической боли и гиперчувствительности.
Интересно, что среди нервных волокон, несущих рецепторы холода, примерно у половины одновременно присутствуют и рецепторы горячего. Как эти волокна дифференцируют разные стимулы и доносят правильную информацию в мозг — пока не совсем понятно.
Еще один рецептор, TRPM3 — реагирует на мягкое тепло. Этот рецептор обнаруживается на мембранах кератиноцитов кожи, а не нейронов, где обычно находятся все выше упомянутые рецепторы. Предполагается, что работа этого рецептора может быть существенна в отношении скорости появления возрастных изменений кожи.
Если вас беспокоит зубная боль, то ее виновника опознали совсем недавно (L. Bernal et al., 2021. Odontoblast TRPC5 channels signal cold pain in teeth). Им оказался рецепторный белок TRPC5, экспрессирующийся в одонтобластах — особых клетках, которые размещаются в пульпе зуба. Из-за этого белка мы испытываем это ужасное ощущение, когда, откусив мороженого, вместо ожидаемого удовольствия, вдруг чувствуешь, как от холода начинают неприятно болеть все зубы одновременно.
Интересно, что рецептор TRPV2 был обнаружен также в клетках внутренних органов, не являющихся нейронами (например, на фибробластах — клетках соединительной ткани). В этих клетках он регулирует транспорт кальция внутрь в ответ на сигналы, не связанные с повышенной температурой (M. Kanzaki et al. 1999. Translocation of a calcium-permeable cation channel induced by insulin-like growth factor-I). В частности, было установлено, что этот канал регулируется связыванием с инсулиноподобным фактором роста — важнейшим белком, поддерживающим деление клеток у животных.
Практические аспекты описываемых работ лежат в области медицинской проблематики, связанной с поиском причин патологических болей и разработкой средств для их оптимального лечения. Вот лишь один пример. Как было сказано выше, рецепторные ионные каналы TRPV1 и TRPV2 способны пропускать органические катионы. Это их свойство стало предпосылкой для разработки нового подхода к проведению анестезии. Всем знакомый лидокаин, будучи неполярным органическим соединением, может проникать через липидную клеточную мембрану посредством диффузии. В нейронах он связывает изнутри и блокирует работу каналов натрия, чем и обусловлен его анестезирующий эффект. Проникновение лидокаина в клетки неизбирательно — воздействие оказывается на все типы нейронов. В области инъекции теряется не только всякая чувствительность, но и возможность управлять мышцами. В эксперименте ученые проводили инъекцию в заднюю конечность смеси из катионных производных лидокаина и капсаицина (он был нужен для стимуляции открытия канала TRPV1). В итоге порог болевой чувствительности был заметно повышен, но при этом крысы в полной мере сохранили способность двигать ногами и воспринимать неболевые стимулы в области инъекции.
Еще один важный класс рецепторов, который был открыт и изучен в работах лауреатов — это так называемые механорецепторы, реагирующие на давление или другие виды механического воздействия (как внешнего, так и внутреннего). По крайней мере для животных белки с функцией механорецепторов впервые были идентифицированы в 2010 году группой Патапутяна (B. Coste et al., 2010. Piezo1 and Piezo2 Are Essential Components of Distinct Mechanically Activated Cation Channels). У позвоночных их оказалось два: PIEZO1 и PIEZO2 (открытие было сделано на культуре мышиных нейробластов). У большинства видов, впрочем, обнаруживается только один этих гомологов. Гомологичный им белок был выявлен, между прочим, и у растений (в частности, на клетках корневого чехлика, см. S. A. R. Moustavi et al., 2021. PIEZO ion channel is required for root mechanotransduction in Arabidopsis thaliana), а также у одноклеточных эукариот. Вместе с тем белки PIEZO не имеют признаков гомологии с некоторыми другими белками-механорецепторами, выявленными намного раньше у бактерий и архей.
В 2012 году группой Патапутяна было подтверждено предположение, что белки PIEZO формируют пору (ионный канал) в мембранах клеток млекопитающих (B. Coste et al., 2012. Piezos are pore-forming subunits of mechanically activated channels). Оказалось, что каждая пора состоит из трех одинаковых молекул белка, но при этом сами белки не имеют жесткой предсказываемой структуры. Предполагается наличие 16–18 гидрофобных участков, пронизывающих мембрану.


Рис. 4. Модель структуры белка PIEZO1 построенная на основе данных, полученных при помощи криогенной электронной микроскопии. А — вид с наружной (слева) и с внутренней стороны мембраны на полный рецептор, образуемый тремя одинаковыми молекулами белка PIEZO1. В рецепторе можно выделить центральную область, в которой, собственно, и находится пора для тока ионов, и периферические лопасти (Blade). С внутренней стороны лопасти поддержаны структурами типа балок (Beam). В — схематическое изображение топологии рецептора в мембране при виде сбоку. На рисунке показаны две субъединицы порового комплекса. В каждой субъединице можно выделить несколько структурных участков-доменов: центральная часть рецептора образована из C-концевого внеклеточныго домена (CED), внутренней и внешней спиралей (IH, OH), C-концевого домена (CTD); периферическая часть рецептора включает якорный домен (Anchor) и периферические спирали (PH), формирующие боковые лопасти и балки. Показано, как рецептор меняет конфигурацию в процессе активации при деформации мембраны вследствие механического воздействия. Неактивному состоянию рецептора соответствует голубой цвет, активированному — оранжевый. С — линейная схема взаимного расположения указанных выше доменов в молекуле белка. Рисунок статьи J. Ge et al., 2015. Architecture of the mammalian mechanosensitive Piezo1 channel
И, наконец, только в 2016 году этой же научной группой было окончательно доказано, что стимулом для активации ионного канала, образованного белками PIEZO, является непосредственно деформация билипидного слоя мембраны, а не какие-то дополнительные молекулы-посредники (R. Syeda et al., 2016. Piezo1 channels are inherently mechanosensitive).
У млекопитающих сходство аминокислотных последовательностей паралогов PIEZO1 и PIEZO2 составляет 42%. Оба белка обнаруживаются в нервных окончаниях, подходящих к чувствительным структурам в коже и мышцах (клетки Меркеля, тельца Мейснера, нервно-мышечные веретена, сухожильный орган Гольджи). Именно работой этих ионных каналов обеспечивается восприятие тактильных ощущений в коже (S. S. Ranade et al., 2015. Piezo2 is the major transducer of mechanical forces for touch sensation in mice), а также проприоцепция — способность ощущать положение собственных частей тела относительно друг друга, чувствовать напряжение собственных мышц (S. Woo et al., 2015. Piezo2 is the principal mechanotransduction channel for proprioception).

У людей особенно высокая концентрация механорецепторов обнаруживается в коже ладоней и пальцев. Скопления механорецепторов обнаруживаются в чувствительных участках кожи и у животных, которые в значительной мере полагаются на осязание при добывании пищи, — например, в отростках на носу у крота-звездоноса, на кончике клюва уток и в волосяных фолликулах у основания вибрисс кошек и мышей.
Некоторые нервные окончания могут содержать одновременно белки PIEZO и TRPV2 — такие нервные окончания несут в мозг болевые сигналы, связанные с некоторыми механическими воздействиями (например, укол иглой).
На сегодняшний день известно около 25 мутаций, затрагивающих эти белки, которые приводят к тяжелым порокам развития у людей. Белок PIEZO2 экспрессируется только в нейронах. Аномалии в этом белке приводят к нарушению развития опорно-двигательного аппарата — атрофии мышц, врожденному сколиозу и т. д. Белок PIEZO1 оказался достаточно широко экспрессируемым в разных типах клеток. Особенно высока его концентрация в легких, почках, мочевом пузыре, сердце и кровеносных сосудах. Все это полостные органы, функционирование которых подразумевает механические сжатия и растяжения. Недостаточность функционирования PIEZO1 в эмбриональном периоде приводит к невозможности нормального развития системы кровеносных сосудов. Но, в то же время, избыточность функции белков PIEZO бывает связана с гиперчувствительностью к боли и синдромами хронических болей, среди которых широко и печально известна мигрень (A. Della Pietra et al., 2020. The Emerging Role of Mechanosensitive Piezo Channels in Migraine Pain). Для любопытствующих можем порекомендовать обстоятельный обзор разнообразия функций механорецепторов PIEZO у млекопитающих (J. Wu et al., 2016. Touch, Tension, and Transduction — the Function and Regulation of Piezo Ion Channels).
Также оказалось, что белок PIEZO1 в больших количествах присутствует на адипоцитах — основных клетках жировой ткани. Как выяснилось, этот рецептор составляет важное звено в контроле созревания адипоцитов и функционирования жировой ткани, в том числе при употреблении высококалорийной диеты (S. Wang et al., 2020. Adipocyte Piezo1 mediates obesogenic adipogenesis through the FGF1/FGFR1 signaling pathway in mice).
В настоящее время исследованиями различных аспектов работы температурных, болевых и механических рецепторов, открытых группами Джулиуса и Патапутяна, занимаются сотни лабораторий по всему миру. Изучение этих белков не только позволило разобраться в деталях генерирования тех или иных сенсорных ощущений у человека, но и привело к пониманию, что те же самые рецепторы вовлечены в обеспечение нормального развития и функционирования множества тканей и органов в нашем теле. Получаемые фундаментальные знания в конечном итоге помогают в поиске оптимальных стратегий решения медицинских задач. В особенности это касается аспектов патологической боли, в том числе хронической, которая серьезно снижает качество жизни многих людей.

Харальд цур Хаузен родился в 1936 году в Гельзенкирхене (Германия). Он учился в Боннском, Гамбургском и Дюссельдорфском университетах. В Дюссельдорфском университете он получил степень доктора медицины и несколько лет работал в подчиненном университету Институте медицинской микробиологии. В середине шестидесятых цур Хаузер переехал в Филадельфию (США), где вначале работал в Лаборатории вирусологии знаменитой Детской больницы, а впоследствии преподавал в Пенсильванском университете. В 1969 году он вернулся в Германию и стал профессором в Вюрцбургском университете, затем работал в университетах в Эрлангене и Нюрнберге и во Фрайбурге в Брайсгау, а с 1983 года — в Германском центре исследования рака, который он возглавлял в течение 20 лет (1983–2003).
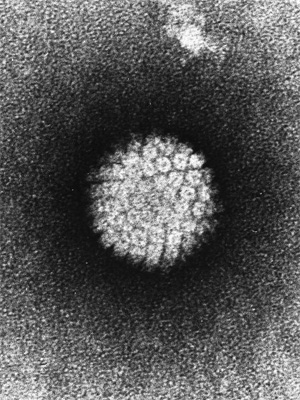
Вирусы папилломы человека (ВПЧ) передаются от человека к человеку. Некоторые разновидности ВПЧ безвредны, некоторые вызывают образование бородавок на коже, некоторые поражают половые органы (передаваясь половым путем). В середине семидесятых Харальд цур Хаузен обнаружил, что женщины, страдающие раком шейки матки, неизменно заражены ВПЧ. В то время многие специалисты полагали, что рак шейки матки вызывается вирусом простого герпеса (Herpes simplex virus), но цур Хаузен нашел в раковых клетках не вирусы герпеса, а вирусы папилломы, и предположил, что развитие рака происходит в результате заражения именно вирусом папилломы. Впоследствии ему и его коллегам удалось подтвердить эту гипотезу и установить, что большинство случаев рака шейки матки вызваны одним из двух типов этих вирусов: ВПЧ-16 и ВПЧ-18. Зараженные такими вирусами клетки с довольно большой вероятностью рано или поздно становятся раковыми, и из них развивается злокачественная опухоль.
В середине восьмидесятых годов были начаты исследования, благодаря которым на сегодня уже получены и запущены в производство несколько вакцин, инъекция которых позволяет, по крайней мере на несколько лет, свести к нулю риск заражения определенными типами ВПЧ (в том числе 16 и 18). Таким образом, благодаря открытию цур Хаузена были разработаны высокоэффективные средства для предотвращения рака шейки матки.
Теперь первоочередная задача — внедрение этих средств. Около 5% всех случаев заболевания раком в мире приходится на рак шейки матки, и больше двухсот тысяч женщин умирают каждый год от этой болезни. Широкое распространение вакцинации от ВПЧ позволит спасти сотни тысяч женщин. Решение Нобелевского комитета наверняка принесет пользу делу: присужденная цур Хаузену премия, вероятно, поможет привлечь внимание людей во всём мире к проблеме предотвращения рака шейки матки и будет способствовать распространению спасительной вакцинации.
Люк Монтанье родился в 1932 году в коммуне Шабри в департаменте Эндр (Франция). Он учился в Пуатье и в Париже, некоторое время работал в Париже, а затем стажировался в ведущих вирусологических лабораториях Великобритании, где изучал, в частности, механизм репликации РНК-содержащих вирусов. Вернувшись в Париж, он вначале исследовал ретровирусы в Институте Кюри, а в 1972 году был приглашен Жаком Моно (Jaques Monod), выдающимся исследователем механизмов регуляции работы генов, в новообразованное отделение вирусологии Института Пастера, где Монтанье организовал и возглавил группу вирусной онкологии, которая проводила исследования, посвященные механизмам возникновения злокачественных опухолей в результате вирусных инфекций. Сотрудниками этой группы и был впервые выделен возбудитель СПИДа. В 1993 году Люк Монтанье и генеральный директор ЮНЕСКО Федерико Майор (Federico Mayor) учредили Всемирный фонд исследования и предупреждения СПИДа. Монтанье возглавил этот фонд и по сей день руководит им.
В 1982 году группа Люка Монтанье начала исследования с целью выявить возможного возбудителя недавно описанного необычного заболевания — синдрома приобретенного иммунодефицита, характеризующегося прогрессирующим ослаблением жизненно важной иммунной системы. В 1983 году вирус был выделен (поначалу он получил другое название, но сегодня он известен как ВИЧ — вирус иммунодефицита человека). Вскоре после открытия ВИЧ в Институте Пастера его выделили и в США, в группе Роберта Галло (Robert Gallo), сотрудничавшей с группой Монтанье, из образцов, полученных от французской группы. Претензия Роберта Галло на первенство в открытии и полученный им патент на методику анализа крови на ВИЧ вызвали многолетние споры между американской и французской сторонами. Эти споры в конечном итоге разрешились признанием приоритета группы Монтанье. К сожалению, споры о приоритете отняли у исследователей много времени и немало помешали работе в области изучения ВИЧ и поиска и внедрения средств, позволяющих выявлять, предупреждать и лечить ВИЧ-инфекцию.

С 1981 года, когда был впервые описан СПИД, от этой болезни умерло больше 25 миллионов человек. Больше 33 миллионов живущих сегодня людей заражены ВИЧ, и каждый год болезнь уносит новые миллионы жизней. СПИД называли чумой XX века. Давно наступил XXI век, а число людей, зараженных ВИЧ, продолжает расти, и порядка двух миллионов зараженных, значительную долю которых составляют дети, ежегодно умирают от СПИДа. К счастью, уже разработаны методы лечения, позволяющие на десятилетия отодвинуть смерть зараженного СПИДом человека. Но к сожалению, это лечение стоит дорого, и позволить его себе могут в основном лишь достаточно состоятельные люди. При этом СПИД более всего распространен как раз на самом бедном континенте — в Африке. Кроме того, до сих пор не удалось разработать, и неизвестно, удастся ли, ни способов полного выведения ВИЧ из зараженного организма, ни вакцины, прививка которой сводила бы к нулю (или хотя бы существенно уменьшала) риск заражения СПИДом. Но продолжаются интенсивные исследования, и в будущем меры борьбы со СПИДом наверняка станут доступнее и действеннее.
Открытие группой Люка Монтанье вируса, вызывающего СПИД, было сделано вскоре после открытия самой болезни. Быстрое выявление возбудителя СПИДа очень помогло последовавшей затем разработке способов борьбы с этим заболеванием.
Премия, по традиции, будет вручена лауреатам 10 декабря, в день смерти Альфреда Нобеля, в его родном городе — Стокгольме. В прошлом году Нобелевскую премию по физиологии и медицине получили Марио Капекки (Mario R. Capecchi) из Университета Юты (США), Оливер Смитис (Oliver Smithies) из Университета Северной Каролины (США) и Мартин Эванс (Sir Martin J. Evans) из Кардиффского университета (Великобритания) за изобретение метода нокаута генов (gene knockout).
Источники:
1) Nobel prize for viral discoveries // BBC News. 6 October 2008.
2) Alison Abbott. Virus discoveries secure Nobel prize in medicine // Nature News. Published online 6 October 2008.

Вирусный гепатит существует в нескольких формах, но самые распространенные из них – A, B и C. Гепатит А – форма более легкая и передается проще, через воду и еду. Гепатиты B и C передаются вместе с кровью. Гепатит B был изучен ранее: возбудителя выделил Барух Блумберг еще в 60-е годы, Нобелевскую премию за это он получил в 1976 году.
Однако оказалось, что тесты на гепатиты A и B не решили проблему возникновения гепатита у пациентов, которым переливали донорскую кровь. Этот эффект обнаружил американец Харви Олтер еще в 1975 году, он же обнаружил, что этим вирусом, кроме людей, болеют шимпанзе – так были найдены единственные доступные для этой болезни животные модели.

Канадский британец Майл Хьютон работал тогда в фармкомпании Chiron и занялся выделением этого нового вируса. Он экспериментировал на шимпанзе – удалось выяснить, на какие из фрагментов ДНК, выделенных из крови больных животных, реагируют антитела из крови людей с этим гепатитом. Так и удалось выделить искомый РНК-вирус – свою главную работу Хьютон опубликовал в 1989 году.
Третий лауреат – американец Чарльз Райс – доказал, что именно этот вирус вызывает гепатит у получивших донорскую кровь пациентов. Он собрал экспериментальный вирус с характерными для гепатита C участки и ввел его в печень шимпанзе. Те заболели изучаемой болезнью – так в 1997 году была показана непосредственная патогенность вируса.
Нередкая болезнь
Во всем мире, по данным ВОЗ, гепатитом C болеют более 70 млн человек, около 400 000 человек умирают от него каждый год. По данным официального источника , в России гепатитом C болеют более 3,5 млн человек, около 15 000 человек в год умирают от вызываемых им цирроза и рака печени. Если от более легко протекающих вирусов гепатита A и B можно привиться, то прививки от гепатита C пока не существует из-за высокой изменчивости вируса.
Зато существует – что гораздо большая редкость – по-настоящему эффективная терапия. Поэтому так значимы исследования сегодняшних лауреатов – это фундаментальная наука, которая позволила решить практическую задачу создания лекарства.
Как лечат вирусы

Для жизни им необходима клетка хозяина, поэтому и для лечения вирусных инфекций приходится иметь дело не с вирусом как таковым, а с процессом его взаимодействия с клеткой хозяина. Поэтому при всем многообразии вирусных инфекций, лекарства с подтвержденной эффективностью существуют всего от нескольких из них. От полиомиелита, свинки, краснухи, корь могут защитить вакцины, но не лекарства (кстати, отчасти этот ответ на вопрос, почему так далеко продвинулись вакцины от ковид, а терапия – нет). В результате многолетних исследований терапии удалось разработать от ВИЧ, герпеса, ветряной оспа и гриппа (с некоторыми оговорками) – и вирусных гепатитов.
О лауреатах

Премия по физиологии и медицине является одной из пяти премий, учрежденных самим Альфредом Нобелем: премии присуждаются за выдающиеся достижения в химии, физике, литературе, в физиологии или медицине и за вклад в установление мира. Первую Нобелевскую премию по физиологии или медицине вручили в 1901 году. Россияне получали эту премию только дважды – это были Иван Павлов (за работы по физиологии пищеварения) и Илья Мечников (за работы по иммунитету). Обе награды были получены более 100 лет назад.
На этой неделе будут объявлены и другие лауреаты Нобелевской премии 2020 года – во вторник по физике, в среду – по химии, четверг – по литературе, в пятницу – премия мира.
Сейчас, когда закрыто огромное количество СМИ, Правмир продолжает свою работу. Мы работаем, чтобы поддерживать людей, и чтобы знали: ВЫ НЕ ОДНИ.
18 лет Правмир работает для вас и ТОЛЬКО благодаря вам. Все наши тексты, фото и видео созданы только благодаря вашей поддержке.
Поддержите Правмир сейчас, подпишитесь на регулярное пожертвование. 50, 100, 200 рублей - чтобы Правмир продолжался. Мы остаемся. Оставайтесь с нами!
Читайте также:

