Отек легких при гриппе патогенез
Обновлено: 27.04.2024
2. Дедов И.И. Эндокринология: учебник / И.И. Дедов, Г.А. Мельниченко. – М.: ГЭОТАР-Медиа, 2013. – 752 с.
3. Зайчик А.Ш. Патофизиология: в 3 томах. Том 1. Общая патофизиология (с основами иммунологии): учеб. / А.Ш. Зайчик, Л.П. Чурилов. – 4-е изд. – СПб.: ЭЛБИ-СПб, 2008. – 656 с.
4. Зайчик А.Ш. Патологическая физиология. Том 2. Патохимия: учеб. / А.Ш. Зайчик, Л.П. Чурилов. – 3-е изд. – СПб.: ЭЛБИ-СПб, 2007. – 688 с.
7. Патологическая физиология: учеб. / под общ. ред. В.В. Моррисона, Н.П. Чесноковой. – 4-е изд. – Саратов: Изд-во Сарат. гос. мед. ун-та, 2009. – 679 с.
8. Серов В.Н. Гинекологическая эндокринология / В.Н. Серов, В.Н. Прилепская, Т.В. Овсянникова. – 5-е изд. – М.: МЕДпресс-информ, 2015. – 512 с.
Отек легких. Отек легких – патологическое состояние полиэтиологической природы, характеризующееся усиленной транссудацией жидкости из сосудов микроциркуляторного русла легких в интерстициальную ткань или альвеолы.
В 23% наблюдений отек легких возникает при сердечно-сосудистой недостаточности, а также при эмболии сосудов малого круга кровообращения. Отек легких может быть осложнением тяжелых инфекций и интоксикаций (корь, скарлатина, брюшной тиф, чума), обструкции воздухоносных путей, почечной и печеночной недостаточности.
В этиологии отека легких немалое место занимает ингаляционное воздействие промышленных ядов, раздражающих газов: хлора, метана, фосгена, фреона, паров аммиака, синильной, уксусной, масляной и минеральных кислот.
Отек легких нередко возникает при передозировке ряда лекарственных соединений: наркотиков, снотворных, препаратов, угнетающих сократительную функцию миокарда, холинолитиков, стимуляторов α-адренорецепторов.
Причиной развития отека легких могут быть блокаторы β-адренергических рецепторов, антихолинэстеразные средства.
Отек легких может возникать при анафилактическом шоке, быстром выведении асцитической жидкости.
Инициировать развитие отека легких могут препараты, задерживающие воду в организме (кортикостероиды, салицилаты, адреналин, производные пирозалона).
Действие вышеуказанных этиологических факторов приводит к инициации следующих разновидностей отека легких: мембранозного, гемодинамического, онкотического, лимфодинамического.
1. Мембранозный отек связан с деструкцией альвеолярно-капиллярной мембраны, повышением ее проницаемости под влиянием медиаторов воспаления и аллергии (гистамина, лейкотриенов, кининов, лизосомальных гидролаз, простагландинов, активных форм кислорода).
Повышение проницаемости альвеолярно-капиллярной мембраны возникает при тяжелых формах системной гипоксии, местных расстройствах кровообращения в легких в случаях тромбоза, эмболии, кровоизлияний, когда снижается продукция сурфактанта, а также при ирритантном воздействии токсических раздражающих веществ.
Через поврежденный эндотелий и базальную мембрану легочных сосудов перемещаются вода, электролиты, белки плазмы, форменные элементы крови в интерстиций легочной ткани.
2. Гемодинамический отек возникает при повышении гидродинамического давления в легочных капиллярах.
Прежде всего, необходимо остановиться на гемодинамических особенностях в системе малого круга кровообращения по сравнению с таковыми в большом кругу кровообращения.
Так, гидродинамическое давление в артериальном колене капилляров различных внутренних органов и тканях большого круга кровообращения в норме составляет 40 гПа (32 мм рт. ст.), а в легочных капиллярах – 3-14 гПА (2-11 мм рт. ст.). Таким образом, даже незначительное возрастание гидродинамического давления в сосудах легких приводит к усилению транссудации и является риском развития отека легких. Как известно, возрастание гидродинамического давления в легких может быть связано с увеличением притока крови, затруднением оттока или возрастанием внутрисосудистого сопротивления в легких.
В связи с этим легочная гипертензия может иметь гиперкинентическое (гипердинамическое), застойное или вазогенное происхождение.
В большинстве случаев в возрастании гидростатического давления играют роль все три механизма, включающиеся последовательно или одновременно.
Отек легких гипердинамического генеза развивается нередко в результате избыточной гемотрансфузии или внутривенного введения безбелковых соединений.
Перегрузка жидкостью обусловливает не только возрастание гидродинамического давления в легочных капиллярах, но и снижение коллоидно-осмотического давления в крови. Отек легких формируется при незначительном возрастании гидродинамического давления на 13-16 гПА (10-12 мм рт. ст.).
3. Онкотический отек связан с развитием гипопротеинемии. Как известно, основной силой, удерживающей жидкость в легочных капиллярах, является коллоидно-осмотическое давление крови. При уменьшении концентрации белков в крови на 47-50% развивается отек.
Следует отметить, что около 80% воды задерживается в сосудистом русле альбуминами, и уменьшение их содержания даже при стабильно-нормальном уровне общего белка является фактором риска развития отека легких.
4. Лимфодинамический отек наблюдается при блокаде лимфатического дренажа. У здорового человека отток лимфы составляет 15-20 мл/ч, по мере необходимости он может увеличиваться в 15 раз. При врожденном дефекте развития лимфатических сосудов, формировании лимфоэктазий, воспалении лимфатических сосудов или их компрессии затрудняется лимфоотток, и жидкость накапливается в легочной ткани.
Стадии развития отека легких и характер нарушения внешнего дыхания. Прогрессирующее течение отека легких характеризуется последовательным развитием трех стадий: интрамурального, интерстициального и альвеолярного отека.
1. Интрамуральная стадия характеризуется усилением гидратации альвеолярно-капиллярной мембраны и ее утолщением, что естественно приводит к ослаблению альвеолярного дыхания за счет снижения эффективного диффузного давления для кислорода и углекислоты.
2. Интерстициальная стадия связана с отеком соединительнотканных структур, а также периваскулярных, перибронхиальных пространств, межальвеолярных перегородок. Для этой стадии характерно накопление в легочной ткани биологически активных веществ клеточного и гуморального происхождения (гистамина, серотонина, гепарина, лейкотриенов, интерлейкинов), вызывающих массивное повреждение эндотелия микроциркуляторного русла и увеличение проницаемости сосудистой стенки. Через поврежденную стенку плазма выходит в интерстиций легочной ткани. На первых этапах жидкость не попадает в альвеолы вследствие работы компенсаторных механизмов: повышение интерстициального гидростатического давления увеличивает скорость тока жидкости от малорастяжимого перимикроваскулярного к более растяжимому бронховаскулярному интерстицию, в котором находятся терминальные лимфатические сосуды, впадающие в конечном итоге в центральную вену. По мере накопления отечной жидкости вокруг терминальных лимфатических сосудов ток легочной лимфы может возрастать в 15 раз, поддерживая тем самым баланс жидкости в легких.
Касаясь нарушений внешнего дыхания в эту стадию, следует отметить наличие в паренхиме легких высокопороговых быстроадаптирующихся юкстакапиллярных рецепторов n. vagus, реагирующих в условиях патологии на возрастание объема интерстициальной жидкости. Возникающая с этих рецепторов афферентация при интерстициальном отеке поступает по мало- и немиелинизированным чувствительным волокнам n. vagus в бульбарный инспираторный отдел дыхательного центра, что приводит к повышению их возбудимости и развитию тахипноэ.
5. Альвеолярный отек возникает, когда истощаются дренажные способности лимфатической системы, хотя они и превышают необходимый объем оттока лимфы примерно в 15 раз.
При интерстициальном отеке возникает компрессия кровеносных и лимфатических сосудов, бронхиол, что приводит к дальнейшему возрастанию гидростатического давления и усилению ультрафильтрации плазмы через альвеолярно-капиллярную мембрану в альвеолы.
Транссудат из интерстиция фильтруется в альвеолы, проходя между эпителиальными клетками, вымывает сурфактант, альвеолы спадаются, проницаемость альвеолярно-капиллярной мембраны еще более возрастает. Кроме того, транссудат поступает в альвеолы и воздухоносные пути, что усугубляет гипоксемию. Альвеолы заполняются транссудатом, богатым фибриногеном. Образующаяся фибриновая выстилка создает условия для формирования гиалиновых мембран. Под влиянием транссудата сурфактант смывается с поверхности альвеол и вызывает вспенивание транссудата в процессе вдыхания воздуха. Последнее приводит к эмболии воздухоносных путей, дальнейшему подавлению синтеза сурфактанта, развитию ателэктазов. Снижается объем оксигенированной крови из-за перфузии невентилируемых альвеол. Кровь, проходя через эти альвеолы, остается венозной и смешивается с кровью, прошедшей мимо альвеол с нормальной оксигенацией; развивается циркуляторная гипоксия.
Принципы патогенетической терапии отека легких включают использование:
1) симпатолитиков, траквилизаторов, анальгетиков;
2) спазмолитиков, сосудорасширяющих препаратов;
3) диуретиков и дегидрационных средств;
4) разгрузки малого круга кровообращения (сидячее положение, горячие ножные ванны, наложение жгута на конечности);
Отек легких – острая легочная недостаточность, связанная с массивным выходом транссудата из капилляров в легочную ткань, что приводит к инфильтрации альвеол и резкому нарушению газообмена в легких. Отек легких проявляется одышкой в покое, чувством стеснения в груди, удушьем, цианозом, кашлем с пенистой кровянистой мокротой, клокочущим дыханием. Диагностика отека легких предполагает проведение аускультации, рентгенографии, ЭКГ, ЭхоКГ. Лечение отека легких требует проведения интенсивной терапии, включающей оксигенотерапию, введение наркотических анальгетиков, седативных, мочегонных, гипотензивных средств, сердечных гликозидов, нитратов, белковых препаратов.
МКБ-10

Общие сведения
Отек легких – клинический синдром, вызванный выпотеванием жидкой части крови в легочную ткань и сопровождающийся нарушением газообмена в легких, развитием тканевой гипоксии и ацидоза. Отек легких может осложнять течение самых различных заболеваний в пульмонологии, кардиологии, неврологии, гинекологии, урологии, гастроэнтерологии, отоларингологии. При несвоевременности оказания необходимой помощи отек легких может быть фатальным.
Причины
Этиологические предпосылки отека легких многообразны. В кардиологической практике отеком легких могут осложняться различные заболевания сердечно-сосудистой системы: атеросклеротический и постинфарктный кардиосклероз, острый инфаркт миокарда, инфекционный эндокардит, аритмии, гипертоническая болезнь, сердечная недостаточность, аортит, кардиомиопатии, миокардиты, миксомы предсердия. Нередко отек легких развивается на фоне врожденных и приобретенных пороков сердца – аортальной недостаточности, митрального стеноза, аневризмы, коарктации аорты, открытого артериального протока, ДМПП и ДМЖП, синдрома Эйзенменгера.
В пульмонологии отеком легких может сопровождаться тяжелое течение хронического бронхита и крупозной пневмонии, пневмосклероза и эмфиземы, бронхиальной астмы, туберкулеза, актиномикоза, опухолей, ТЭЛА, легочного сердца. Развитие отека легких возможно при травмах грудной клетки, сопровождающихся синдромом длительного раздавливания, плевритом, пневмотораксом.
В некоторых случаях отек легких выступает осложнением инфекционных заболеваний, протекающих с тяжелой интоксикацией: ОРВИ, гриппа, кори, скарлатины, дифтерии, коклюша, брюшного тифа, столбняка, полиомиелита.
Отек легких у новорожденных может быть связан с тяжелой гипоксией, недоношенностью, бронхолегочной дисплазией. В педиатрии опасность отека легких существует при любых состояниях, сопряженных с нарушением проходимости дыхательных путей - остром ларингите, аденоидах, инородных телах дыхательных путей и пр. Аналогичный механизм развития отека легких наблюдается при механической асфиксии: повешении, утоплении, аспирации желудочного содержимого в легкие.
В нефрологии к отеку легких может приводить острый гломерулонефрит, нефротический синдром, почечная недостаточность; в гастроэнтерологии – кишечная непроходимость, цирроз печени, острый панкреатит; в неврологии - ОНМК, субарахноидальные кровоизлияния, энцефалит, менингит, опухоли, ЧМТ и операции на головном мозге.
Нередко отек легких развивается вследствие отравлений химическими веществами (фторсодержащими полимерами, фосфорорганическими соединениями, кислотами, солями металлов, газами), интоксикаций алкоголем, никотином, наркотиками; эндогенной интоксикации при обширных ожогах, сепсисе; острого отравления лекарственными средствами (барбитуратами, салицилатами и др.), острых аллергических реакций (анафилактического шока).
В акушерстве и гинекологии отек легких чаще всего связан с развитием эклампсии беременных, синдрома гиперстимуляции яичников. Возможно развитие отека легких на фоне длительной ИВЛ высокими концентрациями кислорода, неконтролируемой внутривенной инфузии растворов, торакоцентеза с быстрой одномоментной эвакуацией жидкости из плевральной полости.
Патогенез
Основные механизмы развития отека легких включают резкое увеличение гидростатического и снижение онкотического (коллоидно-осмотического) давления в легочных капиллярах, а также нарушение проницаемости альвеолокапиллярной мембраны.
Начальную стадию отека легких составляет усиленная фильтрация транссудата в интерстициальную легочную ткань, которая не уравновешивается обратным всасыванием жидкости в сосудистое русло. Эти процессы соответствуют интерстициальной фазе отека легких, которая клинически проявляется в виде сердечной астмы.
Дальнейшее перемещение белкового транссудата и легочного сурфактанта в просвет альвеол, где они смешиваются с воздухом, сопровождается образованием стойкой пены, препятствующей поступлению кислорода к альвеолярно-капиллярной мембране, где происходит газообмен. Данные нарушения характеризуют альвеолярную стадию отека легких. Возникающая в результате гипоксемии одышка способствует снижению внутригрудного давления, что в свою очередь усиливает приток крови к правым отделам сердца. При этом давление в малом круге кровообращения еще больше повышается, а пропотевание транссудата в альвеолы увеличивается. Таким образом, формируется механизм порочного круга, обусловливающий прогрессирование отека легких.
Классификация
С учетом пусковых механизмов выделяют кардиогенный (сердечный), некардиогенный (респираторный дистресс-синдром) и смешанный отек легких. Термином некардиогенный отек легких объединяются различные случаи, не связанные с сердечно-сосудистыми заболеваниями: нефрогенный, токсический, аллергический, неврогенный и другие формы отека легких.
По варианту течения различают следующие виды отека легких:
- молниеносный – развивается бурно, в течение нескольких минут; всегда заканчиваясь летальным исходом
- острый – нарастает быстро, до 4-х часов; даже при немедленно начатых реанимационных мероприятиях не всегда удается избежать летального исхода. Острый отек легких обычно развивается при инфаркте миокарда, ЧМТ, анафилаксии и т. д.
- подострый – имеет волнообразное течение; симптомы развиваются постепенно, то нарастая, то стихая. Такой вариант течения отека легких наблюдается при эндогенной интоксикации различного генеза (уремии, печеночной недостаточности и др.)
- затяжной – развивается в период от 12 часов до нескольких суток; может протекать стерто, без характерных клинических признаков. Затяжной отек легких встречается при хронических заболеваниях легких, хронической сердечной недостаточности.
Симптомы отека легких
Отек легких не всегда развивается внезапно и бурно. В некоторых случаях ему предшествуют продромальные признаки, включающие слабость, головокружение и головную боль, чувство стеснения в грудной клетке, тахипноэ, сухой кашель. Эти симптомы могут наблюдаться за несколько минут или часов до развития отека легких.
Клиника сердечной астмы (интерстициального отека легких) может развиваться в любое время суток, однако чаще это происходит ночью или в предутренние часы. Приступ сердечной астмы может провоцироваться физической нагрузкой, психоэмоциональным напряжением, переохлаждением, тревожными сновидениями, переходом в горизонтальное положение и др. факторами. При этом возникает внезапное удушье или приступообразный кашель, вынуждающие больного сесть. Интерстициальный отек легких сопровождается появлением цианоза губ и ногтей, холодного пота, экзофтальма, возбуждения и двигательного беспокойства. Объективно выявляется ЧД 40-60 в минуту, тахикардия, повышение АД, участие в акте дыхания вспомогательной мускулатуры. Дыхание усиленное, стридорозное; при аускультации могут выслушиваться сухие свистящие хрипы; влажные хрипы отсутствуют.
На стадии альвеолярного отека легких развивается резкая дыхательная недостаточность, выраженная одышка, диффузный цианоз, одутловатость лица, набухание вен шеи. На расстоянии слышно клокочущее дыхание; аускультативно определяются разнокалиберные влажные хрипы. При дыхании и кашле изо рта пациента выделяется пена, часто имеющая розоватый оттенок из-за выпотевания форменных элементов крови.
При отеке легких быстро нарастает заторможенность, спутанность сознания, вплоть до комы. В терминальной стадии отека легких АД снижается, дыхание становится поверхностным и периодическим (дыхание Чейна-Стокса), пульс – нитевидным. Гибель больного с отеком легких наступает вследствие асфиксии.
Диагностика
Кроме оценки физикальных данных, в диагностике отека легких крайне важны показатели лабораторных и инструментальных исследований. Все исследования выполняются в кратчайшие сроки, иногда параллельно с оказанием неотложной помощи:
- Исследование газов крови. При отеке легких характеризуется определенной динамикой: на начальном этапе отмечается умеренная гипокапния; затем по мере прогрессирования отека легких PaO2 и PaCO2 снижается; на поздней стадии отмечается увеличение PaCO2 и снижение PaO2. Показатели КОС крови свидетельствуют о респираторном алкалозе. Измерение ЦВД при отеке легких показывает его увеличение до 12 см. вод. ст. и более.
- Биохимический скрининг. С целью дифференциации причин, приведших к отеку легких, проводится биохимическое исследование показателей крови (КФК-МВ, кардиоспецифических тропонинов, мочевины, общего белка и альбуминов, креатинина, печеночных проб, коагулограммы и др.).
- ЭКГ и ЭхоКГ. На электрокардиограмме при отеке легких часто выявляются признаки гипертрофии левого желудочка, ишемия миокарда, различные аритмии. По данным УЗИ сердца визуализируются зоны гипокинезии миокарда, свидетельствующие о снижении сократимости левого желудочка; фракция выброса снижена, конечный диастолический объем увеличен.
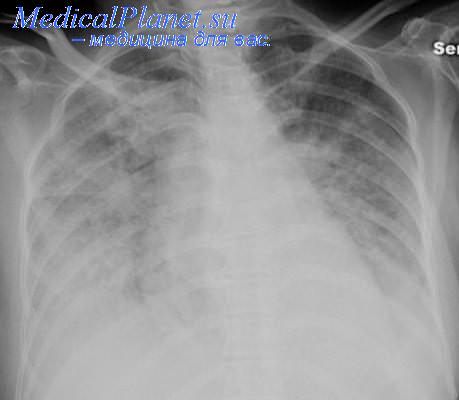
- Рентгенография органов грудной клетки. Выявляет расширение границ сердца и корней легких. При альвеолярном отеке легких в центральных отделах легких выявляется однородное симметричное затемнение в форме бабочки; реже - очаговые изменения. Возможно наличие плеврального выпота умеренного или большого объема.
- Катетеризация легочной артерии. Позволяет провести дифференциальную диагностику между некардиогенным и кардиогенным отеком легких.

Лечение отека легких
Лечение отека легких проводится в ОРИТ под постоянным мониторингом показателей оксигенации и гемодинамики. Экстренные мероприятия при возникновении отека легких включают:
- придание больному положения сидя или полусидя (с приподнятым изголовьем кровати), наложение жгутов или манжет на конечности, горячие ножные ванны, кровопускание, что способствует уменьшению венозного возврата к сердцу.
- подачу увлажненного кислорода при отеке легких целесообразнее осуществлять через пеногасители – антифомсилан, этиловый спирт.
- при необходимости - перевод на ИВЛ. При наличии показаний (например, для удаления инородного тела или аспирации содержимого из дыхательных путей) выполняется трахеостомия.
- введение наркотических анальгетиков (морфина) для подавления активности дыхательного центра.
- введение диуретиков (фуросемида и др.) с целью снижения ОЦК и дегидратации легких.
- введение нитропруссида натрия или нитроглицерина с целью уменьшения постнагрузки.
- применение ганглиоблокаторов (азаметония бромида, триметафана) позволяет быстро снизить давление в малом круге кровообращения.
По показаниям пациентам с отеком легких назначаются сердечные гликозиды, гипотензивные, антиаритмические, тромболитические, гормональные, антибактериальные, антигистаминные препараты, инфузии белковых и коллоидных растворов. После купирования приступа отека легких проводится лечение основного заболевания.
Прогноз и профилактика
Независимо от этиологии, прогноз при отеке легких всегда крайне серьезен. При остром альвеолярном отеке легких летальность достигает 20-50%; если же отек возникает на фоне инфаркта миокарда или анафилактического шока, смертность превышает 90%. Даже после благополучного купирования отека легких возможны осложнения в виде ишемического поражения внутренних органов, застойной пневмонии, ателектазов легкого, пневмосклероза. В том случае, если первопричина отека легких не устранена, высока вероятность его повторения.
Благоприятному исходу в немалой степени способствует ранняя патогенетическая терапия, предпринятая в интерстициальной фазе отека легких, своевременное выявление основного заболевания и его целенаправленное лечение под руководством специалиста соответствующего профиля (пульмонолога, кардиолога, инфекциониста, педиатра, невролога, отоларинголога, нефролога, гастроэнтеролога и др.).
2. Клиническая фармакология и фармакотерапия в реальной врачебной практике: мастер-класс: учебник / Петров В. И. – 2011.
Переборов сопротивление ослабленных ресничек, возбудитель попадает в носоглотку и поддается действию высокоактивного секрета клеток. Белки секрета слизистых желез способны неспецифически ингибировать гемагглютинирующую и инфекционную активность вируса гриппа. Это действие обусловлено наличием в секрете гликопротеидов, которые содержат значительное количество N-ацетилнейраминовой кислоты. Существуют сезонные колебания содержания ингибиторов. Наиболее активны они в летне-осенний период, а в период эпидемии гриппа (зима) содержание ингибиторов снижается. Погибшие клетки отрываются и захватываются макрофагами, а также удаляются с секретом дыхательных путей. В подслизистом слое в результате высвобождения биологически активных веществ (гистамин, серотонин, кинины, простагландины) возникает реакция сосудов, форменных элементов крови, образование мелких тромбов и кровоизлияний, диапедез мо-нонуклеаров и нейтрофильных лейкоцитов, отек, местные нарушения метаболизма, изменения рН среды в кислую сторону и тому подобное. При этом патологический воспалительный процесс наиболее выражен в трахее и бронхах.
Наличие токсикоза при гриппе является существенной особенностью патогенеза. Симптомы интоксикации являются следствием резорбции токсичных субстанций вирусов, продуктов нарушенного обмена веществ, что прямо или опосредованно влияет на органы и системы. Вирус обладает токсическим действием на сосудистую систему, значительно повышая проницаемость и ломкость сосудов, что в комплексе с расстройствами микроциркуляции может приводить к развитию геморрагического синдрома. В возникновении циркуляторных расстройств, кроме прямого действия на сосудистую стенку, большое значение имеет нейротропность вируса. Характерны фазовые повреждения вегетативной нервной системы, касающиеся двух ее частей (симпатической и парасимпатической): гипертензия изменяется гипотензией, тахикардия — брадикардией, повышается секреция слизи в дыхательных путях, появляется потливость.
Проникая в более глубокие слои эпителия, вирус встречается со второй линией специфической обороны (интерферон, циркулирующие антитела классов IgM, IgG, IgE, температурная реакция). Механизмы иммунного ответа при гриппе представлены на рис. 3.
Рис. 3. Механизмы иммунного ответа при гриппе
При гриппе в ответ на инфицирование развиваются ранние цитокиновые реакции (РЦР) как наиболее быстрый ответ на вирус. Здесь мы имеем дело с естественным (врожденным) и наиболее распространенным вариантом РЦР на вирус гриппа как на внутриклеточного паразита, когда вирус сам включает систему интерферона, играя роль природного индуктора.
Каскад внутриклеточных событий, который наблюдается после внедрения вируса, обусловлен индукцией образования ИФН и в последующем разрушением вирусных информационных РНК, благодаря действию 2'-5'-олигоаденилсинтетазы и активации эндонуклеазы. Параллельно активированная протеинкиназа фосфорилирует а-субъединицу фактора, который инициирует трансляцию, что приводит к блокировке синтеза вирусных белков. Все это приводит к угнетению репродукции широкого спектра РНК и ДНК-содержащих вирусов за счет прямого внутриклеточного антивирусного эффекта. Эти явления происходят в течение первых часов после проникновения вируса гриппа в организм.
Интерфероны (в первую очередь ИФН-b или так называемые интерфероны I типа) имеют способность к активации естественных киллеров (ЕК) и цитотоксических лимфоцитов. В результате на этом этапе вирусного инфицирования локально осуществляются три взаимосвязанных действия:
- внутриклеточная ингибиция интерферонами репродукции вирусов;
- удаление посредством ЕК и ЦТЛ инфицированного материала;
- защита вновь образованным интерфероном окружающих незараженных клеток от возможного заражения.
Интерферон распределяется по организму, связывается со специфическими рецепторами здоровых неповрежденных клеток и делает их невосприимчивыми к вирусу. С интерферонсвязанных неинфицированных клеток вокруг очага вирусной инфекции образуется заслон для последующего распространения инфекции. Кроме того, интерферон активирует почти все иммунные реакции (модуляция взаимосвязи между эндокринной и иммунной системами, активация макрофагов, повышение цитотоксичности, стимуляция экспрессии антигенов ГКГ I и II классов).
Однако описанные эффекты ИФН нередко являются недостаточными для завершения инфекционного процесса. Подобное имеет место при сниженном сопротивлении организма, дефектности системы ИФН и иммунитета, неблагоприятной экологической ситуации, действии стрессов и др.
В итоге развивается острое заболевание, которое сопровождается продукцией каскада ранних цитокинов (второй этап РЦР), активацией CD4+ и CD8+ Е-клеток с последующим развитием специфического, опосредствованного Т- и В-клеточного иммунитета. В этих случаях кроме ИФН 1-го типа синтезируются такие ранние цитокины, как фактор некроза опухоли, образуются интерлейкины (IL) 1b, 6, 10 и 15, а также трансформирующий фактор роста (TGF). На этом этапе уже отмечается вариабельность РЦР при разных вирусных инфекциях. Продукция ИФН-b считается ключевым доминантным признаком инфицирования вирусом.
ИФН а/b вызывает лейкопению, лимфаденопатию, миграцию клеток из красной пульпы селезенки в белую пульпу, то есть происходит перераспределение клеток для последующих иммунорегуляторных эффектов. ИФН а/b могут усилить специфический иммунный ответ при гриппе в период первичной инфекции за счет притягивания популяции В- и Е-клеток в места воспаления для антигенной презентации.
Первыми на инфекцию начинают реагировать макрофаги, в них происходит расщепление вирусной частицы на отдельные пептиды, которые продвигаются к поверхности клетки, здесь (на мембране макрофага) они контактируют с молекулами ГКГ I и II классов. ИФН, который секретируется ИЛ-1, усиливает экспрессию антигена ГКГ. Выраженное синергичное действие ИЛ-1 и ИЛ-2 способствует пролиферации предшественников Т-клеток в вилочковой железе. В очаг инфекции направляются Т-лимфоциты (хелперы), которым и предоставляются фрагменты антигена в комплексе с молекулами ГКГ. В активации Т-хелперов принимают участие ИЛ-4, ИЛ-6 и ФНО. Возможна ситуация, когда Т-лимфоциты способны непосредственно связывать вирусные антигены при участии антигенов II класса ГКГ. Потом подключаются ЦТЛ и NK-клетки, которые являются основными факторами ликвидации инфицированных вирусом клеток. Но роль CD8+ ЦТЛ двойственна: с одной стороны, они более эффективно по сравнению с другими субпопуляциями элиминируют вирус из отделов нижних дыхательных путей, с другой — усиливают реакции локального воспаления, вызывая в эксперименте синдром респираторного дистресс-синдрома. Результатом этого взаимодействия может стать победа вируса, тогда макроорганизм подключает факторы гуморального иммунитета (местного и общего).
Основу специфического местного иммунитета составляет секреторный IgA. В его синтезе принимают участие клетки реснитчатого эпителия, макрофаги, Т-лимфоциты, клетки секреторного эпителия. Макрофаги, локализованные в пространствах между эпителиальными клетками, захватывают обломки разрушенных вирусом клеток, метаболизируют их. Антигены, подготовленные макрофагами, активизируют Т- и В-лимфоциты, которые превращаются в плазмоциты, продуцируют антитела класса IgA. Выполняя важные эффекторные функции, IgA играет роль молекулы, которая регулирует функции клеток иммунной системы, в частности альвеолярных макрофагов, несущих рецепторы к Fc-фрагменту этого Ig. Так, иммунные комплексы, которые содержат антитела класса А, индуцируют в моноцитах-макрофагах синтез ФНО-а и СЗ-комплемента С. Секреторные IgA связывают вирус и препятствуют его выходу из организма в активной форме, что ограничивает циркуляцию вируса среди людей.
При первой встрече с вирусом через 3-5 дней образуются антитела класса IgM. Повышение их содержания свидетельствует об остроте инфекционного процесса. Высокое содержание Ig в крови является показателем устойчивости организма к инфекции. IgE — единственный тип антител, который вступает во взаимодействие с мембраной тучных клеток (в клинической картине наблюдаются приступы бронхоспазма).
Иммунные механизмы при первичной встрече с вирусом запоминаются организмом в виде информации, заложенной в клетки памяти (иммунологическая память), и при повторной встрече с вирусом той же антигенной разновидности иммунные реакции протекают быстрее и более эффективно. Создание иммунной памяти об антигене является целью применения вакцин. С их помощью создается и поддерживается защитная концентрация противогриппозных антител. Антитела, вступая во взаимосвязь с антигеном, образуют иммунные комплексы. Иногда вместе с защитными функциями они могут стать причиной тяжелых иммунопатологических состояний. Циркулируя по всему организму, они оседают в тканях, вызывая воспалительные реакции в капиллярах клубочков почек и синовиальных оболочек суставов. Частично вирус из организма выделяется почками, что, возможно, и обусловливает тот факт, что в эпителии дистальных канальцев, как и в эндотелии капилляров клубочков, оказывается значительное количество антигена вируса. Почками также выделяются иммунные комплексы, фрагменты клеток, что приводит к сенсибилизации тканей почки и впоследствии, через несколько недель и даже месяцев после перенесенного заболевания, может послужить причиной возникновения гломерулонефрита. Инициатором в этом случае может быть фактор, который имеет антигенную природу (например, переохлаждение).
Находясь в окружении антител, вирус может сохранять свою структуру и при разрушении комплекса опять поражать чувствительные клетки. Длительная циркуляция комплексов приводит к инфицированию все большего количества клеток, к поддержке инфекции и к персистенции. В данное время не исключается возможность длительной персистенции вируса гриппа в ЦНС по типу медленной инфекции с развитием впоследствии такого патологического состояния, как паркинсонизм. Это изменяет представление о гриппе как об острой инфекции. Установлено, что в 50% случаев антиген вируса гриппа сохраняется в периферических лимфоидных клетках и в крови до 120-200 и более дней.
При гриппе роль антигена могут играть не только структура вируса, но и измененные вирусом структуры клеток, и уже к ним синтезируются антитела, с которыми начинают вступать во взаимодействие нормальные клетки, в результате чего возникает угроза развития аутоиммунопатологического состояния.
Изменения во внутренних органах однотипны, обусловлены генерализованной вазодилятациеи. При массивной вирусемии, которая быстро развивается в первые часы болезни, может возникнуть инфекционно-токсический шок с развитием сердечно-сосудистой недостаточности. В его основе лежат несколько факторов: сосудистый (непосредственное действие вируса на сосуды с повышением их проницаемости, вазодилятациеи), геморрагический синдром с повреждением надпочечников и дефицитом гормонов, нарушение функции миокарда. У таких больных смерть может наступить в ближайшие часы от начала заболевания.
В результате токсического повреждения сосудистого аппарата ЦНС наступает гиперсекреция спинномозговой жидкости, нарушается ликвородинамика, что приводит к повышению внутричерепного давления, может наступить отек мозга. Чаще все-таки повреждаются мягкие мозговые оболочки, сосудистое сплетение, где можно выявить антигены вируса гриппа.
Инфекционно-алергический процесс после перенесенной гриппозной инфекции может возникнуть также в эндокарде. Изменения в миокарде, определенные на ЭКГ как миокардиодистрофия, обусловлены токсикозом и циркуляторными расстройствами.
В патогенезе отека легких имеют значение много факторов: нарушения гемодинамики, связанные с токсикозом, воспалительные процессы в бронхах и легких, снижение сократительной функции левого желудочка, что чаще развивается у лиц с сопутствующими заболеваниями сердечно-сосудистой системы. Необходимо подчеркнуть, что начальные стадии отека легких, на которых повреждается интерстициальная ткань, определяются лишь рентгенологически в виде нерезких, расплывчатых теней, которые сливаются и распространяются от корней к периферии легочных полей.
В механизмах устойчивости организма к генетически инородной информации принимают участие два основных феномена: наследственная резистентность и приобретенный иммунитет:
- природная видовая наследственная резистентность, связанная с врожденной стойкостью организма, которая развивается с возрастом, к возбудителям инфекций, основанная на отсутствии чувствительных клеток или повышении их резистентности к репродукции вируса, а также на их биологической инактивации при участии интерферона, фагоцитарных факторов, нормальной температуры тела или неспецифических ингибиторов крови;
- приобретенный иммунитет создается после болезни или искусственной иммунизации вакцинами.
Приобретенный иммунитет опирается на формирование местной секреторной защиты. Секреторный иммунитет предупреждает или смягчает тяжесть заболевания во входных воротах гриппозной инфекции при участии антител класса IgA, которые синтезированы в процессе кооперации между В-лимфоцитами и эпителиальными клетками. Секреторные антитела избирательно адсорбируются на поверхности клеток мерцательного эпителия, эффективно защищая их от инвазии вируса.
Длительность противогриппозного иммунитета ограничена не дву-мя-тремя годами, как это считалось бесспорным до 1977 г. (в этот год особенно тяжело болели молодые люди, рожденные после 1957 г., когда вирус A (H1N1) исчез из циркуляции и появился снова в 1977 г.). В случае возвращения к активной циркуляции уже известного подтипа через 20 и более лет — выявляется сохранение специфической невосприимчивости к возбудителю, который вернулся, у части населения, которая контактировала с ним раньше. Такая длительная иммунологическая память обусловлена, конечно, не антителами (их титры в крови падают ниже защитного порога через 6-12 месяцев, а в секрете дыхательных путей — еще быстрее). Длительный постинфекционный иммунитет обеспечивают клеточные механизмы (Т- и В-лимфоциты), в том числе местные, во входных воротах возбудителя инфекции. Существует четко выраженная корреляция невосприимчивости к гриппу с концентрацией антител в крови (в основном IgG) и в секрете дыхательных путей (IgA). Однако в частных случаях гриппом могут заболеть люди с высоким исходным уровнем гуморального иммунитета и не заболевают инфицированные лица с низким начальным титром антител. Такие примеры подчеркивают сложность и многогранность иммунной защиты организма, где роль отдельных факторов интегрирована в общем результате.
Между специфическими механизмами противогриппозного иммунитета существует распределение защитных функций:
- секреторные антитела, которые подавляют репродукцию вируса во входных воротах инфекции, обеспечивают противоэпидемическую защиту, направленную на ограничение рассеивания и передачи возбудителя от инфицированных лиц здоровому окружению; в связи с широким диапазоном нейтрализующего эффекта секреторные антитела способны подавлять любые антигенные варианты вируса гриппа А в пределах своего подтипа;
- сывороточные антитела нейтрализуют токсичные продукты вируса и регулируют клиническую тяжесть болезни;
- клеточно-обусловленные факторы иммунитета устраняют резервуар вируса в инфицированных клетках, малодоступных влиянию антител.
Напряженность противовирусного иммунитета зависит от уровня циркулирующих антител и образования цитотоксических лимфоцитов. Цитотоксические лимфоциты вызывают лизис инфицированных вирусом клеток.
Повторное заболевание гриппом обусловлено высокой изменчивостью вируса гриппа и формированием иммунитета только к конкретному штамму, что и объясняет необходимость ежегодной вакцинации.
Патогенез отека легких. Механизмы отека легких.
Основные патофизиологические механизмы отека легких заключаются в следующем.
Рост гидростатического давления в капиллярах легких (в норме- 8 мм рт. ст.), превышающий коллоидно-осмотическое давление плазмы (в норме — 28 мм рт. ст.) и приводящий к перемещению жидкости, богатой белками, из капилляров в интерстициальное пространство и просвет альвеол. Но уровень этого давления четко не коррелирует с тяжестью ОЛ.
• рост давления в легочных венах: окклюзия легочных вен, фиброзирующий медиастинит;
• рост отрицательного давления в интерстиции легких (вследствие быстрого купирования пневмоторакса, тяжелой обструкции дыхательных путей в период тяжелого приступа БА).
Клинико-физиологические ситуации, сопровождающиеся уменьшением онкотического давления крови (менее или равном 15 мм рт. ст.): выраженная гипопротеинемия (но в одиночку она не вызывает развития ОЛ) при истощении, печеночной или почечной недостаточности либо обильной кровопотере.
Малоизвестные факторы: высокогорный (при быстром подъеме на высоту в 3000—4000 м над уровнем моря, из-за вазоконстрикторной реакции на высотную гипоксию), нейрогенный или ОЛ вследствие ТЭЛА, передозировки общих анестетиков, наркотиков, длительного наркоза, интоксикации алкоголем.
Реже причинами отека легких являются: прием больших доз АБ, симпатомиметиков, барбитуратов, салицилатов. В большинстве случаев ОЛ имеется комбинация этих механизмов.
Больные с некардиогенным отеком легких в сознании обычно жалуются на затруднение дыхания (одышку), кашель, боли в грудной клетки, не связанные с поражением плевры. Объективно выслушиваются влажные хрипы; определяются цианоз, гипоксемия, гиперкапния и ацидоз (по данным КЩС), рентгенологически — нормальные размеры, контуры сердца и отсутствие линий Керли. Признаков ОЛЖН и системной объемной перегрузки также нет. В случае сомнений показан замер ДЗЛА путем постановки катетера Сван—Ганца. Если ДЗЛА нормальное, то это свидетельствует о том, что ОЛ не связан с патологией сердца.
- Вернуться в оглавление раздела "Кардиология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Отек легких. Виды отека легких.
Патогенез отека легких различается в зависимости от причины его возникновения: выделяют кардиогенный и некардиогенный отек легких.
Кардиогенный отек легких. Этиология кардиогенного отека легких характеризуется большой и разнообразной группой заболеваний, при которых в патологический процесс вовлекается сердце. Эти болезни объединяет одно из трех необходимых гемодинамических условий:
• нарушения систолы левого предсердия;
• систолическая и
• диастолическая дисфункция.
Дисфункция левого желудочка является наиболее частой причиной развития кардиогенного отека легких. Кардиогенный отек легких обусловлен острой недостаточностью левого сердца с застоем крови в легких и развивается в результате острой недостаточности кровообращения у больных ИБС, в том числе при инфаркте миокарда, пороках сердца (чаще при митральном стенозе), артериальной гипертензии различного происхождения.
Особым является отек легких при резком повышении давления в легочной артерии, при тромбоэмболии в легких с развитием гиперперфузии части легочной ткани.
Доказательством связи отека легких с сердечной недостаточностью может быть повышение легочного капиллярного давления выше 30 мм рт. ст.
Некардиогенный (внесердечный) отек легких может быть обусловлен рядом заболеваний, протекающих с нарушение проницаемости альвеолярно-капиллярной мембраны. К ним относятся пневмонии бактериального и вирусного происхождения, вдыхание токсических газов, аспирация содержимого желудка, ДВС, острый геморрагический панкреатит, шоковое легкое при травме. Изредка некардиогенный отек может развиться при выраженной гипоальбуминемии в результате заболеваний почек, печени, энтеропатии. По общим клиническим признакам часто бывает трудно разграничить эти две формы отека легких, и поэтому необходимо:
• Учитывать историю заболевания или заболеваний, предшествующих возникновению отека легких.
• Выполнить определенную программу обследования, включая методы прямого измерения центральной гемодинамики.
• Провести оценку ишемии миокарда (определить ферменты, при возможности зарегистрировать ЭКГ).
• Важным этапом в обследовании больного является рентгенография органов грудной клетки (фаза интерстициального или альвеолярного отека легких, скопление жидкости в плевральной полости, изменение размеров сердца).
• Высокоспецифическим тестом в дифференциации некардиогенного отека легких является измерение давления заклинивания. Если оно превышает 18 мм рт. ст., то речь идет о развитии кардиогенного отека легких. Если давление заклинивания в пределах физиологической нормы или даже ниже, то можно говорить о преобладании механизма повышенной сосудистой проницаемости, т.е. о развитии респираторного дистресс-синдрома. Типичными для не-кардиогенного отека легких являются нормальные показатели сердечного выброса и давления заклинивания.
• В плановом порядке исключить признаки почечной и печеночной недостаточности.
Для адекватной терапии важно выделять ведущий патогенетический фактор при различных заболеваниях.
Так, при заболеваниях сердечно-сосудистой системы (гипертоническая болезнь или симптоматические гипертензии, инфаркт миокарда с гиперкинетическим типом гемодинамики, миокардит, пороки сердца, тяжелые расстройства сердечного ритма) и остром повышении внутричерепного давления любого генеза ведущим патогенетическим фактором является перевозбуждение симпатико-адреналовой системы.
При заболеваниях легких причина отека легких - повышение легочного сосудистого сопротивления и нарушение механики дыхания с развитием альвеолярной гипоксии или чрезмерного снижения внутригрудного давления, значительное нарушение лимфооттока. Некоторый избыток интерстициальной жидкости может удаляться через лимфатическую систему легких, и поэтому ее патология (при карциноматозе, различных фиброзах) также может приводить к явлениям отека легких.
При заболевании почек в происхождении отека легких, помимо кардиогенной причины, имеет значение повышенная проницаемость сосудистой стенки, снижение онкотического давления крови.
При аллергических состояниях (анафилактическом шоке) причиной быстрого формирования массивного отека легких является резкое увеличение концентрации циркулирующего гистамина и серотонина. Большую роль играет и выраженная альвеолярная гипоксия (следствие бронхоспазма или отека языка и гортани). Альвеолярный отек легких в комбинации с астмоподобной одышкой встречается, например, при ингаляции аэрозолей пенициллина.
При острых инфекционных заболеваниях острая сердечная недостаточность обычно комбинируется с сосудистой недостаточностью, что крайне затрудняет правильную оценку состояния больного. При этом основными причинами отека легких являются инфекционно-токсическое воздействие на сосуды легких и альвеоляр-но-капиллярные мембраны, а также сопутствующее поражение сердечной мышцы.
Патогенетическая особенность неврогенного отека легких (черепно-мозговая травма, инсульты, после эпилептического приступа, субарахноидальное кровоизлияние) состоит в том, что в нем участвуют центральные механизмы ствола головного мозга. Патогенез неврогенного отека мозга вобрал в себя механизмы как кар-диогенного, так и некардиогенного отека легких.
Возможно развитие отека легких при мозговых расстройствах, передозировке наркотиков (особенно героина), при эклампсии, после кардиоверсии, общего наркоза, операции с искусственным кровообращением.
Отек легких может развиваться у практически здоровых лиц - в этом случае следует в первую очередь подумать о сердечной патологии.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

