Репликации днк-содержащих ретроидных вирусов
Обновлено: 11.05.2024
Репликация вирусных ДНК. Механизм репликации вирусных молекул ДНК.
Синтез геномной вирусной ДНК в принципе не отличается от синтеза клеточной ДНК. У разных вирусов это происходит с использованием разных механизмов. Известно, что клеточные ДНК-полимеразы могут начинать синтез новой цепи ДНК только с короткого праймера.
Для решения этой проблемы ДНК-вирусы разных семейств пользуются различной стратегией. Одни из них имеют циркулярный ДНК-геном, другие —линейный геном с комплементарными концами, у третьих имеется белковый праймер на 5'-конце.
Для репликации вирусной ДНК необходимы некоторые кодируемые вирусом ферменты: геликаза (с АТФазной активностью), чтобы расплести двойную спираль; белок, дестабилизирующий двойную спираль до тех пор, пока каждая из нитей не будет скопирована; ДНК-полимераза для копирования каждой цепи в направлении от 5'-конца к З'-концу; РНКаза для разрушения РНК-праймера после его функционирования; ДНК-лигазы для соединения ДНК-фрагментов, если она синтезируется не целиком. Часто один большой фермент обладает двумя и более активностями.
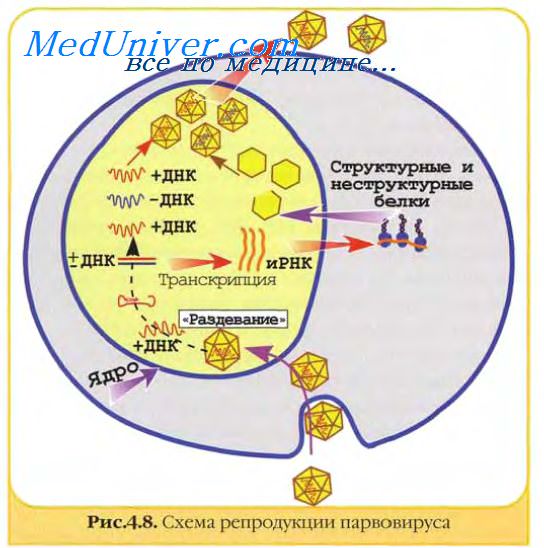
Геном парвовирусов использует для своей репликации клеточные ферменты, включая ДНК-полимеразу А. Ранний вирусный белок присоединяется к месту регуляторной последовательности вирусного генома и начинается репликация ДНК.
Происходит непрерывный и прерывистый синтез, соответственно, двух растущих цепей ДНК: главной и ответвляющейся. Прерывистый синтез ответвляющейся цепи связан с повторяющимися короткими олигонуклеотидными праймерами, поочередно рождающими короткие цепи ДНК (фрагменты Оказаки), которые затем соединяются ковалентно индуцированной вирусом ДНК-лигазой в одну растущую цепь.
Инициирующими единицами репликации папиллома- и полиомавирусов являются ковалентно связанные циркулярные (±)ДНК и линейные (±)ДНК адено- и герпесвирусов. Праймером синтеза аденовирусной ДНК служит предшественник белка, ковалентно связанный с вирионной ДНК. Репликация ДНК происходит непрерывно от 5'-конца к 3'-концу с использованием вирионной ДНК полимеразы. Синтез фрагментов Оказаки не происходит. Герпесвирусы кодируют большинство (если не все) белков, необходимых для репликации ДНК, включая ДНК-полимеразу, геликазу, праймазу, белок, соединяющий одноцепочечные ДНК, и белок, различающий начало репликации.
Вирусы оспы и асфаравирусы, которые размножаются целиком в цитоплазме, являются самодостаточными по механизму репликации. Гепаднавирусы, подобно ретровирусам, используют положительно полярные одноцепочечные РНК транскрипты в качестве посредников в синтезе ДНК с помощью обратной транскрипции. Синтез вирусной ДНК может происходить как в цитоплазме, так и в ядре зараженной клетки. Например, ДНК вирусов оспы синтезируется в цитоплазме, а ДНК герпес-, адено-, папиллома-, полиома- и парвовирусов — в ядре.
Делеция значительного количества генов (~ 40%) у оспо- и герпесвирусов не оказывает существенного влияния на их размножение в культуре клеток, возможно, что они важны для выживания этих вирусов в природе.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
ДНК-вирусы. Этапы репликации вирусов с ДНК геномом.
Оспо-, асфаро- и иридовирусы имеют вирионную транскриптазу (ДНК-зависимую РНК-полимеразу) и размножаются в цитоплазме. Их очень большие геномы кодируют многочисленные ферменты, которые делают их репликацию независимой от клеточного ядра. Моноцистронные мРНК транскрибируются непосредственно на вирусной ДНК.
После разрушения наружной оболочки вириона клеточными ферментами на вирусной ДНК с помощью вирионной ДНК-зависимой РНК-полимеразы синтезируются ранние мРНК. Они транслируются в вирусные белки с помощью которых вирионная ДНК полностью освобождается от белка и реплицируется по полуконсервативному механизму. Вначале синтезируются фрагменты ДНК (фрагменты Оказаки), которые затем соединяются с образованием зрелых вирусных ДНК.
Поздние моно- и полицистронные мРНК транскрибируются после начала репликации вирусной ДНК и кодируют синтез структурных белков вириона. Иридовирусы и асфаровирусы, по-видимому, обладают сходной с вирусами оспы стратегией репликации.
Герпес-, адено-, папиллома и полиомавирусы в одном отношении имеют общую стратегию репликации: вирусная ДНК транскрибируется в ядре клеточной ДНК-зависимой РНК-полимеразой II. В течение определенного промежутка времени проходит два или более циклов транскрипции различных генных единиц (групп генов под контролем одного промотора). Субгеномные полицистронные РНК-транскрипты подвергаются расщеплению и сплайсингу, превращаясь в моноцистронные мРНК.
У папиллома- и полиомавирусов транскрипционная программа состоит по крайней мере из двух циклов (ранние и поздние мРНК), а у герпес- и аденовирусов по крайней мере из трех (сверхранние, ранние и поздние мРНК). В каждом случае вирионные полипептиды синтезируются на мРНК, появляющейся в последнем цикле транскрипции (поздние мРНК). ДНК аденовирусов, папиллома- и полиомавирусов может встраиваться в геном клетки-хозяина, реплицироваться вместе с ним, передаваться дочерним клеткам и транслироваться с образованием вирусных белков.
Парво- и цирковирусы, обладающие оцДНК, реплицируются в ядре. Эти вирусы используют клеточные ДНК-полимеразы для синтеза двуспиральной ДНК, которая затем транскрибируется в ядре клеточной ДНК-зависимой РНК-полимеразой II. Синтезированные транскрипты подвергаются сплайсингу и превращаются в мРНК.
Вирионная ДНК служит матрицей для синтеза (+) и (-)ДНК. Последние включаются в вирионы в качестве генома.
Различают недефектные (автономные) и дефектные парвовирусы. Первые размножаются самостоятельно, тогда как вторые реплицируются только в присутствии вируса-помощника, которым является любой аденовирус или вирус простого герпеса. В связи с этим дефектные парвовирусы называют аденоассоциированными вирусами (ААВ). В вирионах недефектных парвовирусов содержится односпиральная линейная (+)ДНК. Дефектные парвовирусы являются уникальными в мире вирусов, поскольку комплементарные плюс- и минус-ДНК входят в различные вирионы.
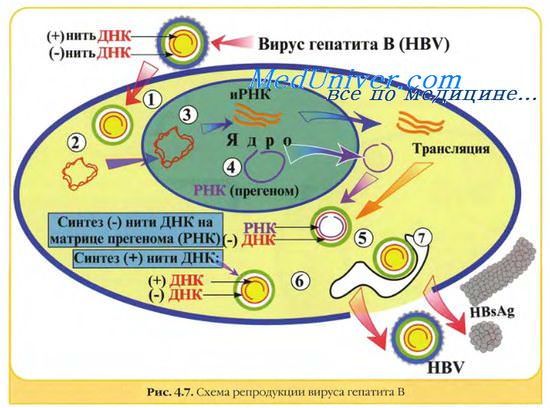
Гепаднавирусы. Частично двуцепочечная ДНК генома гепаднавирусов с помощью вирионной ДНК-полимеразы превращается в суперспирализованную двуцепочечную ДНК. Затем с помощью клеточной РНК-полимеразы II образуются мРНК для вирусных белков, в том числе для обратной транскриптазы, и полноразмерная (+)РНК, которая служит матрицей для обратной вирусной транскрипции с образованием (-)ДНК, на которой в свою очередь синтезируется частично двуцепочечная ДНК. мРНК транскрибируется на двуцепочечной ДНК, стартуя от различных промоторов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Репродукция герпесвирусов. Репликативный цикл герпесвирусов. Поксвирусы. Репродукция поксвирусов.
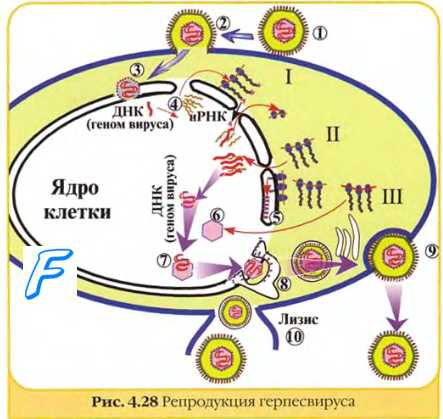
Основные отличия репродуктивного цикла герпесвирусов от остальных ДНК-вирусов связаны с более сложной структурой генома. Адсорбция вирусов на клетках осуществляется через специфические рецепторы. После взаимодействия с рецепторами вирусная оболочка сливается с клеточной мембраной, а нуклеокапсид высвобождается в цитоплазму. Раздевание (депротеинизация) вирусного генома происходит на ядерной мембране, и вирусная ДНК оказывается в ядре клетки-хозяина. Репродукция включает раннюю и позднюю стадии, однако они разграничиваются нечётко.
Поздняя стадия репродукции герпесвирусов. В позднюю стадию вирусная ДНК-полимераза индуцирует репликацию материнской ДНК. В результате образуются молекулы ДНК дочерней популяции. Часть дочерней ДНК считывают клеточные полимеразы, что вызывает транскрипцию концевых генов, кодирующих структурные протеины (белки оболочки и гликопротеины шипов).
Сборка дочерних популяций герпесвирусов осуществляется в ядре, где капсидные белки окружают молекулы ДНК, формируя нуклеокапсиды. Финальная стадия морфогенеза герпесвирусов — формирование суперкапсида на внутренней поверхности ядерной мембраны. Зрелые дочерние популяции отпочковываются от модифицированной ядерной мембраны, транспортируются через цитоплазму и выделяются наружу.
Поксвирусы. Репродукция поксвирусов.
Поксвирусы обладают наиболее сложным репродуктивным циклом, при этом синтезируется более 100 различных белков, входящих в состав вирионов (большинство образует наружную оболочку). Репродукция поксвирусов характеризуется следующими особенностями.
• Транскрипция ДНК начинается до полной депротеинизации вируса, так как она полностью осуществляется вирусными полимеразами.
• Репликация происходит только в цитоплазме и полностью независима от клеточных полимераз, так как, в отличие от прочих вирусов, поксвирусы имеют собственную ДНК-зависимую РНК-полимеразу, которая обеспечивает считывание более половины вирусного генома в течение начальной и ранней стадий.
В репродуктивном цикле выделяют три стадии— начальную, раннюю и позднюю.
Начальная стадия репродукции поксвирусов запускается сразу же после раздевания вируса и выхода вирусной ДНК в цитоплазму.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Обзор
Известны примеры, когда гены вирусов покидали вирусный мир и были отобраны для выполнения важных функций в организме хозяина. Таков оказался ген Arc, ставший ключевым игроком в обеспечении синаптической пластичности мозга млекопитающих.
коллаж автора статьи с использованием изображения с сайта Miray
Автор
Редакторы



Спонсором приза зрительских симпатий выступила компания BioVitrum.
Вездесущие убийцы
Вирусы являются самой распространенной формой жизни в окружающей среде.
В океанах вирусы составляют около 90% объектов, содержащих нуклеиновые кислоты [3]. Однако в связи с их размером, который на порядки уступает таковому у клеточных форм жизни, их вклад в биомассу океана оценивается всего пятью процентами. В то время как на прокариот, количественно составляющих около 10% объектов, содержащих нуклеиновые кислоты, приходится более 90% океанической биомассы (рис. 1). По оценкам, только в мировом океане содержится 10 30 вирусных частиц, которые непрерывно инфицируют самые разные клеточные формы жизни. Так, свыше 20% инфицированных микроорганизмов ежедневно погибает от вирусов [3].

Рисунок 1. Относительные биомасса и количество прокариот, протистов и вирусов в океанах. Приведены усредненные данные по всей толще океанических вод.
Атмосфера Земли также полна вирусами. Показано, что в нижних слоях тропосферы сквозь квадратный метр проносятся несколько миллиардов вирусных частиц в течение суток (плотность потока колеблется в диапазоне от 0,26×10 9 до >7×10 9 шт. в м 2 за сутки). В то же время аналогичный показатель для бактерий на два порядка меньше [4]. По оценкам авторов, большинство вирусов и бактерий (~69% и ~97% соответственно) путешествуют в атмосфере, будучи прикрепленными к частицам пыли или органическим агрегатам. Этот способ глобального распространения вирусов через воздух объясняет тот факт, что идентичные или очень схожие последовательности вирусных нуклеиновых кислот были обнаружены в самых различных экосистемах планеты.
Кроме того, что вирусы являются самой распространенной формой жизни на Земле, они также обладают потрясающим генетическим разнообразием и различными механизмами репродукции в клетке хозяина. Жизненный цикл некоторых из них проходит через этап встраивания своих генов в геном клетки-хозяина. И иногда эти гены, передаваясь от поколения к поколению, остаются в нем на многие миллионы лет. Таковы некоторые ретровирусы — РНК-содержащие вирусы, чей жизненный цикл проходит через стадию интеграции своего генетического материала в геном хозяина.
Неупокоенное кладбище вирусных генов
Геномы эукариот, и в особенности многоклеточных организмов, таких как растения и животные, содержат большое количество генов, принадлежащих в прошлом ретровирусам, инфицировавшим зародышевые линии предковых видов и наследуемым вертикально от родителя к потомку. По всей видимости, обнаруженные в геномах эукариот ретротранспозоны, содержащие длинные концевые повторы (long terminal repeats, LTRs), произошли именно таким образом. LTR-ретротранспозоны включают в себя три семейства: Bel/Pao (Belpaoviridae), Ty3/gypsy (Metaviridae) и Ty1/copia (Pseudoviridae). Эти мобильные генетические элементы имеют явное сходство организации генов с таковым у ретровирусов. В общем случае они содержат ген gag, кодирующий белок (group-specific antigen, группоспецифический антиген), сходный с белком капсида ретровирусов; а также гены, необходимые для репликации и последующего встраивания ретротранспозона в новый сайт-мишень. Вдобавок у семейства Ty3/gypsy также обнаружен ген вирусной оболочки (env). Недавно, на основании накопленных филогенетических данных и схожести механизмов репликации Международным комитетом по таксономии вирусов все эти три семейства ретротранспозонов были объединены с семейством Retroviridae в один порядок Ortervirales [5].

Рисунок 2. Представленность различных мобильных генетических элементов в геномах млекопитающих и других позвоночных животных. По оси ординат указан размер генома в гигабазах (Гб) (10 9 млрд пар оснований). Красной рамкой в легенде выделены LTR-ретротранспозоны. Звездой обозначен вид Homo sapiens.
С одной стороны, сохранившие активность ретротранспозоны являются геномными паразитами, которые могут приводить к дестабилизации генома. Поэтому организмы выработали эпигенетические способы сдерживания подобных угроз, включая метилирование ДНК, модификацию гистонов и малые некодирующие РНК [11]. С другой стороны, активность LTR-ретротранспозонов приводит к дополнительной изменчивости в генофонде популяций, обеспечивая новый материал для отбора [12], [13]. Чаще речь идет об изменении регуляторных участков (промоторов и энхансеров, к примеру) эукариотических генов. Однако даже целые гены ретровирусов могут в процессе эволюции организма отбираться для выполнения определенной функции этого организма. Например, гены ретровирусной оболочки (env) способствовали возникновению класса млекопитающих (Mammalia) в том виде, в каком мы наблюдаем его сейчас . Закрепившаяся за ними функция состоит в обеспечении клеточного слияния, приводящего к формированию синцитиотрофобласта в развивающейся плаценте [14].
Другим удивительным примером вирусного гена, вставшего на службу животным, является ген Arc (другое название Arg 3.1). О нем и пойдет речь в статье.
В название этой главы легла цитата из заголовка обзорной статьи 2011 года, которую опубликовали Джейсон Шеферд и Марк Бэр на основании накопленных данных о роли Arc в обеспечении синаптической пластичности нервной системы млекопитающих [16]. Ген Arc был независимо открыт в середине 90-х годов прошлого века двумя группами ученых, одной из которых руководил Пол Уорли из США, другой — Дитмар Куль из Германии. Они обнаружили, что вскоре после судорожной активности или индукции долговременной потенциации (long-term potentiation (LTP) — устойчивого усиления синаптической передачи между двумя нейронами, возникающего после высокочастотной электрической стимуляции одного из них) происходит быстрое накопление продуктов экспрессии Arc в дендритах активированных нейронов [17], [18].

Рисунок 3. Динамика накопления мРНК Arc в активированных дендритах нейронов зубчатой извилины крысы (Rattus norvegicus domestica). а — Животные, не получавшие стимуляции. б — Спустя 30 мин после стимуляции. в — 1 час после стимуляции. г — 2 часа после стимуляции. На рисунке видно, что с течением времени после стимуляции мРНК Arc распространяется от тел нейронов (темно-коричневая полоса) к их удаленным дендритам (светло-коричневая полоса). Условные обозначения: DG — зубчатая извилина; GCL — гранулярный клеточный слой; CA1 — анатомическая область гиппокампа (от лат. Cornu Ammonis 1).
Подобный характер экспрессии Arc позволил отнести его к так называемым немедленным ранним генам. Немедленные ранние гены (immediate early genes, IEGs) — разнородная группа генов, способных быстро и кратковременно активироваться в течение нескольких минут после воздействия различных экстраклеточных агентов, включая факторы роста, нейромедиаторы и деполяризацию клеточной мембраны .
Позже, на нокаутных по Arc мышам (ген инактивировали во всех клетках организма) было показано нарушение извлечения долговременной памяти в разнообразных поведенческих задачах, среди которых — водный лабиринт Морриса (задача на пространственное обучение и память), условно-рефлекторное замирание на обстановку, условно-рефлекторное замирание на звуковой сигнал, задача на распознавание новых объектов и обусловленная вкусовая аверсия. В последней из перечисленных задач животное учится ассоциировать вкус определенного вещества с последующим наступлением ухудшения самочувствия. Уровень предпочтения этого вещества после нескольких сеансов обучения говорит о сформированной памяти. В то же время, ни в одной из этих задач у нокаутных животных, по сравнению с животными дикого типа, не была нарушена кратковременная память [21]. С помощью введения в миндалевидное тело (структуру лимбической системы мозга, играющюю важную роль в формировании эмоций) антисмысловых олигонуклеотидов к мРНК Arc для ингибирования ее трансляции удалось показать нарушение извлечения долговременной памяти у мышей в задаче условно-рефлекторного замирания на звуковой сигнал. Опять же, кратковременная память нарушена не была [22].
Используя оптогенетическое ингибирование нейронов гиппокампа, экспреcсировавших Arc при обучении условно-рефлекторному замиранию на обстановку, ученые смогли блокировать извлечение сформированной памяти об этой обстановке в тестировании спустя две недели [23]. С другой стороны, локальное увеличение экспрессии Arc в зрительной коре мышей за счет введения Arc-содержащих лентивирусов, восстанавливало пластичность зрительной коры, характерную для ювенильных особей этого вида [24].
Эти и многие другие результаты с очевидностью говорят о ключевой роли гена Arc в процессе формирования долговременной памяти. А теперь вернемся к его эволюционной истории.
Arc: наследие древних ретровирусов
В 2006 году по результатам широкомасштабного анализа генома человека было выявлено 85 генов, кодирующих 103 белковые изоформы, схожие с ретровирусными белками Gag. К сожалению, на тот момент лишь немногие из этих белков были охарактеризованы и исследованы экспериментально, однако в число тех немногих входил Arc, к тому времени активно исследуемый в связи со своей ролью в синаптической пластичности мозга млекопитающих [27].
Лишь спустя без малого 10 лет это наблюдение привлекло внимание нейробиологов. Научный коллектив под руководством Пола Уорли, одного из первооткрывателей Arc, с помощью рентгеноструктурного анализа установил трехмерную структуру N- и C-доменов (относительно стабильных фрагментов третичной структуры белка, укладка которых проходит независимо от остальных частей этого белка) белка Arc. Выяснилось, что трехмерная структура этих доменов имеет значительное сходство с доменом капсидного белка Gag вируса иммунодефицита человека, принадлежащего к семейству Retroviridae (рис. 4). Ученые предположили, что Arc может происходить от Ty3/gypsy ретротранспозонов [28]. Кроме того, N-домен имеет функциональный сайт связывания субъединицы ɣ2 трансмембранного пептида, регулирующего AMPA-рецепторы (transmembrane AMPAR regulatory protein gamma subunit 2, TARPɣ2, или старгазин). Известно, что AMPA-рецепторы — самый распространенный тип рецепторов, передающих быстрые возбуждающие сигналы в синапсах нервной системы позвоночных. Таким образом, структура N-домена белка Arc может опосредовать его роль в приобретении долговременной памяти, о которой шла речь выше.

Рисунок 4. Трехмерная структура доменов белка Arc. 3D-совмещение N- и C-доменов (синий (а) и оранжевый (б) соответственно) с соответствующими доменами капсида вируса иммунодефицита человека (HIV). Розовым цветом показана субъединица ɣ2 трансмембранного пептида, регулирующего AMPA-рецепторы.
В том же году появились первые указания на то, что рекомбинантный человеческий белок Arc, как и белки вирусных капсидов, способен к обратимой самоолигомеризации при физиологических условиях [29]. Но самое интересное ждало исследователей впереди. После того, как было открыто вирусное происхождение гена Arc, учитывая его важную роль в обеспечении синаптической пластичности, резонно было задаться вопросом: какими свойствами ретровирусов он может обладать?
Для начала авторы провели масштабный филогенетический анализ и обнаружили высоко консервативные ортологи мышиного гена Arc у всех исследованных наземных позвоночных, но не у рыб и других вторичноротых. Ортологи и паралоги гена Arc плодовой мушки Drosophila melanogaster, darc1 и darc2, были обнаружены у так называемых настоящих мух (секция Schizophora), но отсутствовали у других исследованных первичноротых (рис. 5) [30].

Рисунок 5. Филогененетическое дерево, отражающее эволюционные связи гена Arc наземных позвоночных (четвероногих), darc1 мух и gag, родственных Ty3/gypsy ретротранспозонам. Указаны следующие ретровирусные гены: группоспецифического антигена Gag (обозначен зеленым), белка капсида; полимеразы Pol (обозначен оранжевым), необходимой для репликации и последующего встраивания вирусной ДНК в геном хозяина; белка вирусной оболочки Env (обозначен голубым).
Интересно, что в этом же номере журнала вышла не менее потрясающая статья, в которой был описан механизм транс-синаптической передачи белка dArc1 и его мРНК в нейро-мышечном контакте у личинок плодовых мушек [31]. По всей видимости, наземные позвоночные, обладающие лишь одной копией гена Arc, приобрели его независимо от генов darc настоящих мух, у которых произошло несколько раундов дупликаций этого гена. Однако и тот, и другой имеют значительную гомологию в ретровирусном Gag-домене [30].



Однако самым удивительным в этой истории оказалось, что перенесенная мРНК Arc начинает транслироваться в дендритах нейронов при деполяризации их мембраны. Ранее было показано, что мРНК Arc транслируется при активации метаботропных глутаматных рецепторов mGluR1/5 (обеспечивающих медленную, опосредуемую метаболическими путями, реакцию на глутаматергические сигналы), например, их агонистом DHPG (3,5-дигидроксифенилглицином) [32]. Авторы повторили выше описанные эксперименты по переносу мРНК Arc в нейроны гиппокампа нокаутных по Arc мышей, но в этот раз добавили в культуральную среду DHPG, вызвав деполяризацию мембраны их дендритов. В итоге в дендритах этих нейронов количество белка Arc достоверно значимо увеличивалось (рис. 9). В свою очередь ингибитор трансляции циклогексимид (CHX) блокировал эффект увеличения количества белка Arc в дендритах, вызванный добавлением DHPG в культуральную среду.

Полученные результаты сложно переоценить: по сути, был открыт новый механизм коммуникации между нейронами, непосредственно связанный с их электрической активностью. И это открытие, как и любое другое в естественных науках, рождает множество новых вопросов, требующих дальнейших исследований.
Например, какие молекулярные механизмы опосредуют выход капсидоподобных структур Arc из нейрона-донора и их проникновение в нейрон-акцептор? Или, учитывая гомологию Arc млекопитающих и darc1 мух, является ли это результатом конвергентной эволюции? Если да, то какие эволюционные требования привели к отбору этих генов для обеспечения функций нервной системы в столь далеких друг от друга таксонах? Вне всяких сомнений в ближайшем будущем нас ждет еще немало удивительных открытий, связанных с геном Arc, потомком древних ретровирусов.
Подробнее эти и другие вопросы, связанные с геном Arc, обсуждаются в обзоре [33].

Обзор
здесь и далее рисунки Андрея Занкевича
Автор
Редактор

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Напомним, что РНК (рибонуклеиновая кислота) — это такая молекула, представляющая собой одну цепочку нуклеотидов. В составе каждого нуклеотида присутствует остаток моносахарида рибозы. На сегодняшний день известно множество разных типов РНК, которые выполняют совершенно разные функции: от кодирования клеточных белков (мРНК) до противовирусной защиты (некоторые микроРНК) [1–5]. РНК, входящие в состав многих вирусов, могут иметь ряд оригинальных функций, таких как регуляция времени экспрессии различных вирусных генов путем изменения пространственной организации цепи РНК или привлечение клеточных белковых комплексов.
Но бывает ли такое, что в пределах одной молекулы РНК одна ее часть, кодирующая некоторый белковый продукт, имеет положительную полярность, в то время как другая часть цепи представлена участком отрицательной полярности, кодирующим другой белок? Могла ли такая молекула возникнуть в процессе эволюции живых форм?
Ответ — да! И для того, чтобы разобраться, как функционируют такие молекулы, нам предстоит погрузиться в таинственный мир вирусов.
Давным-давно, в далекой-далекой галактике.
Как известно, все формы жизни обладают определенной наследственностью, которая определяет степень генетической идентичности живых объектов. В качестве молекул, ответственных за поддержание такой наследственной идентичности, выступают нуклеиновые кислоты (ДНК и РНК). Клеточные формы жизни для хранения и передачи информации используют только один тип нуклеиновых кислот — дезоксирибонуклеиновую кислоту (ДНК), в то время как вирусы в качестве основной молекулы наследственности могут использовать либо ДНК, либо РНК.
В случае ДНК-содержащих вирусов реализуется, как правило, Центральная догма молекулярной биологии в классическом виде: попав в клетку, ДНК удваивается в процессе репликации вирусного генома, на матрице ДНК в ходе транскрипции синтезируются мРНК, которые затем прочитываются рибосомой, синтезирующей по ним вирусные белки, то есть осуществляется трансляция. Далее вирусные белки ассоциируются с ДНК-геномом вируса в вирусную частицу (вирион), которая способна заражать новые клетки.
Очевидно, что РНК-содержащие вирусы используют иные стратегии размножения и, следовательно, реализации своего генома. Непривычные для большинства биологов молекулярные механизмы, которые используются такими вирусами, вероятно, унаследованы от далеких предков из того самого РНК-мира.
Размножение РНК-вирусов подразумевает использование разных типов РНК:
- геномная РНК находится внутри вириона, в зависимости от конкретного вируса, она может быть представлена (+)РНК, (–)РНК, (±)РНК, либо двухцепочечной РНК;
- комплементарная геномной РНК антигеномная РНК образуется в процессе репликации вирусов с одноцепочечным РНК-геномом и обладает полярностью, противоположной геномной РНК;
- субгеномная РНК (вирусная мРНК) имеет (+)полярность и является продуктом транскрипции геномной или антигеномной РНК. Как и подобает мРНК, субгеномная РНК участвует в процессе трансляционного синтеза белка.
Немного истории
Первым найденным РНК-вирусом стал бактериофаг f2, инфицирующий бактерию кишечную палочку (Escherichia coli) [7]. Выделенная геномная РНК фага f2 имела свойства мРНК, то есть она распознавалась рибосомой и могла транслироваться. На родственном РНК-бактериофаге Qβ была изучена РНК-зависимая РНК-полимераза (RdRp), которая, как оказалось, может синтезировать цепь РНК на матрице другой цепи РНК, то есть осуществлять репликацию вирусного РНК-генома! В ходе работы с РНК-бактериофагами f2 и его родственником Qβ были получены общие представления о биологии таких РНК-вирусов [8].
После РНК-бактериофагов были найдены (+)РНК-вирусы животных, такие, как вирус полиомиелита [9], [10], представитель группы пикорнавирусов. Подобные вирусы не содержат репликативных белков в составе вирусной частицы (вириона).
Встречаются вирусы, геном которых представлен двухцепочечной РНК. Как и в случае (–)РНК-вирусов, у дцРНК-вирусов во время репликации в клетке первым делом происходит синтез (+)цепи. Вирусные частицы этой группы также включают в свой состав RdRp.
Вирусы с двусмысленным РНК-геномом из семейства Bunyaviridae

Рисунок 1. Схематичное изображение структуры вириона флебовирусов
В семействе Bunyaviridae роды Phlebovirus, Tospovirus и Tenuivirus являются вирусами с двусмысленным РНК-геномом и, в отличие от остальных представителей семейства, имеют чуть более длинный S-сегмент генома (РНК S) (±)полярности. Род Tospovirus имеет вдобавок (+)участок на РНК M, который делает и эту РНК амбисенсной.
Флебовирусы
Вирусы рода Phlebovirus выделяют практически по всему миру и относят к нетаксономической группе арбовирусов, распространяющихся в членистоногих переносчиках и в позвоночных, на которых питаются переносчики. Члены этого рода переносятся кровососущими членистоногими. Инфекции не обходят стороной человека: вирусы сицилийской и неаполитанской москитных лихорадок широко распространены по территории Средиземноморья [15]. Среди симптомов таких инфекций — продолжительная сильная лихорадка, тошнота, рвота, диарея и головные боли. Вирус Тосканы, также переносимый москитами, обладает способностью проникать в нервную ткань и, вдобавок к вышеперечисленным симптомам, вызывает асептический менингит и менингоэнцефалит. Флебовирусы, переносимые клещами, например, вирус Бханджа, вирус тяжелой лихорадки с синдромом тромбоцитопении, или вирус Хартленд, вызывают серьезные вспышки инфекций среди людей [16].
Эти вирусы получили свое имя от латинского названия москитов (Phlebotominae), которые являются их основными переносчиками. Вирионы флебовирусов имеют диаметр 100-125 нанометров. Внутри вириона находятся три вирусных рибонуклеопротеина (вРНП), содержащих геномные сегменты, однако для вируса лихорадки долины Рифт (RVFV) было показано [17], что вирионы также могут содержать ещё три дополнительных вРНП, образованных цепочками антигеномных РНК, комплементарных геномным вирусным РНК. Рецептор-распознающий аппарат вирусов представлен гетеродимерами гликопротеинов Gn и Gc, которые организованным способом распределены по мембране вириона.
Структура генома флебовирусов
Геном флебовирусов как и других представителей семейства Bunyaviridae, включает три молекулы РНК: PHК L, РНК M, РНК S, имеющие на 5′- и 3′- концах уникальные для каждого геномного сегмента комплементарные последовательности. РНК L (–)полярности кодирует белок репликазы L. (–)РНК M кодирует предшественник гликопротеинов G1 и G2. (±)РНК S кодирует белок нуклеокапсида N на (–)полярном участке (ближе к 3′) и неструктурный белок NSs на (+)полярном участке (ближе к 5′) (рис. 2).

Рисунок 2. Схема структуры генома флебовирусов. Отмечены участки РНК, обладающие (–)- и (+)полярностью. Пунктирной линией обозначен сайт протеолиза белкового продукта.
NSs выполняет ряд функций, среди которых подавление индукции интерферона, усиление репликации и транскрипции вирусной РНК и определение круга хозяев [18]. NSs через цепочку белковых факторов способен приводить к инактивации противовирусной протеинкиназы R организма-хозяина [19].
Механизмы транскрипции и репликации РНК флебовирусов
Остановка транскрипции (–)участка РНК S определяется межгенным сигналом терминации. Похожие сигналы терминации находятся в 5′-концевой области РНК M и РНК L. В результате синтезируются кэпированные, но неполиаденилированные (и, следовательно, не такие стабильные, как клеточные мРНК) субгеномные РНК [18]. Также было показано [17], что в инфицированных клетках наблюдается ранняя экспрессия белка NSs, к тому же при детальном анализе состава вирионов обнаружили, что в вирусную частицу может упаковываться как три геномных цепи, так и еще три антигеномных цепи. Считается, что антигеномная РНК S присутствует в вирионе для осуществления ранней транскрипции мРНК, кодирующей NSs, поскольку этот неструктурный белок способен регулировать клеточные процессы, и чем раньше он начнёт работать в зараженной клетке, тем интенсивнее будет протекать вирусная инфекция.
Жизненный цикл флебовирусов
Жизненный цикл состоит из следующих стадий (рис. 3):

Рисунок 3. Схема, демонстрирующая основные этапы цикла флебовируса
Тосповирусы и тенуивирусы
Название рода Tospovirus происходит от сокращения названия вируса пятнистого увядания томатов (tomato spotted wilt virus, ТоSWV), впервые выделенного в 1930 году из зараженных растений томата. Этот вирус имеет очень широкий спектр хозяев и важное хозяйственное значение, борьба с ним ведется, в основном, за счет контроля численности трипсов.
Структура генома тосповирусов и тенуивирусов
Представители родов Тospovirus и Tenuivirus (тенуивирусы близки к тосповирусам, но не имеют липидной оболочки) являются единственными известными РНКвирусами растений с двусмысленным геномом [23]. Геном тосповирусов представлен тремя РНК-сегментами: большим, средним и малым (L, M, S). РНК L кодирует репликазу L. РНК S, подобно таковой у флебовирусов, кодирует белок нуклеокапсида N в (–)области и неструктурный белок NSs в (+)области. Эти области не пересекаются, они разделены межгенным некодирующим участком, содержащим сигналы терминации транскрипции. М-сегмент генома имеет принципиально отличную от РНК М флебовирусов структуру, являясь амбисенсной РНК. РНК М тосповирусов имеет область (–)полярности, в которой находится последовательность, кодирующая мРНК GnGc — предшественника поверхностных гликопротеинов, а также участок (+)полярности в 5′-области, кодирующий белок межклеточного транспорта NSm. Эти последовательности также разделены межгенным участком (рис. 4). Механизмы транскрипции и репликации РНК этих вирусов сходны с таковыми у флебовирусов [18].

Рисунок 4. Схема структуры генома тосповирусов. Отмечены участки РНК, обладающие (–)- и (+)полярностью. Пунктирной линией обозначен сайт протеолиза белкового продукта.
Отдельного внимания заслуживает неструктурный белок, закодированный в S-сегменте генома тосповирусов — NSs. Основной его функцией является супрессия противовирусного сайленсинга РНК, системы малых интерферирующих РНК [5], [24], распознающих вирусные РНК, что приводит к деградации последних [25]. Логично предположить, что синтез такого белка должен происходить как можно раньше, поэтому, возможно, по аналогии с белком NSs флебовирусов, ранняя транскрипция такой последовательности происходит в результате наличия в вирионе, помимо геномной цепи РНК S, еще и соответствующей ей антигеномной.
Вирусы с двусмысленным РНК-геномом из семейства Arenaviridae
Помимо семейства Bunyaviridae, амбисенсные РНК имеют представители семейства Arenaviridae. Аренавирусы являются таксономической группой вирусов позвоночных с сегментированным двусмысленным РНК-геномом. Вирусы, инфицирующие млекопитающих, определены в род Mammarenavirus, а заражающие рептилий — в роды Reptarenavirus и Hartmanivirus [26].
Вирионы аренавирусов, как и рассмотренных выше буньявирусов, плеоморфны, а их диаметр может варьировать от 40 до 200 нанометров в зависимости от вида, однако и частицы одного вида могут заметно различаться по размерам [27]. Границы вириона представлены липопротеидной оболочкой — производной клеточной мембраны, модифицированной равномерно распределёнными гликопротеиновыми комплексами (гетеродимерный гликопротеин GP1/GP2). Гликопротеины синтезируются в виде предшественника, который разрезается примерно пополам клеточной протеиназой на рецептор-распознающую субъединицу GP1 и трансмембранную субъединицу GP2. Последняя ответственна за слияние мембран при проникновении в цитоплазму [28]. В вирионе гликопротеины ассоциированны с лежащими на внутренней стороне мембраны молекулами матриксного белка Z, выстилающего внутреннюю поверхность мембраны, и белка нуклеокапсида N. Белок N способен связываться с РНК, распознавать кэп и ингибировать интерфероновый ответ. Структурный белок Z в клетке выполняет ряд функций (в том числе ингибирование трансляции клеточных мРНК и подавление апоптоза), являясь фактором созревания вирусных частиц (отвечает за инициацию сборки вирионов и за их отпочковывание).
Во время сборки вирусных частиц при формировании внешней оболочки иногда происходит захват субъединиц клеточных рибосом, по всей видимости, не играющих роли в вирусной инфекции (рис. 5).

Рисунок 5. Схематичное изображение структуры вириона аренавирусов
Значительная часть представителей семейства вызывает хронические и, как правило, бессимптомные инфекции у грызунов. При контакте человека с такими вирусами может развиваться острая и тяжелая инфекция, часто — геморрагическая лихорадка (например, в случае инфекции вирусом лихорадки Ласса, LasV). Вирус лимфоцитарного хориоменингита (LCMV), первый выделенный аренавирус, является нейроинвазивным. Попав в организм человека (например, через выделения грызунов), вирионы с током крови преодолевают гематоэнцефалический барьер центральной нервной системы и вызывают воспаления мозговых оболочек [29].
Структура генома аренавирусов

Рисунок 6. Схема структуры генома аренавирусов. Отмечены участки РНК, обладающие (–)- и (+)полярностью. Пунктирными линиями обозначены сайты протеолиза белковых продуктов.
РНК L на (–)участке несет последовательность, комплементарную гену репликазы L, и рамку матриксного и регуляторного белка Z на (+)участке в 5′-концевой части геномной РНК.
РНК S кодирует белок нуклеокапсида N в области (–)полярности и содержит рамку считывания GP1GP2 — предшественника поверхностных гликопротеинов GP1/GP2 (также в 5′-концевой части геномного сегмента).
Транскрипция и репликация генома аренавирусов
Переключение на репликацию связано с наличием белка N: когда его накапливается такое количество, что он начинает покрывать строящиеся цепи РНК, это, вероятно, влияет на конформацию репликазы и приводит к проскоку сигналов терминации транскрипции в виде межгенных шпилек. РНК S при репликации накапливается в больших количествах, так как нужно много копий белка нуклеокапсида, а также гликопротеинов (для экспрессии последних необходим предварительный синтез антигеномной РНК).
Заключение
Такая необычная организация двусмысленных геномных сегментов является интересным способом представления двух кодирующих последовательностей в одном геномном сегменте. На примере вирусов с двусмысленными РНК-геномами заметно, насколько изобретательной может быть эволюция вирусных РНК. Поскольку вирусы с двусмысленными РНК-геномами до сих пор удерживают определенную нишу, можно утверждать, что такой способ кодирования обладает некоторыми преимуществами по сравнению с более привычным для родственных вирусов способом, использующим только (–)РНК-сегменты.
Как возникли амбисенсные РНК и почему поддержались отбором, до сих пор остается одной из загадок современной вирусологии.
Благодарности от автора
Я благодарю доктора биологических наук, профессора кафедры вирусологии биологического факультета МГУ им. М.В. Ломоносова Аграновского Алексея Анатольевича за интересные и содержательные лекции по молекулярным процессам РНК-вирусов и вдохновение на написание данной статьи. Также выражаю благодарность художнику Андрею Занкевичу, чьи наглядные и яркие иллюстрации украшают данную статью.
Читайте также:

