Статьи по лечению от вирусами
Обновлено: 07.05.2024
В России ежегодно регистрируют более 30 млн. заболевших гриппом и острыми респираторно-вирусными инфекциями. В повседневной клинической практике акцент в лечении ОРВИ делается на применении симптоматических лекарственных средств, направленных на ликвидацию основных проявлений заболевания. В качестве симптоматической терапии используются несколько классов лекарственных средств: жаропонижающие, обезболивающие, антигистаминные, витамины. Наибольшее распространение в связи с удобством применения получили комбинированные препараты, обладающие жаропонижающим, обезболивающим, антигистаминным эффектами.
На сегодняшний день вирусные инфекции являются ведущей причиной заболеваемости во всем мире. В России ежегодно регистрируют более 30 млн. заболевших гриппом и острыми респираторно-вирусными инфекциями (ОРВИ), а ежегодные экономические потери от этих инфекций, по данным экспертов, составляют более 80 млрд. руб [1]. Огромный экономический ущерб от эпидемий гриппа и других ОРВИ обусловлен как прямыми затратами на лечение, так и косвенными, связанными с увеличением числа дней временной нетрудоспособности [2, 3].
Этиологическая структура. В настоящее время известно более 200 вирусов, вызывающих гриппоподобные заболевания, некоторые из них открыты совсем недавно [1]. Информация об удельной частоте выявления тех или иных возбудителей ОРВИ существенно варьирует в зависимости от дизайна исследования, его длительности и сезона, возраста больных, вариантов отбора биологических образцов и методов верификации патогена, а также географической локализации. B результате анализа данных целой серии исследований этиологической структуры ОРВИ, проведенных в разных странах разными группами ученых, установлено, что к наиболее распространенным возбудителям относятся: риновирусы, вирусы гриппа, парагриппа, респираторно-синцитиальный вирус (РСВ), коронавирусы, метапневмовирусы, бокавирусы и аденовирусы [3].
Таблица 1. Этиологическая структура ОРВИ
| Возбудители | Распространенность, % |
| Риновирусы/энтеровирусы | 12-45 |
| Вирусы гриппа | 6-4 |
| Вирусы парагриппа | 15-30 |
| Респираторно-синтициальные вирусы | 10-30 |
| Коронавирусы | 3-13 |
| Метапневмовирусы | 1,5-30 |
| Бокавирусы | 2-11 |
| Аденовирусы | 2-4 |
Вирусы гриппа относятся к ортомиксовирусам, имеют сферическую форму. Внутренняя часть вируса состоит из полимеразного комплекса (PA, PB1, PB2), рибонуклеопротеида и матриксного протеина. Снаружи вирус покрыт оболочкой с двумя видами поверхностных антигенов – гемагглютинин (HA) и нейраминидаза (NA). За счет этих образований происходит прикрепление и внедрение вируса внутрь клетки хозяина. Поверхностные антигены обладают способностью к изменчивости, что обусловливает появление новых вирусов гриппа. Основной профилактической мерой по предотвращению развития эпидемий является массовая вакцинация населения. Вакцины разрабатываются ежегодно с учетом эпидемиологических данных о циркуляции штамма вируса на данной территории. Однако антигенный дрейф вируса гриппа может произойти уже после создания вакцины на текущий год.
В настоящее время отмечается тенденция к снижению частоты инфицирования вирусом гриппа (тип А – 12%, тип В – 3%) и росту активности других респираторных вирусов, в том числе парагриппа – до 50%, аденовирусов – до 5%, респираторно–синцитиальных вирусов – 4%, а также энтеровирусов – 1,2%, смешанных инфекций – около 23% случаев [4]. К гриппу восприимчивы все возрастные категории людей. Эпидемии гриппа, вызванные серотипом А, возникают примерно каждые 2–3 года, а вызванные серотипом В – каждые 4–6 лет. Основной источник инфекции - больной человек. Быстрое распространение заболевания в короткие сроки обусловлено коротким инкубационным периодом, воздушно-капельным механизмом передачи, высокой восприимчивостью людей к ОРВИ и гриппу, а также отсутствием иммунитета у населения к новым антигенным вариантам вируса. Наиболее значимыми с эпидемической точки зрения являются многочисленные больные с легкими и стертыми клиническими формами заболевания.
Главным звеном в патогенезе гриппа является поражение микрососудистой системы, возникающее в результате токсического действия вируса. Клинически нарушения микроциркуляции проявляются носовыми кровотечениями, геморрагической сыпью на коже и слизистых, кровоизлияниями во внутренние органы. При гриппе, в отличие от ОРВИ, наиболее выражен интоксикационный синдром. Клинически он характеризуется ознобом или зябкостью, резкой головной болью с локализацией в лобной области и висках, ломотой в мышцах, суставах, неприятными ощущениями при движении глазами или при надавливании на них, светобоязнью, слезотечением, резкой слабостью и вялостью – в первые дни заболевания эти симптомы доминируют над катаральными проявлениями. Головокружение и склонность к обморочным состояниям чаще встречаются у лиц юношеского и старческого возраста, рвота – преимущественно в младшей возрастной группе и при тяжелых формах заболевания у взрослых. У всех больных тяжелой формой нарушается сон, возникает бессонница, иногда – бред.
Уже в первые часы заболевания температура тела может достигать максимальных показателей – 39–40°С. Снижается температура критически или ускоренным лизисом, продолжительность лихорадки более 5 суток может свидетельствовать о наличии осложнений. Изменения со стороны сердечно-сосудистой системы проявляются снижением артериального давления, приглушенностью сердечных тонов с нежным систолическим шумом на верхушке. Частота сердечных сокращений может соответствовать температуре, однако наиболее характерна относительная брадикардия, которая встречается примерно у 40% больных гриппом. Могут быть отмечены изменения на электрокардиограмме: удлинение интервала PQ, снижение или изоэлектричность зубца Т имеют транзиторный характер. Развитие миокардита для гриппа не характерно (он встречается редко, чаще в сочетании с аденовирусной, микоплазменной инфекцией и при бактериальных осложнениях).
Клинические проявления ОРВИ, вызванных разными возбудителями, весьма схожи между собой и отличаются от таковых при гриппе. Поэтому точный диагноз ОРВИ ставится в единичных случаях лабораторной диагностики. Гриппу, в отличие от других ОРВИ, свойственны резко выраженные симптомы интоксикации, в то время как при парагриппе, аденовирусном и риносинцитиальном заболевании даже при высокой температуре выраженность интоксикации слабая, а при риновирусной инфекции может отсутствовать вовсе.
Клинически ОРВИ характеризуются симптомокомплексом поражений респираторного тракта на различных уровнях. Катаральный синдром проявляется сухостью и ощущением першения в горле, заложенностью носа. При объективном обследовании в первые дни заболевания отмечаются гиперемия и отечность лица, гиперемия шеи, инъекция сосудов склер, влажность глаз, слезотечение, умеренный конъюнктивит. Фарингит и тонзиллит встречаются преимущественно при аденовирусной этиологии заболевания, изолированный ларингит при парагриппе. При поражении ротоглотки отмечается яркая гиперемия слизистой оболочки неба, дужек, задней стенки глотки. У некоторых больных выявляется зернистость мягкого неба, реже – язычка и дужек.
Ринит является постоянным симптомом всех ОРВИ, однако имеет некоторые особенности при каждом из них: при гриппе умеренный, при парагриппе сопровождается выраженной отечностью слизистой оболочки носа, затрудненным дыханием и серозно-слизистым отделяемым; при аденовирусной инфекции, за счет экссудативного компонента, ринит проявляется еще большей отечностью слизистой с выраженной заложенностью носовых ходов и обильным отделяемым. Кроме этого, аденовирусная инфекция часто сопровождается развитием конъюнктивита, чаще одностороннего, лимфоаденопатии, увеличением печени.
Наиболее типичным признаком катарального синдрома является трахеобронхит. При аускультации (при отсутствии осложнений) дыхание везикулярное с жестким оттенком, иногда выслушиваются единичные сухие хрипы. На рентгенограммах визуализируется усиление сосудистого рисунка, расширение корней легких, что ошибочно может диагностироваться как пневмония. Клинически выраженные бронхиты и пневмонии развиваются при присоединении бактериальной инфекции, что в значительной мере обусловливает длительность и тяжесть заболевания. Пневмонии являются самым частым и нередко тяжелым осложнением гриппа и ОРВИ, возникающим на 3-4 день болезни на фоне активной вирусной инфекции. Гриппозная пневмония обладает рядом специфических черт, обусловленных повреждающим действием на клетки свободных радикалов кислорода, нарушениями микроциркуляции, гемостаза, сурфактантной системы. Все это приводит к развитию отека легочной ткани. Рентгенологическая картина характеризуется очаговыми крупнофокусными затемнениями неоднородной структуры, полисегментарными или долевыми, нередко с вовлечением плевры. Особую опасность пневмонии представляют для пожилых пациентов, а также людей с сопутствующими хроническими заболеваниями. При появлении у больного на фоне картины выраженной интоксикации локальной боли в груди, одышки, цианоза необходима немедленная госпитализация больного.
В зависимости от уровня интоксикации и выраженности катарального синдрома грипп и другие ОРВИ могут протекать в легкой (60–65 %), среднетяжелой (30–35 %), тяжелой и тяжелой формах (3–5 %). При тяжелом течении заболевания поражение центральной нервной системы может сопровождаться явлениями менингизма.
Фармакотерапия.
В структуре мероприятий, направленных на улучшение ситуации по ОРВИ и гриппу, одно из важнейших составляющих - это рациональная фармакотерапия и профилактика, которая подразумевает комплексный и системный подход с учетом периода эпидемии [10]. На первом, предэпидемическом этапе особую значимость приобретает комплекс санитарно-оздоровительных мероприятий, средства специфической профилактики (вакцинация) и применение препаратов, повышающих неспецифическую резистентность организма (иммунокорректоры, адаптогены, поливитамины). Во время эпидемического подъема заболеваемости ведущую роль начинают играть этиотропные препараты, которые становятся средствами первой линии защиты и обладают прямым и ингибирующим действием на репродукцию вирусов. Основными требованиями, предъявляемые к данным лекарственным средствам являются: широкий спектр противовирусной активности, низкая токсичность, хорошее проникновение в мозговую ткань, отсутствие отрицательного влияния на иммунитет; подавление размножения вируса, сочетаемость с другими лекарственными средствами, доступность, удобные формы применения, высокая приверженность больного проводимой терапии.
При появлении типичных симптомов гриппа или ОРВИ, уже в первые 24-48 ч необходимо использовать средства, предназначенные для интенсивной терапии (противовирусные препараты и индукторы интерферона) наряду с симптоматической терапией (противокашлевые, жаропонижающие, бронхолитические, антигистаминные препараты).
Необходимо отметить, что имеется целый ряд средств, которые потенциально действуют на различные этапы взаимодействия вируса и клетки: часть из них подавляет внеклеточные вирионы, другие препятствуют проникновению вируса внутрь клетки, третьи ингибируют процессы репликации, сборки вирусов на различных этапах и выход вируса из клетки 12. Вместе с тем, круг препаратов, с реальной и достаточной противовирусной активностью, отвечающий вышеуказанным требованиям, прошедший многоцентровые клинические исследования и рекомендованный во всем мире к практическому применению крайне ограничен. К данным препаратам относятся ингибиторы нейраминидазы (осельтамивир, занамивир), блокаторы М2-белка вируса гриппа А (амантадин, римантадин).
Из блокаторов М2-каналов наибольшее распространение получил римантадин, активный в отношении вируса гриппа А [4]. Препарат известен с конца 60-х годов XX века используется как для профилактики, так и для лечения гриппа А в период эпидемий у взрослых и детей от 2-х лет и старше. Противовирусный эффект римантадина реализуется путем ингибирования синтеза М-белка вируса гриппа, при этом нарушается процесс репродукции и сборки полноценных вирионов. Опыт массового применения в течение последних 20 лет показал его эффективность, особенно при раннем назначении в первые дни заболевания. С терапевтической целью римантадин назначается не позднее 48 часов от появления первых симптомов заболевания у пациентов старше 14 лет в дозе по 100 мг по 2 раза в сутки; у лиц старше 65 лет по 100 мг в сутки. Рекомендуемая длительность терапии составляет 3–5 дней. По отдельным данным, в США и Канаде резистентность вирусов к римантадину достигает 90% [5]. При этом российские исследователи считают, что в нашей стране эта цифра не превышает 20%, что объясняется относительной редкостью применения противовирусных средств для лечения и профилактики гриппа и ОРВИ.
Противовирусные препараты - ингибиторы нейроминидазы (озельтамивир и занамивир) активны в отношении вируса гриппа А и B. Наибольшее распространение получил озельтамивир. Препарат показан для лечения и профилактики гриппа А и В.
Озельтамивир является одним из наиболее безопасных противовирусных препаратов, достаточно редко его прием сопровождает тошнота, рвота, редко головные боли, головокружение, слабость и бессонница, как правило, не требующие отмены терапии. Занамивир обладает низкой биодоступностью, вследствие чего используется только в ингаляционной форме. Препарат позволяет сократить продолжительность симптомов заболевания и частоту осложнений гриппа. Препарат способен вызывать першение в горле, редко бронхоспазм, головные боли, головокружение. Несмотря на относительную новизну этой группы противовирусных средств, резистентность к ним вирусов гриппа не является редкостью. Уже в сезоне 2007–2008 гг. эксперты подразделения ВОЗ предупреждали о развившейся резистентности к озельтамивиру и занамивиру до 64% в различных странах мира. Стоимость препаратов является одним из сдерживающих факторов для широкого распространения препаратов данного класса на территории России[14].
В повседневной клинической практике акцент в лечении ОРВИ делается на применении симптоматических лекарственных средств, направленных на ликвидацию основных проявлений заболевания. В качестве симптоматической терапии используются несколько классов лекарственных средств: жаропонижающие, обезболивающие, антигистаминные, витамины [15].
Разнообразие симптомов ОРВИ определяет обширность списка симптоматических средств. Назначение каждого из них по отдельности оборачивается неудобством для пациента, наталкивается на психологический барьер, снижает приверженность к лечению, и, в конечном итоге, замедляет процесс выздоровления. Одним из решений данной проблемы явилось создание комбинированных лекарственных средств, позволяющих воздействовать на основные симптомы вирусной инфекции. Кроме удобства применения, комбинированные препараты обладают более низкой стоимостью, чем набор различных лекарственных средств. Одним из наиболее удачных препаратов в данной группе является АнвиМакс. Состав препарата включает парацетамол (360 мг), аскорбиновую кислоту (300 мг), кальция глюконат (100 мг), римантадина гидрохлорид (50 мг), рутозида тригидрат (20 мг в пересчете на рутозид), лоратадин (3 мг). С учетом состава препарат может применяться в качестве симптоматического лечения простудных заболеваний, гриппа и ОРВИ, сопровождающихся повышением температуры, болями в мышцах, головной болью, ознобом, а также как этиотропное лечение гриппа типа А.
Основное отличие препарата АнвиМакс от других комплексных противогриппозных средств заключается в наличии в составе римантадина- блокатора М2-каналов вируса гриппа А. Кроме того, в отличие от сходных средств, препарат содержит лоратадин, способный купировать проявления ринореи без побочного седативного эффекта, присущего антигистаминным препаратам более ранних поколений. В состав препарата также входит аскорбиновая кислота. Она стимулирует выработку эндогенного интерферона, нормализует процессы перекисного окисления липидов, укрепляет сосудистую стенку, уменьшая ее проницаемость, и восполняет повышенную во время болезни потребность организма в аскорбиновой кислоте. Рутозид является ангиопротектором, уменьшает проницаемость капилляров, отечность и воспаление, укрепляет сосудистую стенку.
Лихорадка, головная боль и миалгии при ОРВИ требуют применения нестероидных противовоспалительных препаратов (НПВП), которые наряду с жаропонижающим действием обладают анальгетическим эффектом. Парацетамол, входящий в состав препарата, применяется на протяжении нескольких десятилетий. С 1963 г. после включения в Британскую фармакопею парацетамол широко используется в медицинской практике в качестве болеутоляющего и жаропонижающего средства. В настоящее время в Европе и Северной Америке потребляется до 24 млрд. таблеток парацетамола ежегодно [6, 7.]. Препарат не обладает противовоспалительным эффектом и относится к группе анальгетиков-антипиретиков, т.е. к препаратам, способным эффективно бороться с болью и лихорадкой любого происхождения. Выраженное анальгетическое действие препарата связано с его способностью накапливаться в центральной нервной системе, головном и спинном мозге и уменьшать образование простагландинов за счет ингибирования фермента циклооксигеназы (ЦОГ), контролирующего образование простагландинов из арахидоновой кислоты. Отсутствие ингибирующего эффекта в отношении ЦОГ–1 определяет незначительные риски ульцерогенного действия и диспепсии, что было показано в исследовании PAIN у пациентов с ОРВИ. В отличие от ацетилсалициловой кислоты и других групп НПВП, парацетамол не провоцирует бронхоспастические реакции, не оказывает значимого повреждающего действия на слизистую оболочку желудка и может применяться даже пациентами с язвенной болезнью. В отличие от метамизола парацетамол не обладает гематоксическим действием и не имеет таких побочных эффектов как агранулоцитоз, апластическая анемия. Парацетамол признан препаратом выбора в педиатрической практике. Его безопасность для беременных женщин подтверждена результатами исследования ALSPAC, включившего 12104 пациенток [10].
Таким образом, в повседневной практике с целью симптоматическое лечение ОРВИ оптимальным представляется использование комбинированных препаратов, обладающим жаропонижающим, обезболивающим, противоотечным и ангиопротекторным эффектами.
В настоящий момент не существует вакцины и противовирусных препаратов для профилактики и лечения 2019-nCoV. Однако соблюдение стандартных профилактических мер позволяет минимизировать риск распространения вирусов, в том числе и нового коронавируса
Потеря слуха, связанная с врожденной ЦМВ-инфекцией
Использование индукторов интерферона в клинике инфекционных болезней
Обосновано применение циклоферона в профилактических и терапевтических схемах при острой и хронической инфекционной патологии.
Использование циклоферона в терапии больных с реактивацией Эпштейна-Барр вирусной инфекции, протекающей в форме мононуклеоза
Включение циклоферона в схему терапии реактивации ЭБВИ у детей патогенетически обосновано и сопровождается отчетливым терапевтическим эффектом.
Энтеровирусная инфекция у детей: современное состояние проблемы
Необходима разработка новых высокоэффективных методов диагностики для раннего выявления энтеровирусной инфекции, а применения патогенетических метаболических препаратов (Элькар) позволит корректировать патологические состояния, вызываемые энтеровирусами.
Как победить инфекцию - вирус папилломы человека, ротавирус и пневмококк?
Симпозиум, в ходе которого ведущие российские эпидемиологи и инфекционисты обсудили вопросы профилактики и элиминации инфекционных заболеваний
New England Journal of Medicine публикует результаты клинического исследования нового препарата для профилактики цитомегаловирусной инфекции
5 апреля 2017 года – Компания MSD объявила публикации в журнале New England Journal of Medicine результатов клинического исследования 3-й фазы нового препарата летермовир (МНН), предназначенного для…
Цитомегаловирусная болезнь у взрослых
Опыт применения препарата Галавит у больных с папилломавирусной инфекцией органов урогенитального тракта и перианальной области
Д.К. Ермоленко, В.А. Исаков, НИИЭМ имени Пастера
Как известно, папилломавирусы относятся к роду А семейства паповавирусов. Вирионы не имеют оболочки, диаметр их равен 50–55 нм. Капсид имеет форму икосаэдра и состоит из 72 капсомеров. Геном представлен двухспиральной ДНК и включает в себя около 8000 основных пар. Вирусы эпителиотропны, то есть, способны поражать лишь поверхностный эпителий кожи и слизистых, вызывая доброкачественные и злокачественные неоплазии [1]. Наиболее серьезные эпидемиологические исследования, посвященные роли этих патогенов среди заболеваний, передаваемых половым путем,…
Клещевой энцефалит
Острое вирусное заболевание, характеризующееся поражением серого вещества головного и спинного мозга с развитием парезов и параличей
Главная задача биологии — это развитие представлений у человека о живых организмах, о многообразии видов, обо всех закономерностях развития живых существ, а также об их взаимодействии с окружающей природой. Предмет основы безопасности жизнедеятельности (ОБЖ) позволяет получить знания и умения, которые помогут сохранить жизнь и здоровье в опасных ситуациях. Эти ситуации всегда возникают неожиданно, но, тем не менее, большинство из них предсказуемы и к ним можно подготовиться заранее. ОБЖ учит нас предвидеть возможные опасности и минимизировать потери от той или иной ситуации. Сегодня мы сталкиваемся с новым видом вирусной опасности COVID-19,о котором поговорим с точки зрения биологии и ОБЖ.
Что такое вирус?
Вирус — это неклеточный инфекционный агент. Сегодня нам известно около 6 тысяч различных вирусов, но их существует несколько миллионов. Вирусы не похожи друг на друга и могут иметь как форму сферы, спирали, так и форму сложного асимметричного сплетения. Размеры вирусов варьируются от 20 нм до 300 нм.
Как устроен вирус?
В центре агента находится генетический материал РНК или ДНК, вокруг которого располагается белковая структура — капсид.
Капсид служит для защиты вируса и помогает при захвате клетки. Некоторые вирусы дополнительно покрыты липидной оболочкой, т.е. жировой структурой, которая защищает их от изменений окружающей среды.
Вирусолог Дэвид Балтимор объединил все вирусы в 8 групп, из которых некоторые группы вирусов содержат 1-2 цепочки ДНК. Другие же содержат 1 цепочку РНК, которая может удваиваться или достраивать на своей матрице ДНК. При этом каждая группа вирусов производит себя в различных органеллах зараженной клетки.
Вирусы имеют определенный диапазон хозяев, т.е. он может быть опасен для одних видов и абсолютно безвреден для других. Например, оспой болеет только человек, а чумкой только некоторые виды плотоядных. Вирус не способен выжить сам по себе, поэтому активируется только в хозяйской клетке, используя ее ресурсы и питательные вещества. Цель вируса — создание множества копий себя, чтобы инфицировать другие клетки!
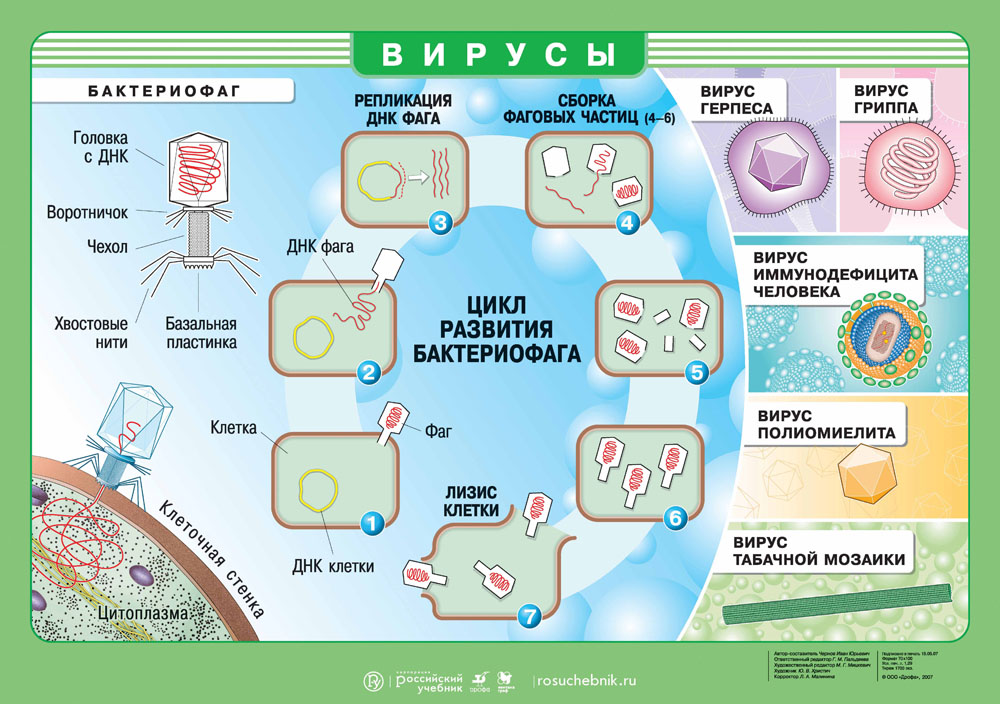
Как вирус попадает в организм?
- через физические повреждения (например, порезы на коже)
- путём направленного впрыскивания (к примеру, укус комара)
- направленного поражения отдельной поверхности (например, при вдыхании вируса через трахею)
- к эпителию слизистых оболочек (это например вирус гриппа)
- к нервной ткани (вирус простого герпеса)
- к иммунным клеткам (вирус иммунодефицита человека)

Геном вируса встраивается в одну из органелл или цитоплазму и превращает клетку в настоящий вирусный завод. Естественные процессы в клетке нарушаются, и она начинает заниматься производством и сбором белка вируса. Этот процесс называется репликацией. И его основная цель — это захват территории. Во время репликации генетический материал вируса смешивается с генами клетки хозяина — это приводит к активной мутации самого вируса, а также повышает его выживаемость. Когда процесс репликации налажен, вирусная частица отпочковывается и заражает уже новые клетки, в то время как инфицированная ранее клетка продолжает производство.
Выход вируса
Вирус создал множество собственных копий, клетка оказывается изнуренной из-за использования ее ресурсов. Больше вирусу клетка не нужна, поэтому клетка часто погибает и новорожденным вирусам приходится искать нового хозяина. Это и есть заключительная стадию жизненного цикла вируса.
Скорость распространения вирусной инфекции
Размножение вирусов протекает с исключительно высокой скоростью: при попадании в верхние дыхательные пути одной вирусной частицы уже через 8 часов количество инфекционного потомства достигает 10³, а концу первых суток − 10²³.
Вирусная латентность
Как вирус распространяется?
- воздушно-капельный (кашель, чихание)
- с кожи на кожу (при прикосновениях и рукопожатиях)
- с кожи на продукты (при прикосновениях к пище грязными руками вирусы могут попасть в пищеварительную и дыхательную системы)
- через жидкие среды организма (кровь, слюну и другие)
Почему с вирусами так тяжело бороться?
Сегодня людям уже удалось победить некоторые вирусы, а некоторые взять под жесткий контроль. Например, Оспа (она же черная оспа). Болезнь вызывается вирусом натуральной оспы, передается от человека к человеку воздушно-капельным путем. Больные покрываются сыпью, переходящей в язвы, как на коже, так и на слизистых внутренних органов. Смертность, в зависимости от штамма вируса, составляет от 10 до 40 (иногда даже 70%), На сегодняшний день вирус полностью истреблен человечеством.
Кроме того, взяты под контроль такие заболевания, как бешенство, корь и полиомиелит. Но помимо этих вирусов существует масса других, которые требуют разработок или открытия новых вакцин.
Коронавирус
Виновником эпидемии, распространяющейся сегодня по миру, стал коронавирус, вирусная частица в 0,1 микрона. Свое название он получил благодаря наростам на своей структуре, своеобразным шипам. Внутри вируса спрятан яд, с помощью которого он подчиняет себе зараженный организм. Этот вирус воздействует не только на человека, но и на птиц, свиней, собак и летучих мышей. В настоящий момент выделяют от 30 до 39 разновидностей коронавирусной инфекции. Но для человека патогенно всего 6. И как любой другой вирус COVID-19 мутирует.

К наиболее распространенным симптомам COVID-19 относятся повышение температуры тела, сухой кашель и утомляемость. К более редким симптомам относятся боли в суставах и мышцах, заложенность носа, головная боль, конъюнктивит, боль в горле, диарея, потеря вкусовых ощущений или обоняния, сыпь и изменение цвета кожи на пальцах рук и ног. Как правило, эти симптомы развиваются постепенно и носят слабо выраженный характер. У некоторых инфицированных лиц болезнь сопровождается очень легкими симптомами.
Сколько же может жить этот вирус вне организма? Все зависит от типа вируса и от той поверхности, на которую вирусы попали. В качестве примера было рассмотрено 3 вируса, по которым велись исследования. Изучали время, на которое может задерживаться вирус на различных поверхностях. Данные приведены в таблице.

Поскольку пока не изобретено вакцины от COVID-19, в целях защиты от инфекции самым важным для нас является соблюдение гигиены.
Гигиена — раздел медицины, изучающий влияние жизни и труда на здоровье человека и разрабатывающая меры (санитарные нормы и правила), направленные на предупреждение заболеваний, обеспечение оптимальных условий существования, укрепление здоровья и продление жизни.
Сегодня следует соблюдать определенные правила гигиены:
- Соблюдение режима труда и отдыха, не допускающего развития утомления и переутомления.
- Выполнение условий, обеспечивающих здоровый и полноценный сон (свежий воздух, отсутствие шума, удобная постель, оптимальная продолжительность).
- Правильное здоровое питание в соответствии с потребностями организма.
- Комфортный микроклимат в жилище (температура, влажность и подвижность воздуха, естественная и искусственная освещенность помещений).
- Содержание в чистоте тела и тщательный уход за зубами.
- Спокойное и корректное поведение в конфликтных ситуациях.


Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Читайте также:

