Вирус иммунодефицита функционирует в клетках
Обновлено: 12.05.2024
Проведя тщательный анализ этого образца, группа ученых во главе с Майклом Уороби (Michael Worobey) из университета Аризоны показала, что этот мужчина был инфицирован ВИЧ — вирусом, вызывающим синдром приобретенного иммунодефицита.
При жизни ни сам мужчина, ни его лечащие врачи об этом не знали. Формально вирус будет открыт лишь 17 лет спустя.
Извлекая крошечные генетические фрагменты из образца ткани, команда Уороби практически полностью реконструировала геном ВИЧ в том виде, в котором он существовал в те годы. А сама работа ученого помогла пролить свет на возникновение того, что станет причиной одной из самых важных пандемий в истории человечества.
В погоне за образцами
Вирус иммунодефицита человека был выявлен в 1980-х, после того как таинственный новый синдром затронул жителей США, и, как казалось, тогда он появился из ниоткуда. На самом деле эпидемия зародилась за несколько десятилетий до этого, просто на совсем другом континенте. В Африке.
Теперь мы можем с уверенностью утверждать, что по мере распространения геном вируса претерпевал постоянные изменения: сравнивая накопившиеся мутации и оценивая время, за которое они произошли, ученые могут проследить историю эволюции вируса вплоть до самого момента возникновения.
по теме

Общество
Наиболее вероятное место его появления — южный Камерун. А приблизительное время — 1920-е годы. Именно там и тогда вирус от шимпанзе перешел к человеку, перед тем как вскоре перебраться в город, известный в наше время как Киншаса.
В густонаселенном и быстрорастущем регионе с множеством потенциальных реципиентов вирус и обосновался, чтобы затем распространиться по всему миру.
Очевидно, что огромное количество людей тогда было инфицировано ВИЧ еще прежде, чем кто-то узнал о его существовании. Образцы тканей некоторых из погибших сохранились до наших дней: они рутинно собирались для исследований патологоанатомами, обрабатывались химическим фиксатором, располагались на восковых подложках, изучались под микроскопом (скорее всего, безрезультатно), а затем отправлялись в хранилище.
Но поскольку вирус до своего появления на Западе не был идентифицирован, определить заранее, какой именно образец ткани, взятый в то время, может содержать его следы, невозможно. Искать следы вируса в таких условиях — все равно что искать иголку в тысяче стогов сена.
Более того, процесс обработки химическим фиксатором и условия хранения образцов, дошедших до нашего времени, были таковы, что негативно влияли на содержащиеся в них РНК — молекулы, составляющие геном ВИЧ.
Вирус ВИЧ под микроскопом. Компьютерная Модель.
Однако нет ничего странного в том, что за два десятилетия поисков ученым удалось найти лишь два образца со следами вируса, собранных в Киншасе в период до его открытия.
Дэвид Хо (David Ho) из университета Рокфеллера (Rockefeller University) нашел следы вируса в образце крови, взятой в 1959 году; Уороби обнаружил их в кусочке лимфатического узла из 1960 года.
В обоих случаях от молекул РНК в целом сохранилось около одного процента. Но даже этих крошечных кусочков оказалось достаточно, чтобы доказать: именно ВИЧ блуждал по Киншасе за десятилетия до его открытия, а также чтобы наметить основные вехи истории его эволюции.
В то же время, ввиду ненадежности фрагментарных свидетельств, Уороби хотел собрать геном полностью. Целиком.
Его коллеги Софи Грисилс и Том Уоттс (Sophie Gryseels and Tom Watts) для этого разработали более точную технологию извлечения РНК и применили ее к более чем 1600 образцам тканей из Университета Киншасы (University of Kinshasa). И один из них, как оказалось, действительно содержал следы вируса.
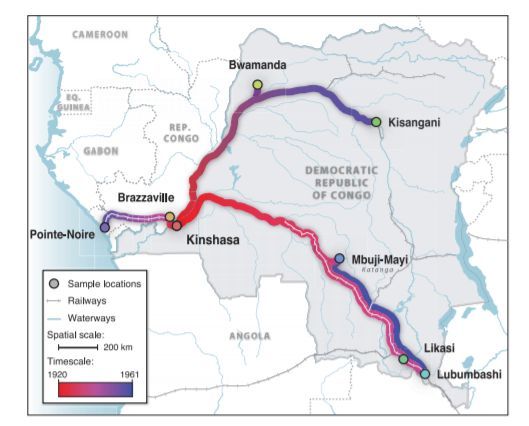
Скрытая эпидемия. Пути распространения ВИЧ в Африке до того, как вирус попал в США.
Место и время
Извлеченные образцы оказались больше всего похожи на подтип С, наиболее распространенный тип ВИЧ в Африке. Тот, что и сейчас доминирует в южной части континента.
На поверку генетический материал, попавший в руки ученых, является лишь малой частью того разнообразия, которое существовало в Киншасе в 1960-е.
А стало быть, из всех подтипов вируса лишь некоторые из тех, что в то время можно было обнаружить в городе, вырвались наружу, дабы стать общемировой проблемой.
История ВИЧ в датах
1930-е
Исследователи полагают, что приблизительно в 1930-х некая форма вируса иммунодефицита обезьян (SIV) перебралась к людям во время разделки или поедания мяса шимпанзе в Демократической Республике Конго. Этот вирус стали называть ВИЧ-1, и это самый распространенный тип вируса на сегодняшний день.
1959
Первый известный случай заболевания СПИДом выявлен при исследовании образцов плазмы крови мужчины, умершего в Демократической Республике Конго в 1959 году.
1960-е
ВИЧ-2, ареал распространения которого ограничен западной частью Африки, перешел к людям от обезьян вида дымчатый мангобей в Гвинее-Бисау в 1960-х.
Генетический анализ вируса, проведенный в 2003 году, говорит, что именно этот тип, вероятно, впервые перебрался в Соединенные Штаты примерно в 1968 году.
1970-е
На протяжении 1970-х вирус, оставаясь незамеченным, продолжает распространяться по США и остальному миру, начинается эпидемия.
1981
Высокая распространенность двух редких заболеваний — саркомы Капоши и пневмонии — отмечена среди молодых гомосексуальных мужчин в Нью-Йорке и Калифорнии в США. Это первый задокументированный случаи СПИДа. К концу года уже 121 человек умер от таинственного заболевания.
1982
Ученые центра по контролю и профилактике заболеваний (Centers for Disease Control and Prevention, CDC) в Атланте, США, предположили, что нарушение работы иммунной системы среди гей-сообщества вызвано инфекционным заболеванием. Они ввели термин Синдром приобретенного иммунодефицита (СПИД) и установили, что помимо геев в группу риска входят потребители инъекционных наркотиков, люди гаитянского происхождения и больные гемофилией. К концу 1982 года СПИД был обнаружен на пяти континентах.
1983
Эпидемия СПИДа бурно развивается в Европе: в первую очередь среди гей-сообщества, а также среди людей, имеющих тесные связи с центральной Африкой.
Начинается расследование случаев СПИДа в Руанде, Заире и других африканских странах.
1984
Используя недавно разработанные техники, в ходе нескольких исследований независимо друг от друга Люк Монтанье (Luc Montagnier) из Института Пастера в Париже (the Pasteur Institute in Paris), Франция, и Роберт Галло (Robert Gallo) из Национального института раковых заболеваний (the National Cancer Institute) в Вашингтоне, округ Колумбия, США, обнаруживают ретровирус, ответственный за развитие заболевания, известного как СПИД. Позднее он будет назван вирусом иммунодефицита человека (ВИЧ).
Случаи заболевания СПИДом все чаще начинают появляться в среде гетеросексуалов.
1985
В Атланте, США, проведена первая конференция, посвященная проблемам СПИДа.
Вслед за прошлогодним открытием вируса на рынке появляется первый метод тестирования на ВИЧ, одобренный Управлением по контролю за продуктами и лекарствами США (US Food and Drug Administration, FDA).
В США начинается тестирование крови в донорских пунктах.
1987
Азидотимидин (AZT), также известный как Зидовудин, первый противовирусный препарат, становится доступным для лечения ВИЧ после клинических испытаний. Препарат работает, блокируя действие обратной транскриптазы фермента ВИЧ, не давая вирусу размножаться в клетках. AZT замедляет развитие СПИДа, отдаляя смерть.
К 1987 году 16908 человек умерли от СПИДа в США. Всего Всемирная организация здравоохранения (ВОЗ) сообщила о 71571 случае заболевания СПИДом, из которых 47022 — в США.
По оценкам Всемирной организации здравоохранения, по всему миру носителями ВИЧ являются от 5 до 10 миллионов человек, ВОЗ запускает глобальную программу по борьбе со СПИДом.
1988
ВОЗ объявила 1 декабря всемирным днем борьбы с ВИЧ/СПИДом.
1991
Красная лента стала международным символом борьбы с ВИЧ/СПИДом.
1992
В США СПИД вышел на первое место среди причин смертности мужчин в возрасте от 24 до 44 лет.
Первые комбинированные лекарственные препараты для лечения ВИЧ появляются на рынке, после того как FDA наряду с AZT одобрило использование Zalcitabine (ddC), который также блокирует обратную транскриптазу.
Комбинированные препараты против ВИЧ оказываются более эффективными, а комплексное лечение замедляет развитие лекарственной резистентности.
1994
Использование AZT для предотвращения передачи ВИЧ от матери ребенку во время беременности рекомендовано в США. Исследование показало, что подобная терапия снижает шанс передачи вируса во время беременности до 8 %, в контрольной группе вероятность передачи составляла 25 %.
Через 12 лет после открытия вируса правительство США впервые запускает кампанию в медиа по пропаганде использования барьерных контрацептивов.
1995
ВОЗ объявила о достижении количеством зараженных миллионной отметки, всего же с начала эпидемии ВИЧ вирусом заразились более 19,5 миллиона человек.
1996
Международная инициатива по вакцинации против СПИДа (IAVI) — некоммерческая организация, базирующаяся в Нью-Йорке, — создана для ускорения поиска вакцины против ВИЧ.
90 % всех заболевших теперь проживают в развивающихся и развитых странах.
1997
Впервые благодаря появлению ВААРТ отмечено резкое падение смертности от СПИДа.
ООН объявляет, что к 2010 году 40 миллионов детей могут потерять одного или обоих родителей из-за СПИДа.
1998
Первые полномасштабные испытания вакцины против ВИЧ начинаются в США.
Две команды исследователей начинают разработку вакцин против штаммов ВИЧ, распространенных в странах Африки к югу от Сахары
В Сан-Франциско обнаружен штамм ВИЧ, устойчивый ко всем лекарственным средствам, подавляющим протеазу, которые в то время существовали на рынке. У некоторых пациентов, использующих для лечения ингибиторы протеазы, встречаются необычные побочные эффекты, такие как рост жировых отложений и проблемы с сердцем.
1999
33 миллиона человек инфицированы ВИЧ, а 14 миллионов умерли от СПИДа по всему миру.
СПИД становится одним из четырех самых массовых убийц современности.
2001
Индийская компания начинает продавать копии дорогих запатентованных лекарств против СПИДа через медицинскую благотворительную организацию в Африке. Этот шаг заставляет некоторые фармацевтические компании снижать цены.
2003
5 миллионов новых случаев СПИДа выявлены на протяжении 2003 года — самое большое количество с начала эпидемии. 3 миллиона человек умерли от СПИДа в этом же году.
2005
Около 40 миллионов человек инфицированы ВИЧ по всему миру.
Высокорезистивный штамм вируса, вызывающий быстрое развитие СПИДа, обнаружен в Нью-Йорке, США.
По оценкам ученых, сам ВИЧ возник где-то между 1896 и 1905 годом. Далеко не все вирусы так молоды. Когда ученые впервые обнаружили следы гепатита B времен Бронзового века, они подсчитали, что вирус менялся в 100 раз медленнее, чем предполагалось до этого. Открытие кардинально изменило предполагаемый период его возникновения. Даже ВИО (вирусы иммунодефицита обезьян), ближайшие родственники ВИЧ, поражающие шимпанзе, эволюционировали с разной скоростью в далеком прошлом и в новейшей истории, что делает оценку времени возникновения очень сложной.
В целом именно благодаря этому факту статистическими методами ученым удалось достаточно точно локализовать время и место начала пандемии. Установить, что с 1920-х годов именно Киншаса, ныне столица Демократической Республики Конго, стала центром первого очага эпидемии ВИЧ, а также положила начало эпидемии 1960-х годов в других частях континента.
Отсюда, из Киншасы, вирус прибыл на Гаити примерно в 1964 году. Причиной тому стало возвращение на родину жителей этого островного государства. До середины 60-х многие жители Гаити работали в только что получившем свою независимость Конго в качестве специалистов. И значительная часть гаитянских работников проживала именно в Киншасе.

Миграция из Гаити в США. Вторая половина 60-х тут наблюдается резкий рост. ВИЧ попадет в США именно в этот период.
Уже с Гаити вирус вместе с мигрантами перебрался на материк — в Соединенные Штаты Америки. Где очень быстро распространился среди гомосексуалов, воспользовавшись относительной уязвимостью перед ВИЧ именно этой группы.
Первые смерти от симптомов, крайне похожих на СПИД, будут зафиксированы здесь (преимущественно среди афроамериканских геев) уже в конце 60-х. Накануне знаменитых Стоунвольских бунтов, органично связанных с борьбой за права черного населения Америки и ставших отправной точкой эмансипации ЛГБТ-движения, завершившегося нынешней либерализаций законодательства относительной однополых браков и партнерств практически во всех западных странах.
Работа Уороби подтвердила эти и некоторые другие тезисы. Не на моделях, а на реальном генетическом материале.
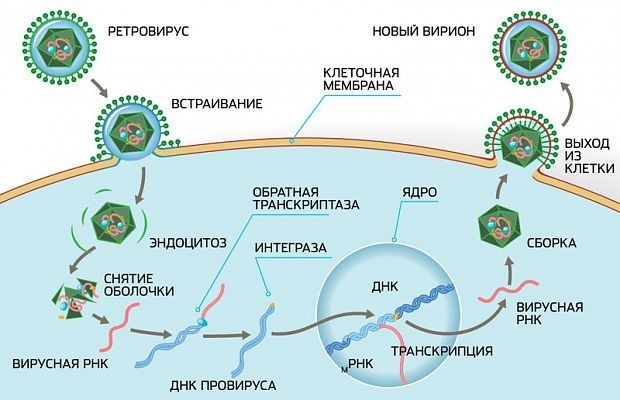
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, а значит, специальные лекарства могут тормозить его на различных этапах.
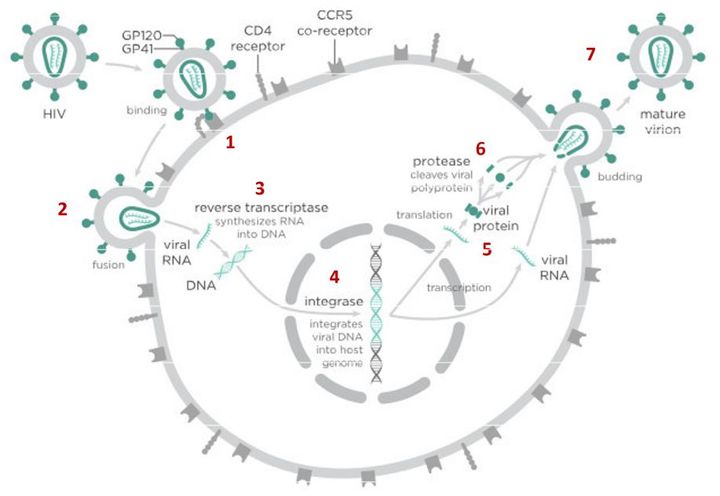
В случае с ВИЧ это выглядит так.
по теме

Лечение
Лучшие научпоп-статьи 2018 года
После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме). На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.
На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин). Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы. Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.
по теме

Лечение
Ошибка системы. Почему в регионах опять не хватает таблеток от ВИЧ
После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы, включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Есть несколько перспективных технологий, например, CRISPR/Cas9, которые могут позволить полностью удалить вирусную ДНК из организма человека, но пока ни одна из них не прошла все необходимые исследования для подтверждения эффективности и безопасности. Исследования продолжаются.
ВИЧ-инфекция — это медленно прогрессирующее инфекционное заболевание, вызываемое вирусом иммунодефицита человека (ВИЧ).
Размножаясь, ВИЧ поражает клетки иммунной системы — так называемые CD4+ Т-лимфоциты. В результате чего количество их постепенно уменьшается.
Что это за клетки?
Они отвечают за уничтожение тех вирусов, которые попали в организм человека и смогли преодолеть гуморальный барьер.
Т-лимфоциты действуют не против возбудителей, циркулирующих в крови, а распознают измененную, то есть зараженную вирусом, клетку и разрушают ее. Клетки CD4 регулируют весь этот процесс, выполняя функцию иммунной памяти.
Именно поэтому против ВИЧ иммунная система не может сработать так, как это было бы с любым другим вирусом.
Стоит сразу отметить, что ВИЧ — вирус нестойкий, он погибает вне среды человеческого организма при высыхании содержащих его жидкостей и практически моментально погибает при температуре выше 56ºС.
ВИЧ содержится во всех биологических жидкостях человеческого организма. Однако достаточное для инфицирования количество ВИЧ может содержаться только в крови, сперме, предэякуляте, вагинальном секрете и грудном молоке.
Слюна, пот и моча не содержат достаточного для инфицирования количества вируса.
Пути инфицирования ВИЧ
Вероятность инфицирования при незащищенном контакте такого типа наиболее велика.
Некоторые другие практики, например оральный секс, могут подразумевать меньшую опасность инфицирования.
Несмотря на то, что в справочниках обычно для орального секса отмечается процент вероятности, отличный от нуля, за всю историю эпидемии пока достоверно не зафиксировано ни одного случая инфицирования таким образом — даже в том случае, если принимающий партнер проглатывает сперму после эякуляции.
Таким образом, получить ВИЧ может каждый независимо от пола, возраста, национальности, сексуальной ориентации, материального достатка или принадлежности к какой-либо социальной группе.
Часто люди могут знать, как необходимо поступать, чтобы избежать инфицирования, однако в силу социальных, культурных или экономических условий, в которых им приходится находиться, они могут воздерживаться от правильных действий.
Что такое СПИД?
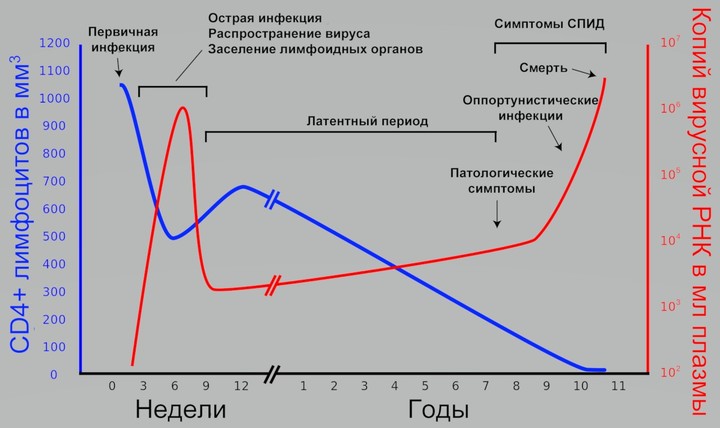
ВИЧ-инфекция течет медленно и почти бессимптомно. В течение многих лет она может никак не тревожить человека.
СПИД — синдром приобретенного иммунодефицита — тяжелое состояние, которое вызывается у человека длительным течением ВИЧ-инфекции.
Считается, что с момента проникновения вируса в организм до достижения стадии СПИДа проходит в среднем 10 лет (от 5 до 15 лет). Но только в том случае, если пациент, получив вирус, не начал лечение.
Антиретровирусная терапия является единственным средством для лечения ВИЧ-инфекции с доказанной эффективностью.
Если антиретровирусная терапия не начата вовремя и количество CD4+ Т-лимфоцитов снизилось ниже критического уровня 200 кл/мкл, у человека появляется вероятность развития СПИДа.
Но СПИДа можно избежать!
Что для этого нужно сделать? Необходимо как можно скорее после обнаружения в организме следов вируса начать так называемую антиретровирусную терапию (сокращенно АРВТ или АРТ).
Антиретровирусная терапия — это комбинация из 3-4 препаратов, которые блокируют размножение ВИЧ на разных этапах. Вследствие ее применения вирус иммунодефицита человека перестает размножаться.
Пока АРТ неспособна элиминировать вирус, то есть полностью вылечить ВИЧ-инфекцию, однако в состоянии не просто продлить жизнь ВИЧ-инфицированного человека, но и повысить ее качество.
Пациенты, которые получают АРТ, не болеют СПИДом!
Предполагаемая продолжительность жизни человека с ВИЧ-инфекцией, получающего АРТ, не отличается от таковой в общей популяции людей. Более того, человек, принимающий препараты АРТ и достигший неопределяемого уровня вирусной нагрузки, безопасен для своего сексуального партнера, даже в том случае, если занимается с ним сексом без презерватива.
Считается, что, если у человека с ВИЧ показатель вирусной нагрузки менее 200 копий, риск передачи отсутствует. Если этот показатель выше — риск безусловно есть. В этом случае ВИЧ-отрицательному партнеру советуется начать доконтактную профилактику (PrEP, ДКП).
Почему важно регулярно проходить тестирование на ВИЧ?
Зная результат обследования, вы избавитесь от неопределенности, связанной с тревожными размышлениями о том, что у вас может быть ВИЧ-инфекция, но вы не знаете об этом.
Плюсы тестирования:
Если результат теста показал, что у вас нет ВИЧ-инфекции, но при этом вы знаете, что ваше поведение связано с риском инфицирования, вы можете узнать, как быть осторожнее, дабы избежать инфицирования в будущем.
Впрочем, о тестировании не стоит забывать даже тем, кто состоит в моногамных отношениях: вы не можете знать наверняка, верен ли ваш партнер. Более того, испытывая чувство вины, он может стыдиться рассказывать вам о тех случайных связях, которые были у него на стороне.
Большинство тестов определяют не сам ВИЧ, а антитела к нему: иммунная система начинает вырабатывать их после того, как вирус попадает в организм. У 97 % людей антитела к ВИЧ выявляют в срок от 3 до 12 недель после инфицирования. В течение этого срока проверку можно проходить как в лабораторных условиях (ИФА-диагностика), так и при помощи домашней тест-системы — по крови или слюне.
Более чувствительные тесты (ИФА четвертого поколения) выявляют антигены, которые являются частью самого вируса и появляются в достаточном для определения количестве, пока антитела еще не появились. Подобные тест-системы показывают результат на сроке в 2—6 недель после инфицирования.
ПЦР-диагностика выявляет не антитела или антигены, а генетический материал вируса. Из-за высокой стоимости и сложности этот метод используется реже других. Он способен показать точный результат в срок от 1 до 4 недель.
Более подробно о том, каким бывает тестирование, вы можете узнать, вернувшись к оглавлению данного раздела.
ВИЧ-положительными называют людей, чей тест на ВИЧ показал положительный результат. То есть вирус в организме этого человека есть.
ВИЧ-отрицательными — людей, чей тест не обнаружил следов вируса в организме.
Знайте: тот факт, что у кого-то из вас обнаружена ВИЧ-инфекция, вовсе не означает, что вы должны отказываться от секса и/или отношений.
Но это значит, что как можно скорее вам нужно начать антиретровирусную терапию. От этого зависит ваше здоровье и здоровье вашего партнера.
Не бойтесь АРВ-терапии: несмотря на то, что в прошлом многие препараты от ВИЧ были весьма токсичны, сегодня они ничуть не опаснее других лекарств. Свои побочные эффекты есть и у них, но всех их можно избежать, если правильно подобрать схему лечения.
Запомните: схема подбирается врачом! Именно он обладает всеми необходимыми знаниями, чтобы определить, какие именно таблетки и по какому графику вам необходимо принимать. Не занимайтесь самолечением!
Если вы столкнулись с побочными эффектами, сообщите об этом вашему лечащему врачу в центре СПИД и попросите его подобрать для вас альтернативную схему терапии.
Как оценивают эффективность АРВТ и от чего она зависит?
Для оценки эффективности и неэффективности лечения используются разные критерии: вирусологические, иммунологические и клинические.
Вирусологическая эффективность — это уменьшение вирусной нагрузки до неопределяемой (менее 20 копий/мкл). Чем быстрее и значительнее упадет вирусная нагрузка, тем дольше терапия будет эффективной. Если через 6 месяцев после начала терапии вирусная нагрузка сохраняется выше порога определения — это вирусологическая неэффективность.
Причинами вирусологической неэффективности лечения могут быть:
низкая приверженность пациента лечению, то есть пропуск приема препаратов; несоблюдение других условий приема лекарств, например, таких как сочетание с пищей, межлекарственные взаимодействия; резистентность вируса к проводимой АРТ.
Иммунологическая эффективность — это увеличение количества CD4+ T- клеток. В разных исследованиях критерием иммунологического ответа служит прирост количества CD4+ T-клеток на 50 в микролитре, на 100 в мкл или на 200 в мкл. Или превышение CD4+ T-клетками порога в 200 кл/мкл или 500 кл/мкл. Под иммунологической неэффективностью подразумевается отсутствие прироста CD4+ T-клеток.
Стадия СПИДа наступает только в том случае, если количество CD4+ ниже 200 кл/мкл.
Клиническая эффективность
Клинический успех лечения оценивается как отсутствие СПИД- индикаторных заболеваний. Уменьшение выраженности общих симптомов.
Клинический успех лечения напрямую связан с вирусологическим и иммунологическим ответом на лечение.
Как рассказать партнеру, с которым я встречаюсь, что у меня ВИЧ?
Многие люди с ВИЧ-инфекцией сталкивались с отказом в отношениях, когда рассказывали о ВИЧ партнерам, с которыми встречались, из-за чего им было тяжело в дальнейшем принимать решение о раскрытии своего статуса.
Рассказать о себе партнеру будет проще, если вы предварительно обсудите это с другими ВИЧ-позитивными людьми или с профессионалом, работающим в этой сфере.
Однако помните, что ваш диагноз касается в первую очередь вас — это ваш личный мир, очень глубокая и интимная часть вас и вашей жизни.
От того, как и при каких обстоятельствах вы это преподнесете, будет зависеть реакция вашего партнера. Лучше всего рассказывать о том, что у вас ВИЧ-инфекция, тогда, когда вы сами приняли свой диагноз, а значит, перестал испытывать чувства вины и стыда, связанные с диагнозом.
Потому что состояние, находясь в котором, мы делимся чем-то сокровенным, отражается на собеседнике.
Теперь меня бросят, и я останусь один?
Нет. Не обязательно. Конечно, такая новость может огорчить и даже напугать вашего любимого человека, но это вовсе не означает, что он обязательно должен вас из-за этого бросить.
В мире много пар, в которых один из партнеров имеет положительный ВИЧ-статус, и эти пары остаются вместе, несмотря на ВИЧ.
Общение и честность являются ключевыми факторами укрепления и успешного развития отношений. Вы оба должны четко говорить о том, как вы чувствуете себя и что вы хотите друг от друга. Вам обоим нужно уметь внимательно слушать и слышать друг друга.
Вместо послесловия
В течение всех последних лет количество людей с ВИЧ в России растет, количество инфицированных от общего их числа равняется примерно одному проценту, то есть с ВИЧ живет практически каждый сотый россиянин. Это очень много.
Значительная часть из них — совсем не представители уязвимых групп, а гетеросексуальные мужчины и женщины, никогда не употреблявшие наркотиков.
Один из ста — совсем немного? Но это закон статистики: тем самым сотым может стать каждый. Вне зависимости от образа жизни, вероисповедания и социального статуса.
Более того, среди российских геев или мужчин, практикующих секс с мужчинами, носителем вируса по разным оценкам является каждый десятый или даже каждый пятый.
Это очень много. Именно поэтому Фонд помощи людям, живущим с ВИЧ, как и многие другие ВИЧ-сервисные организации, регулярно проводит анонимное бесплатное тестирование на ВИЧ.
В любое время пройти абсолютно анонимный тест (для этого не нужны ни прописка, ни паспорт) можно в открытом пространстве фонда СПИД.ЦЕНТР по адресу:
Москва, ул. Нижняя Сыромятническая, д. 11, с.1, офис 313.

Обзор
Распространенность СПИДа в мире на 2009 год.
Автор
Редакторы

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Иммунная система

Рисунок 1. Упрощенная схема иммунного ответа. Молниями указано, как один тип клеток активирует другие. Мф — макрофаг, Б — бактерия, ТХ — Т-хелпер, ВКл — B-клетка, ПлКл — плазматическая клетка, Ат — антитела, Б+Ат — бактерия, покрытая антителами, привлекающими макрофагов, В — вирус, ЗМф — зараженный макрофаг, ТК — Т-киллер, ЗК — клетка, зараженная вирусом, УК — умирающая (апоптотирующая) клетка, В+Ат — вирус, покрытый антителами.
рисунок автора статьи
Жизненный цикл ВИЧ
Видео. Жизненный цикл ВИЧ.

Таким образом, после того как копия вируса в геноме клетки начинает действовать, на её поверхности появляются знакомые нам белки gp41 и gp120, в цитоплазме — остальные вирусные белки и вирусная РНК. И через некоторое время от зараженной клетки начинают отпочковываться всё новые и новые копии ВИЧ.
Способы уничтожения иммунной системы
При отпочковывании вирус использует клеточную мембрану клетки, и со временем это должно вызвать ее разрушение. К тому же, вирусный белок Vpu вызывает увеличение проницаемости мембраны клетки [6]. При активации вируса в клетке появляется неинтегрированная в геном двуцепочечная ДНК [19], наличие которой может рассматриваться клеткой как повреждение ее генетического материала и индуцировать ее смерть через апоптоз (С точки зрения организма такая клетка потенциально может стать раковой). Помимо этого, вирусные белки напрямую нарушают баланс про- и противоапоптотических белков в клетке. К примеру, вирусная протеаза p10 может разрезать противоапоптотический фактор Bcl-2. Белки Nef [26], Env [22] и Tat [24] вовлечены в возрастание количества клеточных белков CD95 и FasL, служащих индукторами апоптоза по т.н. Fas-опосредованному пути. Белок Tat положительно регулирует каспазу 8 [2] — ключевой фактор индукции апоптоза.
Если же клетки не погибли сами, они активно уничтожаются Т-киллерами. (Это стандартный ответ иммунитета на заражение любыми вирусами.)
Помимо этого, при производстве gp120 и Tat часть их выбрасывается зараженной клеткой в кровоток, а это оказывает токсическое действие на организм [4], [28]. gp120 оседает на все СD4 + -клетки (в том числе и здоровые), что имеет три последствия:
- Белок СD4 важен для взаимодействия Т-хелпера с фагоцитом, при слипании же СD4 с gp120 T-хелпер перестает выполнять эту функцию.
- На gp120 как на чужеродный белок образуются антитела; после оседания gp120 на здоровые клетки, последние маркируются антителами, и иммунная система их уничтожает [9].
- После обильного связывания Т-хелпером gp120 клетка умирает сама. Дело в том, что CD4 — это корецептор. Он усиливает сигнал от TCR (T-cell receptor) — главного белка, позволяющего выполнять Т-клеткам функцию иммунитета. В норме эти рецепторы активируются вместе. Если же активируется один тип рецепторов, но не активируется другой, это является сигналом, что что-то пошло не так, и клетка умирает посредством апоптоза.
Антитела, призванные препятствовать инфекции, в случае с ВИЧ часто, наоборот, ее усиливают [28]. Почему так происходит — не совсем понятно. Одну причину мы рассмотрели выше. Возможно, дело в том, что антитела сшивают несколько вирусных частиц вместе, и в клетку попадает не один, а сразу много вирусов. Помимо этого, антитела активируют клетки иммунитета, а в активированной клетке вирусные белки синтезируются быстрее.
Вдобавок, gp120 и gp41 имеют участки, похожие на участки некоторых белков, участвующих в иммунитете (например, MHC-II [25], IgG [23], компонент системы комплемента Clq-A [14]). В результате на эти участки образуются антитела, способные помимо вируса маркировать совершенно здоровые клетки (если на них будут эти белки), с соответствующими для них последствиями.
Так как на поверхности зараженной клетки появляется gp120, то она, как и вирусная частица, будет сливаться с другими СD4-содержащими клетками, образуя огромную многоядерную клетку (синцитий), неспособную выполнять какие-либо функции и обреченную на смерть.
На самом деле, помимо Т-хелперов, СD4 содержатся во множестве других клеток — предшественниках Т-киллеров/Т-хелперов, дендритных клетках, макрофагах/моноцитах, эозинофилах, микроглии (последние четыре — разновидности фагоцитов), нейронах (!), мегакариоцитах, астроцитах, олигодендроцитах (последние две — клетки, питающие нейроны), клетках поперечно-полосатых мышц и хорионаллантоиса (присутствует в плаценте) [29]. Все эти клетки способны заражаться ВИЧ, но сильно токсичен он лишь для Т-хелперов. Это и определяет основное клиническое проявление СПИДа — сильное снижение количества Т-хелперов в крови. Однако для других клеток заражение тоже не проходит бесследно — у больных СПИДом часто снижена свертываемость крови, имеются неврологические и психиатрические отклонения [16], наблюдается общая слабость.
Пути заражения ВИЧ
Внимание! Ввиду того, что СПИД является венерическим заболеванием, информация, приведенная в этом разделе, может вас оскорбить либо вызвать неприятные эмоции при прочтении. Будьте осторожны.
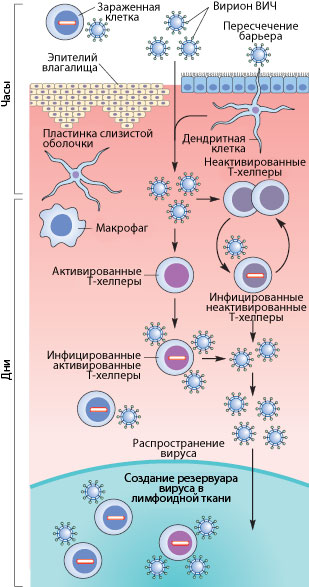
Рисунок 3. Пути проникновения ВИЧ в организм при половом контакте. Слева указано примерные временные рамки каждого этапа.
Как же происходит первичное заражение человека ВИЧ? Думаю, что с переливанием крови или с использованием общего шприца при употреблении наркотиков читателю все понятно — вирус доставляется напрямую из зараженной крови в здоровую. При вертикальном способе передачи инфекции (от матери к ребенку) заражение может произойти во время внутриутробного развития, в момент родов или в период кормления ребенка грудью (т.к. вирус и зараженные вирусом клетки содержатся в молоке матери) [17], [20]. Тем не менее, даже у ребенка, рожденного от ВИЧ-инфицированной матери, есть шанс остаться здоровым, особенно если мать использует ВААРТ (высокоактивную антиретровирусную терапию) [5]. А почему же люди заражаются при половом контакте?
Механизмы передачи вируса при половом акте не до конца ясны. Тем не менее, они понятны в общих чертах. Итак, рассмотрим барьеры, которые необходимо преодолеть вирусу, чтобы добраться до макрофагов и Т-хелперов. К сожалению, рассматривать особо нечего: барьер только один — это слой эпителиальных клеток и вырабатываемая ими слизь, находящиеся во влагалище (а также пенисе, прямой кишке, глотке). Барьер этот тонок — он может быть всего одну клетку в толщину, — но для вируса труднопреодолим, доказательством чего может служить сравнительно небольшой процент заражений — примерно 1–2 случая на 100 половых контактов. Итак, и какими же путями преодолевает вирус это препятствие?
Наиболее очевидный механизм — это микротравмы. При обычном половом контакте, а особенно при анальном сексе, почти неизбежно появляются микротрещины; при наличии же венерических заболеваний часто возникают изъязвления слизистой. Через эти микротравмы вирус, содержащийся в сперме и влагалищном секрете, может проникнуть к иммунокомпетентным клеткам [17], [20].
Помимо дендритных клеток, в кишечнике существует другой тип клеток, предназначенный для ознакомления организма с антигенами внешней среды. Это так называемые М-клетки, пропускающие через себя довольно крупные объекты неповрежденными из просвета кишечника. В т.ч. через них может проходить и вирион ВИЧ.
Свой вклад в заражение вносит и провоспалительный процесс, в норме присутствующий в женских половых путях из-за наличия в них спермы. Благодаря ему Т-клетки подвержены активации, что способствует их восприимчивости к инфекции.
Итак, риск заразиться ВИЧ возрастает в ряду (Классический секс → Анальный секс → переливание крови / использование общих шприцов при принятии наркотиков). Что же касается орального секса, то весьма небольшой шанс заразиться есть только у принимающей стороны — слюна и тем более желудочный сок инактивирует ВИЧ. Теоретически, этим способом может заразиться и мужчина, но для этого необходимы ранки на пенисе.
При поцелуях и обычных бытовых контактах вирус не передается — он очень неустойчив в окружающей среде .
Заключение
. Все эти факты позволяют надеяться, что вскоре ВИЧ, как и оспа, останется в прошлом.

Новость
Комплекс-белок Cas9/sgRNA/viral RNA (слева) и модель вируса иммунодефицита человека (справа), построенная коллективом Visual science.
Автор
Редактор

Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсор публикации этой статьи — Виктор Татарский.
Врага нужно знать в лицо
Об иммунитете, апоптозе и вообще.
Иммунная система развивалась сотни миллионов лет. По типу реакции ее обычно делят на врожденный (неспецифичный) и приобретенный (специфичный) иммунитет [1], [2]. Считается, что специфичный (то есть вырабатываемый к конкретному патогену) иммунитет впервые появился у челюстноротых (рыб и всех вышестоящих по эволюционному древу таксонов) после отделения от бесчелюстных (миног и миксин), хотя у вторых имеется аналогичная система защиты [3]. К клеткам специфичного иммунитета относят В-лимфоциты, Т-лимфоциты и NK-клетки (естественные киллеры, natural killer cells). Помимо этого существуют моноциты, которые хоть и не являются истинными инструментами приобретенного иммунитета, однако выполняют некоторые функции по нейтрализации патогена: фагоцитоз, презентация антигена, выделение бактерицидных веществ и цитокинов.

Рисунок 1. Взаимодействия Т-киллеров (слева) и Т-хелперов (справа) с зараженными клетками. Для передачи сигнала о заражении необходимо выполнение двух условий: контакт комплекса МНС-патоген с TcR (T-cell Receptor, рецептор Т-клеток) и CD. Двигаясь по организму, Т-лимфоциты проверяют каждую клетку на предмет наличия у нее антигена в комплексе с МНС. Их можно сравнить с подслеповатой глуховатой бабушкой, пришедшей забирать дитятко из детского сада. Для опознания ей надо подойти вплотную и по нескольким (в данном случае по двум) признакам определить, ее ли это чадо или нет.
Т-лимфоциты, в свою очередь, необходимы для уничтожения клеток, зараженных внутриклеточными паразитами, и опухолевых клеток. Они делятся на два основных типа в зависимости от класса рецепторов, находящихся на внешней стороне их мембраны.
Т-киллеры несут CD8 рецепторы и отвечают за:
Т-хелперы имеют CD4 рецепторы и ответственны за секрецию цитокинов, которые:
- активируют макрофаги для борьбы с внутриклеточными паразитами;
- способствуют продукции антител В-лимфоцитами.
Но не менее важна роль Т-хелперов в подготовке зрелых Т-киллеров из клеток-предшественниц, активации NK-клеток и моноцитов.
Как же происходит опознавание антигена на молекулярном уровне? Здесь надо упомянуть еще об одном очень важном классе рецепторов — МНС (Major Histocompability Complex или главном комплексе гистосовместимости). Они бывают двух классов: I и II. МНС I присутствует на поверхности всех ядерных клеток организма человека. Он необходим для опознавания клетки натуральным киллером и Т-киллером (рис. 1, 2). Если по какой-то причине МНС I изменен, несет на себе антиген или отсутствует, клетка будет подвергнута апоптозу. МНС II находится на поверхности В-лимфоцитов, макрофагов и дендритных клеток. Он необходим для презентации антигена Т-хелперам (рис. 1, 2). Жизнь пула Т-хелперов можно представить как прогулку с ребенком в зоопарке, только вместо животных — антигены, вместо ребенка — Т-хелпер, а вместо взрослых, объясняющих, кто есть кто, — три перечисленных типа клеток.

Рисунок 2. Процесс передачи сигнала Т-киллеру и Т-хелперу. Первый этап — сборка комплекса МНС-антиген, второй этап — презентация комплекса на поверхности клетки.
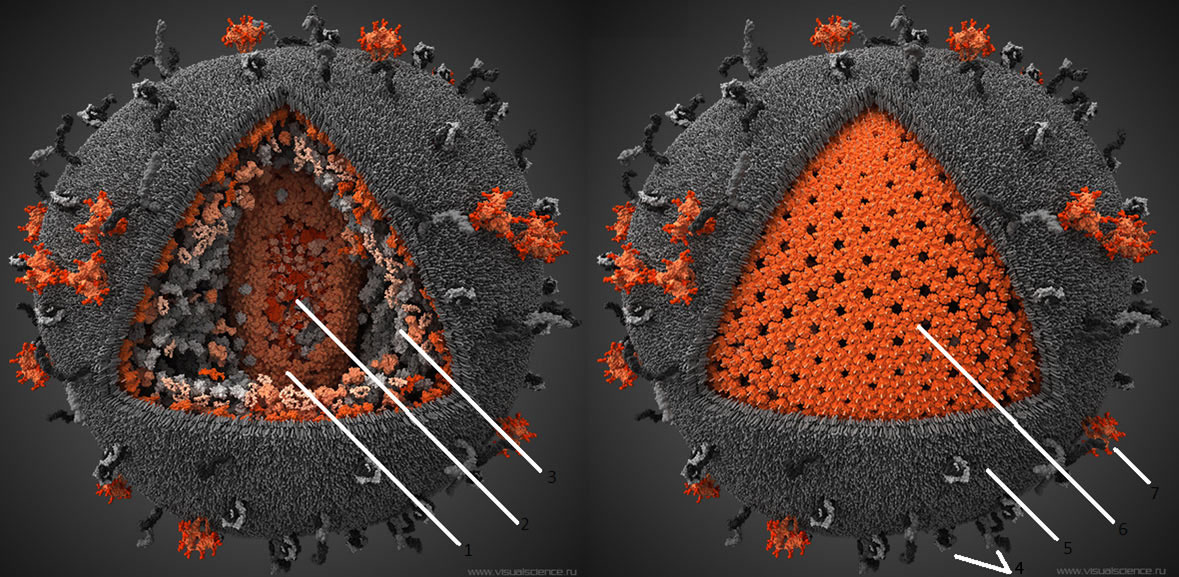
Первый этап проникновения вируса в клетку — взаимодействие вирусного белка gp120 (рис. 3) с рецептором CD4. Отсюда понятно, почему ВИЧ размножается именно в Т-хелперах. Взаимодействию способствуют корецепторы CCR5 и CXCR4 [8]. В норме они являются рецепторами цитокинов, а при взаимодействии ВИЧ с клеткой их связь является необходимым условием проникновения вируса внутрь. Мутации в генах этих рецепторов обеспечивают частичную устойчивость носителей таких мутаций (таких людей около 2%, причем некоторые штаммы вируса все равно могут их поражать) [9]. Затем в мембрану клетки погружается белок gp41, после чего мембрана вируса сливается с клеточной, и происходит распаковка генетического материала. По принципу обратной транскрипции с РНК-матрицы вируса с помощью фермента ревертазы (обратной транскриптазы) синтезируются молекулы кДНК (комплементарной ДНК). Синтезированная кДНК вставляется вирусной интегразой в геном клетки хозяина. После попадания в геном хозяина вирус может никак себя не проявлять до нескольких лет — протекает так называемый инкубационный период. Только когда клетки активно пролиферируют, а значит, синтезируют белки на матрице ДНК, начинается сборка вирусных частиц , выход их из клеток и гибель последних (так как каждая частица забирает с собой часть клеточной мембраны клетки, вирусы попросту разрывают клетку).

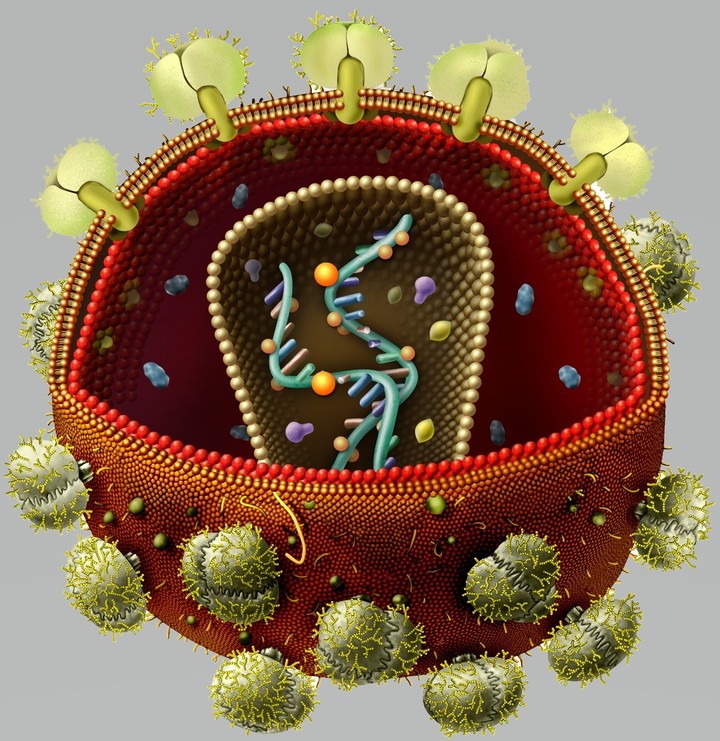
Рисунок 3. Строение ВИЧ. Белки gp120 и gp41 участвуют в рецепции вируса клеткой и проникновении вирусной частицы внутрь. Липидная оболочка захватывается от клетки хозяина вместе с частью мембранных белков. Белки матрикса синтезируются в клетке после встраивания кДНК в геном в момент наработки клеточных белков для деления. Протеаза, возможно, необходима для разрезания противоапоптотического фактора Bcl-2 [9]. Ферменты обратная транскриптаза и интеграза создают кДНК на матрице РНК и встраивают кДНК в геном Т-хелпера соответственно. Tat — белок, вовлеченный в индукцию апоптоза. Нуклеокапсид — комплекс из РНК и белков вируса, представляющий собой компактную упакованную форму генома. Капсид — белковая оболочка, защищающая содержимое от воздействия внешних условий.
Как иммунитет бактерий правит геномы
Система редактирования геномов CRISPR/Cas известна уже довольно давно (впервые локус описал в 1987 году Есизуми Исино из университета Осаки), но только недавно (в 2005 году) ученые поняли ее истинное предназначение [11], [12].
Как вы уже поняли, система состоит из двух компонентов: CRISPR-локуса (Clustered Regularly Interspaced Short Palindromic Repeats или сгруппированные и регулярно разделенные короткие палиндромные повторы) и белков Cas, которые, являются нуклеотид-специфичными эндонуклеазами (а название получили за работу в команде с CRISPR — Crispr associated).
Помимо CRISPR-локуса и блока генов Cas в ДНК бактерии (не обязательно в нуклеоиде [12]) находится ген tracrРНК (transactivated crispr RNA), частично комплементарной палиндромам.
Для формирования специфичной устойчивости к вирусу бактерия, как и человек, должна встретиться с ним дважды.
Первый раз после внедрения вирусной ДНК в клетку происходит разрезание ДНК белками Cas1 и Cas2 на протоспейсеры и встраивание их в начало CRISPR-локуса. Cas1 и Cas2 формируют при этом комплекс, причем Cas2 играет только структурную роль, удерживая ДНК, тогда как Cas1 встраивает ее. Каждый протоспейсер вставляется в CRISPR-локус так, чтобы от другого (уже имеющегося) спейсера его отделял палиндром.
Соответственно, после транскрипции ДНК всего комплекса образуются три продукта (рис. 4):
- tracrРНК;
- РНК белка Cas (наиболее изученным является Cas9, поэтому далее повествование пойдет о нем), далее транслирующаяся;
- pre-crРНК (poly-spacer precursor crRNA или многоспейсерный предшественник crРНК), которая представляет собой транскрипт спейсеров, разделенных образовавшимися из палиндромов шпильками или петлями.

Рисунок 4. Строение CRISPR-локуса и результат транскрипции. leader — лидерная последовательность, отвечающая за начало транскрипции, со стороны которой вставляется новый спейсер. repeat — палиндромный повтор, который после транскрипции превращается в шпильку или петлю.
Второй этап — образование комплекса pre-crРНК/Cas9/РНКаза III. Очевидно, что вся длинная pre-crРНК не может участвовать в опознавании инвазивной ДНК, так как, во-первых, очень длинна, что конформационно неудобно, а во-вторых, при сравнении спейсеров РНК с протоспейсерами инвазивной ДНК длинный транскрипт начнет путаться и в итоге образует клубок, непригодный для дальнейшей работы. Самое логичное — разделить длинную последовательность на короткие участки, которые могли бы проверятся на соответствие инвазивной ДНК белком Cas9. И тащить за собой не надо, и не запутается.
С помощью фермента РНКазы III и при участии tracrРНК pre-crРНК разделяется по границам повторов так, что в белково-нуклеиновый комплекс входят один спейсер и один повтор, комплементарно связанный с tracrРНК (рис. 5) [13]. Повтор полностью теряет свою вторичную структуру, tracrРНК же оставляет несколько шпилек (обычно три).

Рисунок 5. Белково-нуклеиновый комплекс после созревания транскрипта. crРНК состоит из спейсера (слева) и повтора, соединенного с частью tracrРНК (справа). Три петли на tracrРНК нужны для удержания ее эндонуклеазой Cas9.
- комплементарность спейсера комплекса Cas9/crРНК/tracrРНК протоспейсеру инвазивной (например, вирусной) ДНК;
- наличие в геноме вируса около протоспейсера последовательности из трех нуклеотидов — РАМ (Protospacer Adjacent Motif, прилежащий к протоспейсеру мотив).
Таким образом клетка страхуется от уничтожения своей ДНК. Но даже просто разрезанная в одном месте вирусная ДНК может представлять опасность, поэтому завершает инактивацию негомологическое сращивание концов (non-homologous end joining, NHEJ). При этом происходит инсерция/делеция одного или нескольких нуклеотидов, что приводит к потере инфекционности.

Рисунок 6. Полная схема механизма работы CRISPR/Cas9 системы. а — Транскрипция CRISPR локуса с образованием pre-crРНК. б, в — Разрезание РНК РНКазой III и образование комплексов Cas9/tracrРНК/crРНК. г — Вторичное проникновение в клетку чужеродной ДНК. д — Соединение комплекса с инвазивной ДНК. е — Образование двухнитевого разрыва в протоспейсере.
А где же тут редактирование геномов? А вот где:
- во-первых, таким образом можно просто нокаутировать целевой ген и добиться прекращения экспрессии того или иного белка;
- во-вторых, после создания двухцепочечного разрыва в образовавшуюся брешь можно вставить нужный нам ген и заставить организм синтезировать нужный нам белок.

Рисунок 7. Сравнение искусственной (а) и естественной (б) систем CRISPR/Cas9. Отличие состоит лишь в том, что искусственная РНК едина, а природная — состоит из двух частей, гены которых разделены.
Битва века
Однако вернемся к теме этой статьи.
Так как система редактирования геномов может помочь в избавлении от ВИЧ? Очень просто: вирус можно вырезать! Нацелив Cas9, путем создания sgРНК с последовательностью, комплементарной вирусной кДНК.
Некоторое время назад группа ученых из немецкого Института экспериментальной вирусологии и иммунологии уже пыталась использовать инструмент редактирования геномов для удаления ВИЧ из культуры HeLa [15]. Они модифицировали Cre-рекомбиназу методом направленной эволюции и один из полученных вариантов использовали для удаления вируса путем контролируемой рекомбинации [16]. Однако надо учитывать, что между Т-хелперами и опухолевой HeLa есть немало различий, к тому же, авторы не предлагают вариантов доставки или экспрессии гена Tre-рекомбиназы (усовершенствованный вариант фермента Cre).
С другой стороны, группа американских исследователей опубликовала в марте этого года статью [17], где подробно описывались метод доставки и механизм удаления вируса. Ученые ставили перед собой задачу не только полностью избавить клеточную культуру Т-хелперов от вируса, но и проверить отсутствие цитотоксического действия самой CRISPR/Cas9 системы. Единственный недостаток этого геномного инструмента в том, что из-за сравнительно небольшой длины спейсера, даже при наличии страхующего элемента PAM, в больших геномах могут быть найдены нецелевые сайты, подверженные разрезанию (off-target sites). Именно поэтому исследователи уделяли данной проблеме немало внимания.
Работа проводилась с использованием штамма ВИЧ-1 и клеточной линии Т-хелперов 2D10, зараженной вирусом в покоящейся стадии. Доставка и экспрессия sgРНК/Cas9 осуществлялась с помощью лентивирусного вектора.
Для оценки того, вырезался ли вирус из двух мест встраивания (1-я и 16-я хромосомы), было проведено полногеномное секвенирование. Оно показало, что в клетках, где экспрессировались и гены Cas9, и sgРНК, провирусная ДНК отсутствует.
Был проведен анализ того, могут ли гены, куда встроился провирус (RSBN1 и MSRB1), и близлежащие гены нормально транскрибироваться после его вырезания. Ученые показали, что как RSBN1, так и MSRB1 нормально экспрессируются. Соседние гены также не претерпели изменений.
С помощью биоинформатических методов и анализа баз данных было показано, что sgРНК/Cas9 не проявляет активности по отношению к нецелевым сайтам.
Таким образом, можно с уверенностью сказать, что группа Камински впервые успешно удалила ВИЧ из культуры зараженных Т-хелперов. Данное достижение приблизило человечество к победе на ВИЧ. Да, это только культура клеток. Да, до внедрения данной техники в медицину пройдут годы, а может и десятки лет, но данная работа является уникальной в своем роде, ибо ученые не только бросили вызов одному из страшнейших заболеваний на планете, но и смогли победить его — пусть даже масштаб сражения пока невелик.
Перспективы применения данной технологии очевидны: введя пациенту вектор, содержащий гены Cas9 и sgРНК, мы добьемся их экспрессии и полного удаления вируса из клеток. Современная терапия, направленная против ретровирусов, являющаяся основным средством борьбы с ВИЧ, не удаляет вирус из клеток, так как провирус остается встроенным в ДНК хозяина. В свою очередь, данный подход не оставляет вирусу шансов укрыться.
Читайте также:

