Вирусный сепсис что это такое
Обновлено: 25.04.2024
Сепсис (инфекционное заражение крови) – это тяжелое патологическое состояние, которое описывается, как нахождение возбудителя (микроба или грибков) в крови.
Развитие септического процесса является опасным для жизни состоянием и при несвоевременном лечении может приводить к гибели человека.
Возбудителями могут становиться микробы или патогенные грибки. Основными микробными агентами являются:
- синегнойная палочка, патогенные штаммы стафилококка,
- патогенные штаммы кишечной палочки,
- пневмококк, менингококк, клебсиелла,
- туберкулезная микобактерия,
- в редких случаях может возникать сепсис, вызванный грибками Candida или другими видами грибков.
Процесс развивается в случае снижения общей сопротивляемости организма к инфекции, истощения иммунной системы хроническими инфекционными процессами или наличием гнойных очагов, в случае снижения защитной функции естественных барьеров – кожи, кишечника, легких.
В результате организм не может локализовать и уничтожить микробы, они беспрепятственно проникают в кровь, в то время как в крови, за счет нарушения иммунитета, снижено количество бактерицидных компонентов и иммунных клеток.
В каждом конкретном случае очаги первичной инфекции могут быть разными – от кариозных зубов и миндалин, до абсцессов в брюшной полости и гнойных ран кожи.
Обычно сепсис возникает
- при диабете,
- при онкологических заболеваниях,
- при рахите или иммунодефицитах (врожденных или приобретенных),
- при тяжелых травмах или ожогах,
- при длительном приеме иммуносупрессоров или в случае длительной рентгено- и химиотерапии.
Выделяется несколько видов сепсиса, отличающихся по механизму развития и типам возбудителей:
- Кожный сепсис - очаги инфекции первично возникают на коже (ожоги, раны, гнойные процессы).
- Ротовой (оральный) сепсис - первичные очаги расположены в полости рта или глотке (кариозные полости, пульпиты, остеомиелиты челюсти, миндалины, заглоточные абсцессы).
- Акушерский (гинекологический) с первичными очагами в матке или половой сфере после родов, при воспалительных процессах малого таза.
- Отогенный сепсис, с первичным очагом в области среднего уха или рядом с ним.
- Хирургический (диагностический) - возникает после оперативных вмешательств с заносом инфекции или после проведения диагностических манипуляций.
- Криптогенный, с неизвестным или невыясненным первичным очагом заражения.
- Внутрибольничный сепсис - особое состояние, характеризующееся инфицированием опасными штаммами микробов, устойчивых к терапии.
В отличие от обычных инфекций, сепсис имеет особенные условия протекания. Для него характерно:
- Обязательное наличие первичного очага, пусть даже и невыясненного, но он имеется всегда. Причем, этот очаг должен быть тесно связан с кровеносными или лимфатическими путями.
- При сепсисе возбудитель должен многократно проникать в кровь (это состояние называют септицемией).
- Характерно формирование вторичных инфекционных очагов, в которых размножается возбудитель и вновь проникает в кровь (септикопиемия).
- Организм не в состоянии обеспечить должный иммунный ответ на инфекцию и активизировать защитные реакции клеток и тканей против возбудителей.
Только при наличии всех этих условий выставляется диагноз сепсиса.
Признаки сепсиса во многом зависят от первичного очага и типа возбудителя, но для септического процесса характерно несколько типичных клинических симптомов:
- сильные ознобы,
- повышение температуры тела (постоянное или волнообразное, связанное с поступлением в кровь новой порции возбудителя),
- сильная потливость со сменой нескольких комплектов белья за сутки.
Это три основных симптома сепсиса, они являются наиболее постоянными проявлениями процесса. К ним в дополнение могут быть:
- бледность кожи и слизистых, восковой цвет лица,
- усталость и безучастность пациента, изменения в психике от эйфории до сильной апатии и ступора,
- впалые щеки с сильно выраженным румянцем на щеках на фоне общей бледности,
- кровоизлияния на коже в виде пятен или полосок, особенно на руках и ногах,
- герпесоподобные высыпания на губах, кровоточивость слизистых,
- нарушение дыхания, снижение давления,
- уплотнения или гнойнички на коже,
- уменьшение объема мочи.
Процесс может развиваться по следующим сценариям:
- молниеносно – развивается за 1-3 суток,
- остро - развивается спустя 4-60 суток с момента формирования первичного очага,
- подостро - течение длится от двух до шести месяцев,
- хронически - длится более полугода,
- рецидивирующе - чередуются периоды развития сепсиса с периодами полного здоровья.
Диагноз устанавливается при наличии типичной картины сепсиса с подтверждением его лабораторными данными.
Производится посев крови и отделяемого из очагов воспаления. Проведение посевов с обнаружением возбудителя должно быть многократным, так как у возбудителей существуют жизненные циклы, а проведение терапии может существенно изменять картину крови и уровня микроба в ней.
При обнаружении в крови и содержимом первичного очага аналогичных микробов, диагноз подтверждается.
Для уточнения лечения проводится еще и определение чувствительности микробов к антибиотикам.
Кроме того, проводятся общий анализ крови с выявлением воспалительной картины, биохимический анализ крови с выявлением воспалительных сдвигов, газовый состав, электролитный состав и ее свертываемость.
Проводят рентген грудной клетки, УЗИ внутренних органов с поиском первичных очагов инфекции.
Одни и те же симптомы могут быть признаками разных заболеваний, а болезнь может протекать не по учебнику. Не пытайтесь лечиться сами — посоветуйтесь с врачом.
Сепсис лечится только в инфекционном или терапевтическом стационаре, в отделении реанимации и интенсивной терапии.
Принципы лечения аналогичны лечению других очагов инфекции, но учитываются общее тяжелое состояние и риск летального исхода.
- антибиотики в максимальных дозах с учетом чувствительности, внутривенно.
- проводят активную борьбу с токсикозом,
- активизируют собственную иммунную систему, корректируют нарушенные процессы жизнедеятельности.
Необходимо создание покоя и изоляции, назначается особая диета, в случае тяжелого состояния – искусственное внутривенное питание.
Важно удаление инфекции из первичного очага, применение двух и более антибиотиков иногда в сочетании с гормонами.
При необходимости больным производят вливание плазмы крови, гамма-глобулина и глюкозы.
При формировании вторичных гнойных очагов необходимо их хирургическое лечение – вскрытие абсцессов, удаление гноя и промывание ран, иссечение пораженных участков.
Не смотря на все мероприятия, прогноз при сепсисе серьезный – летальность достигает 60%, инвалидизация после перенесенного сепсиса также довольно высока.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Сепсис: причины появления, симптомы, диагностика и способы лечения.
Определение
Сепсис – это патологический процесс, в основе которого лежит реакция организма в виде генерализованного воспаления на инфекцию различной природы. При сепсисе бактерии преодолевают иммунную защиту человека и распространяются из очага воспаления по всему организму. Местное воспаление, сепсис, тяжелый сепсис и септический шок – это различные формы выраженности воспалительной реакции организма на инфекционный процесс.

Истинная частота возникновения случаев сепсиса остается неизвестной, однако по оценкам исследователей, во всем мире сепсис является лидирующей причиной летальности у пациентов в критическом состоянии. Согласно результатам большого европейского исследования SOAP, включившего 3147 пациентов из 198 европейских медицинских центров, сепсис развился в 37,4% случаев, а госпитальная летальность от него колебалась от 14% случаев в Швейцарии до 41% в Португалии, в среднем составив 24,1%. Данные другого крупного исследования PROGRES (12 881 больной тяжелым сепсисом в 37 странах) показали, что госпитальная летальность в среднем составила 49,6%.
Причины возникновения сепсиса
Возбудителями сепсиса могут быть бактерии, вирусы или грибы. Но чаще сепсис имеет бактериальную природу - его причиной становятся стафилококки, стрептококки, пневмококки, менингококки, сальмонеллы, синегнойная палочка и др.
В большинстве случаев патологический процесс вызывают условно-патогенные микроорганизмы, которые присутствуют на коже, слизистых оболочках дыхательного и пищеварительного трактов, мочевыводящих путей и половых органов. Иногда при сепсисе выделяют сразу 2-3 микроорганизма.
Причиной сепсиса могут стать гнойно-воспалительные заболевания кожи (абсцессы, фурункулы, флегмоны), обширные травмы, ожоги, инфекционно-воспалительные заболевания мочевыводящей системы (пиелонефрит), живота (например, гнойно-некротический деструктивный панкреатит), тяжелая ангина, гнойный отит, пневмония, инфицирование во время родов или абортов и др.

Возможность возникновения сепсиса зависит не только от свойств возбудителя, но и от состояния иммунной системы человека - нарушения в ее работе предрасполагают к распространению инфекции. Причинами таких нарушений могут быть врожденные дефекты иммунитета, хронические инфекционные болезни (ВИЧ, гнойные процессы), эндокринные заболевания (сахарный диабет), онкологические болезни, хронические интоксикации (алкоголизм, наркомания), проникающая радиация, прием иммуносупрессоров (кортикостероидов, цитостатиков) и др.
В ответ на внедрение возбудителя вырабатываются цитокины – особые белковые молекулы, которые выполняют защитные функции сначала на местном уровне, а затем, попадая в системный кровоток, продолжают работать уже на уровне всего организма. Цитокины бывают провоспалительными и противовоспалительными. В самом начале инфекционного процесса их количество находится в равновесии. Если регулирующие системы организма не способны поддерживать это равновесие, то цитокины накапливаются в кровотоке в сверхвысоких объемах, начинают доминировать их деструктивные, разрушающие эффекты, в результате повреждается сосудистая стенка, запускается синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) и полиорганная дисфункция. Вследствие полиорганной дисфункции печени, почек, кишечника появляются новые повреждающие факторы (лактат, мочевина, билирубин и др.), которые усиливают деструктивные процессы. При ДВС-синдроме в сосудах микроциркуляторного русла образуются множественные тромбы в сочетании с несвёртываемостью крови, приводящей к множественным кровоизлияниям.
Классификация заболевания
В зависимости от локализации входных ворот и первичного очага сепсис подразделяют на:
- перкутанный (чрескожный) – развивается при попадании возбудителя в организм через поврежденный кожный покров (ранки, царапины, фурункулы и др.);
- акушерско-гинекологический – развивается после родов и абортов;
- оральный (одонтогенный и тонзиллогенный) – развивается в результате первичной инфекции в полости рта;
- оториногенный – развивается в результате распространения инфекции из полости уха и/или носа;
- пневмогенный – при наличии инфекционного очага в нижних дыхательных путях;
- хирургический;
- урологический;
- пупочный – развивается у новорожденных вследствие проникновения инфекционных агентов в кровь через пупочную ранку;
- криптогенный (идиопатический, эссенциальный, генуинный) – сепсис неизвестного происхождения: первичный очаг гнойного воспаления неизвестен.
- молниеносный сепсис,
- острый сепсис,
- подострый сепсис,
- хронический сепсис (хрониосепсис).
По клиническим признакам:
1. Синдром системного воспалительного ответа (ССВО) – системная реакция организма на воздействие различных сильных раздражителей (инфекции, травмы, операции и др.) характеризуется двумя или более признаками:
- температура тела ≥ 38°С или ≤ 36°С;
- частота сердечных сокращений (ЧСС) ≥ 90 ударов в минуту;
- частота дыхания (ЧД) > 20 в минуту или гипервентиляция (РаСО2 ≤ 32 мм рт. ст.);
- лейкоциты крови > 12х109 /л или < 4х109 /л, или незрелых форм >10%.
По виду и характеру возбудителя:
- аэробный сепсис,
- анаэробный сепсис,
- смешанный сепсис,
- грибковый сепсис,
- вирусный сепсис.
Клинические проявления сепсиса могут варьировать от незначительных до критических. При молниеносном течении патологическое состояние развивается бурно - за несколько часов или суток. При остром сепсисе симптомы развиваются за несколько дней. Для хрониосепсиса характерно вялое течение и наличие малозаметных изменений, формирующихся месяцами. Рецидивирующий сепсис протекает с эпизодами обострений и затуханий.
Инкубационный период после выявления ворот инфекции или первичного очага составляет от 1 до 3-5 суток. Начало сепсиса, как правило, острое, хотя иногда может быть подострым или постепенным. Интоксикация проявляется резкой слабостью, адинамией, анорексией, нарушением сна, головной болью, расстройством сознания, менингеальным синдромом (поражением оболочек головного и спинного мозга), тахикардией, артериальной гипотензией. Температура тела держится высокой, со скачками утром и вечером. Признаки интоксикации особенно выражены на высоте лихорадки. На коже у трети больных появляется геморрагическая сыпь.
Со стороны дыхательной системы наблюдаются одышка и хрипы в легких. При нарушении функции почек снижается количество выделяемой мочи (олигурия) вплоть до полного прекращения мочеиспускания (анурия), в моче появляются следы крови, гноя. Наблюдается ухудшение функции печени с развитием желтухи и явлениями гепатита, увеличивается селезенка. Повреждение органов ЖКТ проявляется нарушением пищеварения, отсутствием аппетита, язык сухой, обложенный, нередко наблюдаются упорные септические поносы, тошнота и рвота. Метастазирование возбудителя из первичного очага с образованием вторичных очагов инфекции может приводить к инфаркту легкого, гангрене легкого, гнойному плевриту, эндокардиту (поражению внутренней оболочки сердца), воспалению сердечной мышцы (миокардиту), воспалению околосердечной сумки (перикардиту), гнойному циститу, абсцессам мозга и воспалению оболочек мозга (гнойному менингиту), гнойным артритам, флегмонам и абсцессам в мышцах.
Недостаточность функции одного органа длительностью более суток сопровождается летальностью до 35%, при недостаточности двух органов – 55%, при недостаточности функции трех и более органов летальность к четвертому дню возрастает до 85%.
Производят посевы крови, мочи, ликвора, мокроты, гнойного экссудата из элементов сыпи, абсцессов, пунктатов плевры, суставов и других септических очагов. Посевы делают многократно, чтобы определить чувствительность к максимальному количеству антибиотиков. Используется также обнаружение антигенов в крови методом ИФА и определение генома возбудителя методом ПЦР.
Одним из наиболее специфичных и чувствительных маркеров бактериальной инфекции служит прокальцитониновый тест. Прокальцитонин – один из основных маркёров системного воспаления, вызванного бактериями.
Синонимы: Анализ крови на прокальцитонин; ПКТ. Procalcitonin; PCT. Краткая характеристика определяемого вещества Прокальцитонин Прокальцитонин является прогормоном кальцитонина, состоящим из 116 аминокислот с молекулярной массой 14,5 кDa. Биосинтез прокальцитонина в физиологических условиях прои.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Отек легких: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.
Определение
Отек легких определяется как жизнеугрожающее состояние, для которого характерен процесс накопления внесосудистой жидкости в легких. Отек может развиться внезапно при большой и разнообразной по своей природе группе заболеваний и нарастать стремительно.
Функции легочного кровообращения – газообмен и фильтрация крови, регуляция водного и электролитного баланса, участие в метаболических процессах. Транспорту крови способствует низкое давление в системе малого круга кровообращения и относительно низкие показатели сопротивления сосудов току крови.
Жидкость из кровеносных сосудов просачивается за их пределы в окружающие ткани либо из-за слишком высокого давления в кровеносных сосудах, либо из-за недостаточного количества белков в кровотоке, чтобы удерживать жидкость в плазме крови.
Непосредственно за пределами мелких кровеносных сосудов в легких находятся крошечные воздушные мешочки – альвеолы. Альвеолы разделены тонкими эластичными стенками (мембранами), внутри которых проходят мельчайшие кровеносные сосуды (капилляры), позволяющие молекулам кислорода и углекислого газа перемещаться через мембраны. Жидкость попадает в альвеолы в том случае, если мембраны теряют свою целостность, что приводит к затруднению дыхания и плохому насыщению крови кислородом.
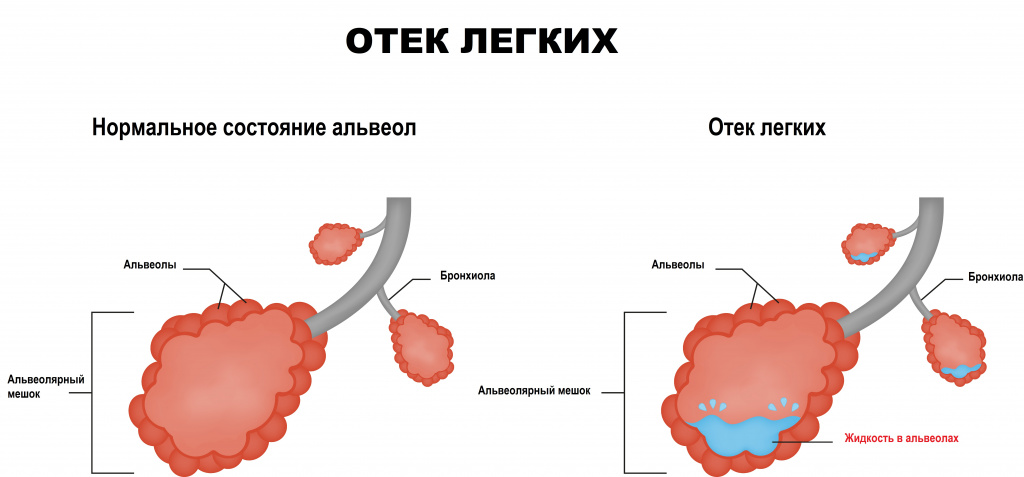
Выделяют два патогенетических процесса, с которыми связывают развитие отека легких:
Первый обусловлен повышением гидростатического давления в микрососудах малого круга кровообращения. Жидкость, электролиты и белки выходят за пределы сосудистой стенки и аккумулируются в интерстициальном (межсосудистом) пространстве легкого. На следующем этапе накопление жидкости происходит на поверхности альвеол, что становится причиной резкого ухудшения функции газообмена в легких и приводит к развитию гипоксемии.
Второй процесс связан с нарушением проницаемости альвеолярно-капиллярной мембраны из-за острого повреждения легочной ткани, которое может происходить при сепсисе, травме, пневмонии и некоторых других заболеваниях. Этот процесс также сопровождается гипоксемией и одышкой различной степени выраженности. В конечной фазе развития отека легких происходит аномальное накопление белков, в первую очередь альбуминов, в альвеолярной жидкости.
Разновидности отека легких
Кардиогенный отек легких встречается преимущественно при заболеваниях сердца или сосудов как осложнение острой сердечной недостаточности и связан с повышением гидростатического давления. У больного человека можно наблюдать тахикардию, кашель и одышку, которые возникают вследствие систолической или диастолической дисфункций левого желудочка.
Некардиогенный отек легких развивается вследствие повышенной проницаемости сосудистой стенки альвеолярных капилляров. Основным клиническим проявлением является развитие острого респираторного дистресс-синдрома.
По варианту течения выделяют следующие виды отека легких:
- Молниеносный – развивается в течение нескольких минут, в большинстве случаев приводит к летальному исходу.
- Острый – отмечается быстрое (на протяжении 4 часов) нарастание выраженности клинических симптомов. Вероятность летального исхода довольно высока и возникает на фоне инфаркта, черепно-мозговой травмы, анафилактического шока.
- Подострый – имеет волнообразное течение, характеризуется чередованием активных и спокойных периодов. Причиной часто является печеночная недостаточность. Имеет достаточно благоприятный прогноз, особенно при своевременном начале мероприятий неотложной помощи.
- Затяжной – симптомы нарастают в течение 12 часов со стертой клинической картиной, что значительно затрудняет диагностику. Основой являются хроническая сердечная недостаточность или заболевания бронхолегочной системы.
К основным причинам развития кардиогенного отека легких относятся:
- инфаркт миокарда с подъемом сегмента ST электрокардиограммы;
- гипертонический криз;
- пароксизм мерцательной аритмии (эпизод, длящийся от 30 секунд до семи дней, проходит самостоятельно или при помощи лечения).
- недостаточность митрального клапана (отрыв хорды сосочковой мышцы).
- постинфарктный и атеросклеротический кардиосклероз с систолической сердечной недостаточностью;
- диастолическая дисфункция миокарда у пожилых больных;
- систолическая и диастолическая дисфункция миокарда у больных с кардимиопатией или миокардитом;
- постоянная форма мерцательной аритмии;
- врожденные и приобретенные пороки левых отделов сердца;
- поражения клапанного аппарата, особенно митрального клапана, вследствие ревмокардита, инфекционного эндокардита, атеросклероза.
Основные легочные причины и факторы риска острого респираторного дистресс-синдрома:
- пневмония,
- вирус COVID-19,
- тромбоэмболия легочной артерии,
- ингаляционная травма,
- аспирационный синдром,
- травма грудной клетки,
- респираторные вирусные заболевания,
- эмфизема легких,
- бронхиальная астма,
- туберкулез легких,
- рак легких или метастазы в легкие.
- тяжелый сепсис и септический шок,
- переливание крови и кровезаменителей,
- большая кровопотеря,
- черепно-мозговые травмы, множественные и обширные травмы, ожоги,
- острое нарушение мозгового кровообращения,
- менингит, энцефалит,
- панкреонекроз,
- острая почечная недостаточность, острый гломерулонефрит,
- отравление химическими веществами, лекарственными средствами, алкоголем, наркотическими веществами,
- инфекционные заболевания, протекающие с тяжелой интоксикацией (грипп, корь, дифтерия, скарлатина, коклюш, столбняк, брюшной тиф),
- цирроз печени,
- патология беременных (эклампсия, синдром гиперстимуляции яичников),
- анафилактический шок,
- иммерсионный отек легких, вызванный плаванием на глубине.
В детском возрасте проблемы с сердцем наблюдаются намного реже, чем во взрослом. Поэтому основными причинами отека легких становятся заболевания дыхательной системы или серьезные травмы.
К каким врачам обращаться при отеке легких
Диагностика и обследования при отеке легких
Для установления диагноза обычно достаточно проведения клинического обследования и рентгенографии грудной клетки.
Рентгенологическое исследование структуры легких с целью диагностики различных патологий.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Определение
Вирус SARS-CoV-2 распространяется в микроскопических частицах жидкости, выделяемых больным человеком во время кашля, чихания, разговора, пения или тяжелого дыхания и попадает на слизистые носа, рта, либо глаз другого человека.
Кроме того, вирус может также распространяться контактно-бытовым путем, когда частицы с вирусом, находящиеся на поверхностях или предметах, через руки попадают на слизистые респираторного тракта.
Передача инфекции аэрозольным путем происходит в закрытых, переполненных и плохо вентилируемых помещениях.
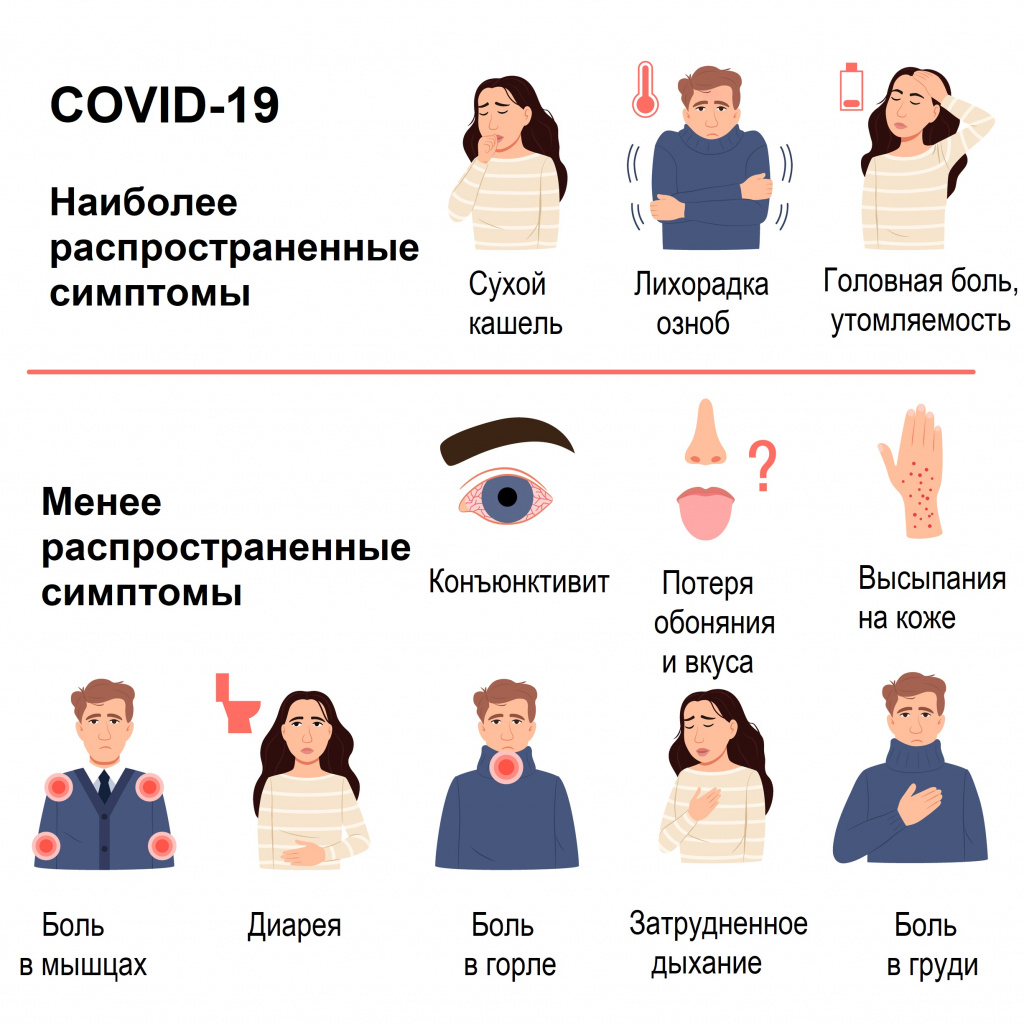
Симптомы COVID-19 при тяжелой и средней тяжести форме заболевания
Наиболее распространенные симптомы
- Одышка, учащенное дыхание (55%).
- Усиление кашля, появление мокроты (30-35%).
- Кровохарканье (5%).
- Потеря аппетита (20%).
- Спутанность сознания (9%).
- Ощущение сдавления и заложенности в грудной клетке (> 20%).
- Температура тела выше 38°С (80%) более 5 дней.
- Насыщение крови кислородом по данным пульсоксиметрии (SpO2) ≤ 95% (до 20%).
- тахикардия,
- дефицит витамина D,
- раздражительность,
- судороги,
- тревожность,
- угнетенное состояние,
- нарушения сна.
Важно! Симптомы могут не обнаруживаться во время инкубационного периода COVID-19 или проявляться в любой комбинации (например, без температуры). Точный диагноз устанавливает врач по результатам обследований.
У пациентов старше 65 лет может наблюдаться атипичная картина заболевания, которая включают делирий (помутнение сознания), нарушения речи, двигательные расстройства, а также более тяжелые и редкие неврологические осложнения – инсульт, воспалительное поражение мозга и другие.
Большинство (около 80%) пациентов, у которых появляются симптомы заболевания, выздоравливают без госпитализации. Примерно у 15% пациентов развивается серьезная форма заболевания, при которой необходима кислородотерапия, а у 5% – крайне тяжелая форма, требующая лечения в условиях отделения интенсивной терапии.
Отличия новой коронавирусной болезни COVID-19 от ОРВИ и гриппа
COVID-19 тоже относится к ОРВИ – острым респираторным вирусным инфекциям, характеризующимся сходными симптомами: кашель, насморк, повышение температуры, головная боль, першение и боли в горле. Наиболее четко выраженную клиническую картину вызывают вирусы гриппа, парагриппа, аденовирусы. Коронавирус может протекать в более тяжелой форме, нежели другие ОРВИ, приводя к осложнениям и даже летальному исходу. Именно поэтому крайне важно отличать новый тип коронавируса от относительно безобидной простуды.
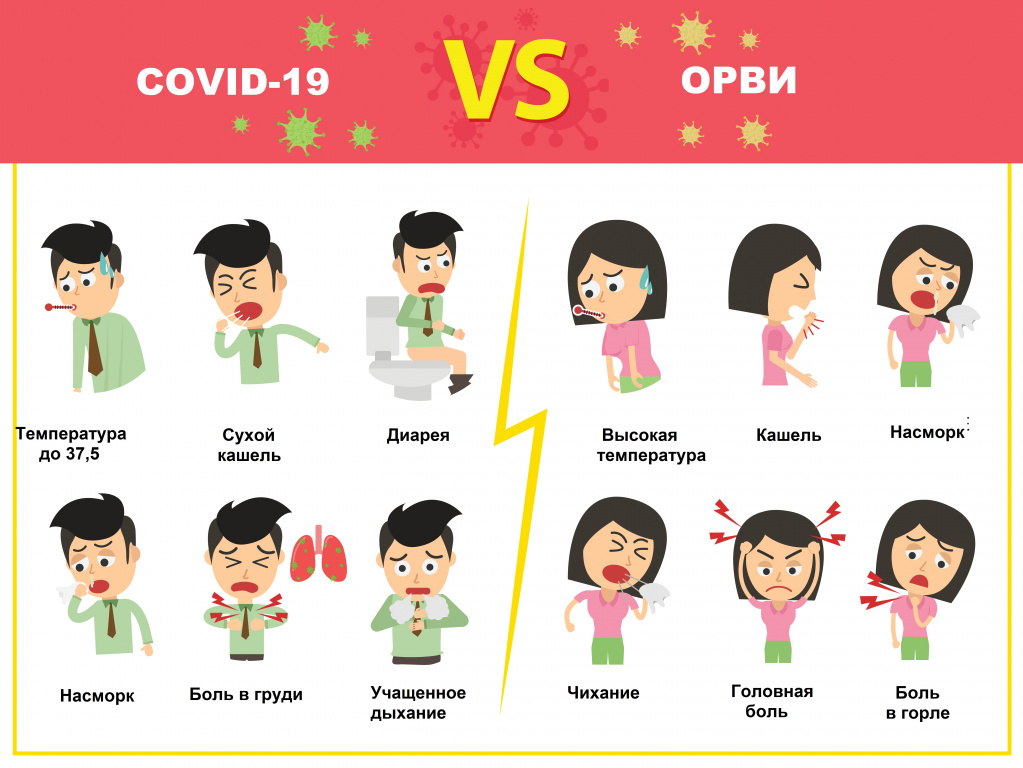
В чем отличие коронавируса от гриппа
Надо отметить, что COVID-19 и грипп имеют много общего:
- передаются воздушно-капельным и контактным путем;
- могут проявляться ломотой в суставах, головной болью, сильной слабостью и общим ощущением разбитости;
- могут возникать кишечные расстройства.
- Грипп начинается остро с повышения температуры сразу до фебрильных значений (39-40⁰С). На первый план выступают симптомы общей интоксикации: головная боль, слабость, боли в мышцах и суставах, слезотечение, боль в глазах.
- Коронавирус развивается постепенно - от общего недомогания в первые дни до выраженных симптомов, включая значимое повышение температуры тела через неделю.
Другие заболевания со схожими симптомами
Пневмонии, в том числе атипичные.
Аллергии. Одышка, проблемы с обонянием и другие симптомы могут возникать в результате воздействия аллергенов. Проблему решают антигистаминные препараты, которые при вирусной инфекции неэффективны.
Бронхиальная астма, которая также дает о себе знать затрудненным дыханием и мучительным кашлем, но имеет неинфекционную природу.
Отличаются ли симптомы у детей и у взрослых?
Дети составляют лишь около 2% от числа всех заболевших COVID-19. При этом они легче переносят коронавирусную инфекцию и часто являются ее бессимптомными носителями.
Протекание COVID-19 у детей разного возраста:
От 1 года до 3 лет
Инфекция обычно проявляется как легкое недомогание. Характерные симптомы COVID-19 не наблюдаются. Иногда присутствует потеря аппетита, которая проходит через 2-3 дня и никак не сказывается на общем самочувствие малыша.
Дети в этом возрасте болеют около семи дней и выздоравливают без осложнений. У них может появиться осиплость голоса и легкая заложенность носа. Кашля нет, не исключены редкие чихания.
У младших школьников и подростков может наблюдаться незначительное повышение температуры тела и легкое недомогание. Возможен сухой кашель, еще реже - головная боль.
По данным Роспотребнадзора, легкая форма заболевания, как правило, обусловлена сильным иммунитетом пациента.
Иммунная система детей и подростков, как правило, хорошо подготовлена к борьбе с вирусами. Они могут заразиться, но заболевание у них протекает в более мягкой форме или вообще бессимптомно.
Этапы развития заболевания с учетом симптомов
Симптомы коронавируса у взрослого человека по дням
1-3-й день. Заболевание начинается с легкого недомогания, незначительного повышения температуры, заложенности носа и боли в мышцах, как при ОРВИ или гриппе.
3-5-й день. Повышается температура тела, возможен несильный, поверхностный кашель. Может пропасть обоняние, а вкусовые ощущения сильно измениться. Возникают пищеварительные расстройства, выражающиеся, в том числе, диареей. Этот период считается кульминацией легкой формы течения COVID-19.
5-10-й день. Важный период для определения тяжести заболевания коронавирусной инфекцией. У 80% заболевших COVID-19 наблюдаются улучшения, которые через несколько дней могут привести к полному выздоровлению. Второй сценарий подразумевает ухудшение состояния, которое проявляется увеличением количества и тяжести симптомов. При таком развитии событий у пациента появляются сильный насморк, изнуряющий кашель, озноб, боль в теле, одышка.
10-12-й день. Этот период характеризуется сильной одышкой, болью в груди, прогрессированием слабости, бледностью, что свидетельствует о развитии пневмонии. Повреждение легких приводит к кислородному голоданию. Требуется госпитализация. Это состояние считается среднетяжелым.
12-14-й день. При COVID-19 75% пациентов с вирусной пневмонией начинают идти на поправку в среднем через 2 недели от начала заболевания. Однако тем, у кого развивается тяжелая форма заболевания, может потребоваться искусственная вентиляция легких.
14-30-й день. На излечение от тяжелой формы пневмонии, вызванной коронавирусом, требуется в среднем до двух недель с момента наступления серьезного осложнения.
Но даже после полного выздоровления может сохраняться одышка в легкой форме, проявляться слабость и недомогание в течение длительного времени (до нескольких месяцев).
- Поражение только верхних отделов дыхательных путей.
- Пневмония без дыхательной недостаточности.
- Острый респираторный дистресс-синдром (пневмония с острой дыхательной недостаточностью).
- Сепсис, септический (инфекционно-токсический) шок.
- Синдром диссеминированного внутрисосудистого свертывания, тромбозы и тромбоэмболии.
- Насыщение крови кислородом менее 88%.
Цитокиновый шторм при COVID-19 - реакция организма на воспалительный процесс, приводящая к тому, что иммунные клетки атакуют не только вирус, но и ткани собственного организма. Следствием этого может стать разрушение тканей и органов, и, как следствие, гибель организма.
Очень важно, что иногда COVID-19 опасен не только пневмонией и ее осложнениями, но и негативным влиянием на сосуды, мозг и сердце, что повышает риск развития инсульта. В таких случаях у пациента наблюдается головокружение, могут случаться обмороки, синеет лицо и немеют мышцы.
Симптомы, свидетельствующие о процессе выздоровления
Внимание! Временные интервалы течения болезни условны, они зависят от индивидуальных особенностей организма. COVID-19 в легкой форме, как правило, протекает не более 14 дней. Но подтвердить окончательное выздоровление может только тест на антитела.
Учитывая тяжесть заболевания, процесс выздоровления может проходить по-разному. Критерий выздоровления – если два последовательно сделанных теста на коронавирус методом ПЦР дали отрицательный результат.
Для проведения исследования в медицинских офисах необходимо предъявить СНИЛС и документ удостоверяющий личность. Запись на исследование В случае получения положительного или сомнительного результата на COVID-19 и при необходимости проведения подтверждающего тестирования обра.
Уросепсис — это генерализованный неспецифический инфекционно-воспалительный процесс, вызванный проникновением в кровяное русло уроинфекционных патогенов и их токсинов. Проявляется внезапным ухудшением состояния, гипертермией, ознобами, тахикардией, олигурией, симптомами общей интоксикации, усугубляющими основную уропатологию. Диагностируется с помощью общего и биохимического анализов крови и мочи, УЗИ, КТ мочевыводящих органов, экскреторной урографии, микробиологических методов исследования. Для лечения уросепсиса проводится хирургическая санация очага инфекции в комбинации с антибактериальной, инфузионной, дезинтоксикационной, иммуномодулирующей терапией.
МКБ-10
Общие сведения
Впервые о лихорадочных приступах, возникших после катетеризации и операций на уретре, в 1833-1837 годах сообщили французские хирурги А. Вельпо и Ж. Сивиаль. В 1899 году были описаны острая и хроническая формы мочевой лихорадки. В настоящее время распространенность уросепсиса в индустриально развитых европейских странах достигает 16,5-33 случаев на 100 тысяч населения, показатель продолжает ежегодно увеличиваться, при этом возрастает количество заболеваний, вызванных грамположительной флорой и кандидами.
По данным российских исследований, летальность при урогенной форме сепсиса остается стабильно высокой и составляет от 35 до 65%. Заболевание больше распространено у мужчин, что связано с более частым проведением эндоскопических инвазивных вмешательств у пациентов мужского пола.

Причины уросепсиса
Возбудителями заболевания являются те же микроорганизмы, которые обычно высеиваются у пациентов, страдающих острыми и хроническими инфекционными болезнями мочевыделительных органов. В 79-80% случаев уросепсис вызывается грамотрицательной условно-патогенной микрофлорой, в первую очередь – кишечной палочкой, реже — протеем, синегнойной палочкой, клебсиеллой, серратией, у 10-10,5% больных — грамположительными бактериями (энтерококками, эпидермальным стафилококком), в 0,75% наблюдений — кандидами. У 9% пациентов определяются полимикробные ассоциации. По мнению специалистов в сфере урологии и нефрологии, предпосылками, способствующими генерализации уроинфекции, являются:
- Воспалительные урологические заболевания. Обычно септическое состояние осложняет уже существующий инфекционный процесс. Более чем у половины больных уросепсис развивается на фоне острого и хронического пиелонефрита, особенно их апостематозных форм. Основной для генерализации инфекции также могут стать пионефроз, карбункул почки, паранефрит, острый абсцедирующий простатит, эпидидимит, гангрена Фурнье и др.
- Уростаз. Провоцирующим фактором активного размножения патогенной флоры является нарушение естественного пассажа мочи, обусловленное ренальными и постренальными причинами. Наиболее высок риск возникновения уросепсиса у пациентов с мочекаменной болезнью и обструкцией камнем мочеточника. Застой мочи возможен при стриктурах уретры, сморщенном мочевом пузыре, мочеточниково-влагалищных свищах, других обтурационных процессах.
- Медицинские манипуляции. Распространению инфекции способствует недостаточная санация мочевыводящих путей перед урологическими вмешательствами и нарушение техники их выполнения. Уросепсис может диагностироваться после грубой катетеризации мочевого пузыря, уретроскопии, цистоскопии, трансуретральной резекции простаты, мочевого пузыря, чрескожной нефролитотомии, других диагностических и лечебных вмешательств.
- Сопутствующая патология. Условно-патогенная микрофлора чаще активируется и бурно размножается у больных сахарным диабетом, хронической печеночной недостаточностью, кардиопатологией. Снижению иммунитета способствует прием иммуносупрессивных препаратов, применяемых для лечения аутоиммунных заболеваний, злокачественных опухолей, предотвращения отторжения трансплантированной почки или других органов.
Патогенез
По результатам последних исследований в области иммунологии и генетики, при уросепсисе бактериальный агент играет роль пускового фактора, запускающего каскадную гиперергическую воспалительную реакцию. В ответ на действие микробных эндотоксинов происходит активация комплемента, стимулирующая выделение гистамина. На фоне эндотоксемии повышается активность свертывающей системы крови, усиливаются адгезивные свойства тромбоцитов и нейтрофилов, в больших количествах выделяются медиаторы воспаления, кислородные радикалы, протеазы. В конечном итоге это приводит к множественному повреждению сосудистого эндотелия с последующим развитием полиорганной недостаточности. У части больных на фоне септицемии формируются вторичные гнойные метастазы в других органах.
Классификация
При выделении различных форм уросепсиса учитывают тип возбудителя, механизм его проникновения в кровоток, фазу и особенности клинического течения септического процесса. Различают бактериальные, вирусные, грибковые варианты заболевания. При наличии источника инфекции в органах мочевыводящего тракта уросепсис называют эндогенным, при инфицировании во время инвазивных процедур — экзогенным. Наиболее значимой для прогнозирования исхода и разработки оптимальной врачебной тактики является классификация процесса по динамике нарастания и выраженности симптоматики. Существуют следующие клинические формы септического состояния:
- Бактериемический уросептический шок. Самый неблагоприятный вариант течения расстройства. Отличается молниеносным нарастанием симптомов, выраженной полиорганной недостаточностью, высокими (до 60-65%) показателями летальности. Выявляется у 9,1% пациентов.
- Острый уросепсис. Обычно проявляется 2-3 общетоксическими атаками с ознобом и выраженной гипертермической реакцией. Хорошо поддается лечению. У некоторых больных принимает затяжной характер. Диагностируется в 56,6% случаев урогенных септических процессов.
- Подострый уросепсис. Интоксикационная симптоматика менее выражена. Заболевание имеет затяжной характер без четко ограниченных атак. Ведущим клиническим проявлением является стойкая гипертермия, сохраняющаяся до 2-3 месяцев. Определяется у 30% больных.
- Хронический уросепсис. Встречается у 4,3% пациентов. Не имеет острого периода. Симптоматика нарастает постепенно или проявляется волнообразно в виде обострений. Температура обычно повышается до субфебрильных цифр. Часто возникает почечная недостаточность.
Септический процесс развивается поэтапно и может быть стабилизирован на любой стадии. Начальная токсемическая фаза уросепсиса (синдром системной воспалительной реакции) характеризуется циркулированием в крови бактериальных эндотоксинов и развитием гиперергического воспаления. В септицемической фазе отмечается бактериемия, которая в дальнейшем может осложниться формированием гнойных метастазов (фаза септикопиемии).
Симптомы уросепсиса
Основными клиническими проявлениями молниеносной и острой форм заболевания являются резкое ухудшение состояния больного, длительно страдающего урологическим заболеванием либо перенесшего инвазивное вмешательство на мочевыводящих органах, высокая температура тела, сильный озноб, судороги, значительная тахикардия. Прогностически неблагоприятным симптомом считается гипотермия ниже 35,5° С. При уросепсисе часто наблюдается нарушение оттока мочи, уменьшение ее количества. Появляются и нарастают признаки общей интоксикации в виде головных болей, слабости, тошноты.
При присоединении сосудистых нарушений отмечается падение артериального давления, побледнение кожных покровов, оглушенность, спутанность, потеря сознания, мелкоточечные кровоизлияния. Для подострой и хронической форм уросепсиса характерен длительный субфебрилитет, который периодически можно сменяться кратковременными подъемами температуры до фебрильных цифр. У таких пациентов на фоне клинической симптоматики основного урологического расстройства сильно выражены интоксикационные астеновегетативные нарушения — быстрая утомляемость, слабость, головокружения, потливость, сердцебиение.
Осложнения
При стремительном прогрессировании симптомов, неадекватной терапии, нарастании коагулопатических расстройств уросепсис осложняется ДВС-синдромом. У 58,7% пациентов выявляется почечная недостаточность, у 55,5% появляются метастатические гнойные очаги в различных органах, у 42,2% поражается печень — возникает токсический гепатит, острая печеночная недостаточность, гепаторенальный синдром. В 14,8% случаев наблюдаются кровотечения разной локализации, в том числе из стрессовых язв желудка. На фоне полиорганной недостаточности повышается риск развития респираторного дистресс-синдрома, тяжелой энцефалопатии вплоть до септического психоза и мозговой комы. Уровень смертности при тяжелых септических процессах достигает 65%.
Диагностика
О возможном начале уросепсиса свидетельствует связь общетоксической реакции с предшествующим урологическим заболеванием или инвазивным вмешательством на органах мочевыделительной системы. Диагностический поиск направлен на выявление признаков системного воспаления, первичного инфекционного очага, определение возбудителя инфекционного процесса и его чувствительности к антибиотикам, оценку функциональной состоятельности почек. Рекомендованными методами обследований при подозрении на уросепсис являются:
- Общий анализ мочи. При наличии бактериальной уроинфекции определяется лейкоцитурия, бактериурия, возможна протеинурия. У пациентов, которые страдают мочекаменной болезнью, при микроскопии выявляют кристаллы солей (оксалатов, фосфатов, уратов). Присутствие неизмененных эритроцитов может указывать на травматическое повреждение слизистых при эндоскопии.
- Общий анализ крови. О развитии уросепсиса свидетельствуют выраженные воспалительные изменения показателей. Диагностически значимым является лейкоцитоз до 12х10 9 /л и более, лейкопения менее 4х10 9 /л, выявление более 10% незрелых форм лейкоцитов. СОЭ обычно ускоряется до 20 мм/ч и выше. При тяжелом течении снижаются уровни тромбоцитов и лимфоцитов.
- Сонография. УЗИ забрюшинного пространства позволяет обнаружить морфологические изменения почечной паренхимы, конкременты, обструкцию, скопления гноя. Преимуществами сонографии являются неинвазивность и возможность использования в качестве скринингового метода диагностики уропатологии. При необходимости УЗИ дополняют УЗДГ почек.
- Контрастная рентгенография. На основании данных о естественном пассаже рентгеноконтрастного вещества по мочевыводящему тракту оценивают особенности строения и функциональную активность почечной паренхимы, определяют конкременты в чашечно-лоханочной системе. В ходе экскреторной урографии выявляют обтурацию мочеточников и другие причины застоя мочи.
- КТ-урография. Благодаря созданию послойных изображений органов и тканей КТ мочевыделительных органов позволяет визуализировать абсцессы, кисты, опухоли, расширение чашечек и лоханок, другие морфологические нарушения в почках, забрюшинном пространстве. С учетом возможного нарушения фильтрации предпочтительным является бесконтрастное сканирование.
В качестве альтернативных или дополнительных методов диагностики могут быть рекомендованы МСКТ почек, МСКТ цистоуретрография, МРТ урография. Для определения возбудителя выполняется посев мочи на микрофлору и трехкратный бактериологический посев крови. Поскольку даже при самом тщательном проведении исследования микробиологическая верификация уросепсиса возможна лишь у половины пациентов, для выявления системного воспаления оценивают содержание в сыворотке крови прокальцитонина — суррогатного маркера генерализованной инфекционно-воспалительной реакции.
Меньшей специфичностью отличается повышение концентрации С-реактивного белка, альбуминов, отдельных фракций глобулинов. Для обнаружения возможной почечной дисфункции применяют биохимический анализ крови на креатинин, азот мочевины, мочевую кислоту, калий, назначают нефрологический комплекс. Дифференциальную диагностику уросепсиса проводят с хирургическими, акушерскими септическими состояниями, перитонитом, тяжелыми формами пиелонефрита, пионефроза, паранефрита, карбункулом и абсцессом почки, эндогенными интоксикациями (уремической, раковой). Диагностику и лечение осуществляет специалист-уролог или нефролог, по показаниям назначаются консультации других специалистов.
Лечение уросепсиса
Основными задачами при урогенных септических состояниях являются элиминация возбудителя, коррекция полиорганных расстройств, восстановление гомеостаза. С учетом тяжести состояния пациента рекомендуется госпитализация в палату интенсивной терапии урологического или реанимационного отделения и соблюдение строгого постельного режима. Этиотропное лечение уросепсиса предполагает эффективную санацию инфекционного очага и проведение адекватной антибактериальной терапии. Антибиотики назначают в два этапа:
- Эмпирическая антибиотикотерапия. Осуществляется до получения результатов бактериологического исследования. Схема лечения обычно включает комбинацию цефалоспоринов IV поколения с аминогликозидами или карбапенемы. При возможном инфицировании грамположительными микроорганизмами терапию дополняют трициклическими гликопептидами.
- Целенаправленная антибиотикотерапия. После получения данных о чувствительности возбудителя уросепсиса применяют соответствующий антибактериальный препарат узконаправленного действия. Во избежание формирования терапевтически резистентных штаммов микроорганизмов противомикробную терапию продолжают до 4-6 дня нормализации температуры.
Чтобы восстановить адекватную тканевую и органную перфузию, корректировать расстройства гомеостаза, уменьшить токсемию, проводят активную инфузионную и противошоковую терапию. При значительной артериальной гипотензии и дефиците ОЦК под контролем диуреза вводят кристаллоидные и коллоидные растворы, плазмозаменители, альбумин, прямые антикоагулянты, ксантиновые ингибиторы фосфодиэстеразы, селективные β₁-адреномиметики.
Пациенту с уросепсисом обеспечивают адекватное энтеральное питание специальными сбалансированными смесями. Для усиления иммунитета назначают заместительную терапию специфическими иммуноглобулинами, используют иммуномодуляторы. Эффективность лечения существенно возрастает при хирургической санации очага инфекции не позднее двух часов после диагностирования уросепсиса. С учетом состояния пациента выполняют чрескожную пункционную или классическую открытую нефростомию.
Для нормализации пассажа мочи при обструктивных состояниях может применяться эпицистостомия, уретеролитотомия, уретеролитоэкстракция. При значительной деструкции печеночной паренхимы показана экстренная нефрэктомия. С детоксикационной целью в предоперационном периоде и после операции рекомендованы экстракорпоральные методы: плазмаферез, плазмосорбция, гемофильтрация, гемодиафильтрация.
Прогноз и профилактика
Хотя при поздней диагностике и неэффективной терапии уросепсис характеризуется высокой вероятностью летального исхода, выявление расстройства на стадии токсемии позволяет снизить смертность с 65% до 7,5%. Профилактика основана на грамотной санации очагов уроинфекции, устранении обструкции мочевыводящих путей, проведении превентивной антибиотикотерапии перед диагностическими и лечебными урологическими вмешательствами, соблюдении техники выполнения медицинских процедур. Важную роль в предупреждении уросепсиса играют контроль своевременного опорожнения мочевого пузыря, снижающий риск избыточного накопления патогенов, укрепление иммунитета, исключение переохлаждений.
2. Уросепсис - актуальная проблема современной урологии/ Учваткин Г.В., Гайворонский Е.А. // Урологические ведомости. – 2017.
3. Этиопатогенетические аспекты развития гнойно-септических осложнений и уросепсиса у пациентов с урологическими заболеваниями до и после трансплантации почки: современный взгляд на проблему/ Крстич М., Зулькарнаев А.Б.// Альманах клинической медицины. - 2013 - №28.
4. Патогенетическое обоснование коррекции нарушений системного кровообращения в периоперационном периоде у больных с уросепсисом: Автореферат диссертации/ Адилбеков Е.А. – 2006.
Читайте также:

