Выделение вируса из материала
Обновлено: 26.04.2024
Физико-химическое изучение любого вируса, как правило, начинается с разработки метода его выделения и очистки. Обычно исходный материал представляет собой культуральную жидкость, тканевый экстракт и т.д. Во всех этих случаях вирус находится в смеси с большим количеством разнообразных балластных веществ – белков, пигментов, структурных компонентов клеток и т.п. Без удаления этих примесей невозможно проводить биохимические исследования вирусов.
Для очистки большинства вирусов с успехом применяют дифференциальное ультрацентрифугирование. Центрифугирование в градиенте плотности сахарозы делает возможным более тонкое разделение частиц, седимен- тационные свойства которых незначительно отличаются друг от друга. Методом равновесной седиментации в градиентах плотности цезиевых солей можно разделить частицы, обладающие различной плотностью.
В случае, если вирусы приходится выделять из больших объемов биологических жидкостей, прибегают к высаливанию сернокислым аммонием, осаждению органическими растворителями, осаждению в изоэлектрической точке. Наряду с этим используется ионообменная хроматография, гельфильтрация и т.д. Короче говоря, большинство методов, используемых для очистки белков, применимо и к вирусам. Однако существует и ряд специфических методов, применяемых для очистки только вполне определенных вирусов.
Например, миксовирусы можно очистить, используя их способность адсорбироваться на эритроцитах.
Общей схемы, пригодной для очистки любого вируса, в настоящее время не существует. Поскольку свойства вируса, так же как и химические свойства примесей, могут значительно варьировать у различных вируссодержащих материалов, то и выбор приемов очистки будет зависеть от каждого конкретного случая.
Высокоочищенные вирусы можно получить только благодаря применению целого ряда методов.
Идеальным методом выделения вирусов был бы тот, который обеспечил бы сохранение их биологической активности при полном разрушении клеточных компонентов и мембран. Однако такого метода нет. В зависимости от характера исходного материала и природы вируса приемы извлечения вирусов различны.
Выделение вирусов из зараженных клеток
Размалывание. Этот способ широко применяется в тех случаях, когда приходится работать с большим количеством вируссодержащего материала. Наиболее простым и почти универсальным приспособлением для размельчения нативной животной ткани является обычная или электрическая мясорубка.
Обработка ультразвуком. Очень широко используется также дезинтеграция клеток, зараженных вирусами, при помощи ультразвука. Если обрабатывать жидкость ультразвуком, то при определенной интенсивности звука (около 20 кГц/с) в среде возникает явление кавитации. Благодаря очень быстрому чередованию давления и разрежения возникает большое число крошечных воздушных пузырьков, которые, разрываясь, образуют вокруг себя область с интенсивной ударной волной. При этом возникает мгновенный жесткий локальный градиент давления, который и разрушает клетки.
На практике часто обработка ультразвуком сочетается с другими способами дезинтеграции, такими, как осмотический шок в дистиллированной воде (протопласты бактерий и грибов), многократное замораживание и оттаивание (ткани животных), гомогенизация, что значительно уменьшает время обработки ультразвуком. Последнее благоприятно сказывается на выходе инфекционных вирусных частиц, поскольку ультразвуковая обработка приводит к значительному разогреву озвучиваемой суспензий.
Концентрирование и очистка вирусов
Осаждение солями. Вирусы, подобно белкам, осаждаются из водных растворов при определенных концентрациях солей, которые разрушают взаимодействие между молекулами воды и полярными группировками оболочки вируса. Вирус агрегирует и выпадает в осадок. Наиболее часто для этого применяют сульфат аммония.
Несмотря на простоту и дешевизну, метод высаливания сульфатом аммония обладает двумя недостатками. Во-первых, он неспецифичен для вирусов, поскольку вместе с ними высаливаются и белки клетки-хозяина, во-вторых, при этой процедуре происходит деструкция некоторых вирусов.
Осаждение в изоэлектрической точке. Большинство вирусов преципитирует в кислой зоне pH, поскольку их изоэлектрические точки лежат в пределах 3,5-6,5.
Осаждение в изоэлектрической точке – наиболее простая и доступная операция из всех применяемых методов концентрирования и очистки вирусов. Однако при pH ниже 5,0 также выпадают в осадок многие белки клетки-хозяина, что ограничивает возможность применения этого метода. К тому же подобная процедура не всегда желательна при очистке некоторых лабильных вирусов.
Осаждение спиртами. При добавлении к вируссодержащей суспензии охлажденного метанола или этанола вирус преципитирует вследствие уменьшения (как и в рассмотренном выше случае обработки сульфатом аммония) степени гидратации его белковой оболочки. Оптимальная концентрация спирта для каждого вируса подбирается эмпирически. Эта величина колеблется от 15 до 35% . Процедура проводится при максимально возможных низких температурах для избежания денатурации вирусных частиц. Метанол более выгодно использовать, чем этанол, так как, применяя его, можно работать при более низких температурах.
Однако этот метод так же, как и метод высаливания сульфатом аммония, имеет недостатки. Он неспецифичен для вирусов (осаждается значительное количество балластных белков) и не может быть использован для некоторых вирусов животных, которые не устойчивы к спиртам (сложные вирусы, содержащие липопротеидные оболочки).
Обработка ферментами. Благодаря особой структурной организации вирионов, большинство вирусов, несмотря на их нуклеопротеидную природу, устойчиво к действию протеолитических ферментов и нуклеаз, в то время как клеточные нуклеиновые кислоты и белки легко разрушаются этими ферментами. Используя эту различную чувствительность вируса и клеточных примесей к ферментам, можно при помощи ферментов провести частичную очистку вирусов.
Ультрафильтрация. Метод концентрирования и очистки вирусов с помощью мембранных ультрафильтров имеет преимущества перед другими методами, как один из наиболее мягких и щадящих. Мембранные фильтры изготавливают из этерифицированной целлюлозы. Размер пор у фильтров разных типов варьирует от 0,01 до 8 мк. Фильтры устойчивы к температуре (до 125°С), к воздействию разбавленных кислот и щелочей и неполярных растворителей. В идеале, используя последовательную ультрафильтрацию через две мембраны с убывающим размером пор (одна задерживает частицы более крупные, чем вирус, а вторая – только вирус), можно получить в чистом виде любой вирус. Недостатком метода является то, что часто происходит засорение фильтра или адсорбция вируса на фильтре.
Скорость осаждения частиц, приведенная к единице центробежного ускорения (коэффициент седиментации, S), является специфической характеристикой макромолекул и выражается формулой

где х – расстояние от оси вращения, см; t – время, с; ω – угловая скорость, рад/с.
Коэффициент седиментации имеет размерность времени, так как со имеет размерность, обратную времени (радиан – величина безразмерная). Значения коэффициента седиментации для различных макромолекул имеют величины порядка 10 -14 -10 -13 с. Для удобства величина 10 -13 принята за единицу коэффициента седиментации. Эту величину обозначают S (единица Сведберга).
Коэффициент седиментации обычно зависит от концентрации изучаемого вещества. На практике бывает необходимым знать седиментационные характеристики веществ при оседании в сравнимых и идеальных условиях, т.е. условиях, когда взаимодействие между частицами отсутствует. Для этого величина коэффициента седиментации, измеренная в воде при 20°С, рассчитывается для бесконечного разведения раствора и обозначается как S°20,w – константа седиментации.
В современных ультрацентрифугах достигается скорость вращения ротора 60 000 об/мин и выше. Для частиц, находящихся на расстоянии 5-6 см от оси вращения, эта скорость соответствует центробежной силе, превышающей силу тяжести в 250 тыс. раз.
Ядра клетки оседают при 800 g, митохондрии – при 10 000 g9 а большинство вирусов – при 30 000-100 000 g за 0,5-3 ч. При низкоскоростном центрифугировании из вируссодержащей суспензии удаляются обломки клеток и их компоненты. Затем при центрифугировании над осадка при 100 000 g осаждают вирусные частицы, а основная часть белков и других низкомолекулярных соединений остается в надосадочной жидкости. Таким образом, с помощью цикла дифференциального центрифугирования удается разделить вирусную суспензию на ряд фракций, содержащих однородные по скорости седиментации частицы.
Следует отметить, что для большинства вирусов использование только одного метода дифференциального центрифугирования недостаточно, чтобы получить высо- коочищенную вирусную суспензию. Как правило, конечный препарат содержит некоторые нормальные компоненты клеток, имеющие очень близкие с вирусами седиментационные характеристики. К сожалению, многие вирусы, особенно палочкообразные, могут образовывать после центрифугирования осадки, которые затем очень трудно вновь суспензировать.
Ультрацентрифугирование в градиенте плотности. Это понятие относится к скоростному центрифугированию частиц в столбе жидкости с плотностью, увеличивающейся по направлению от оси ротора. Такой градиент плотности может быть образован с помощью, например, сахарозы, глицерина, фиколла или солей тяжелых металлов (цезия, рубидия).
Существуют две наиболее важные разновидности метода:
- метод зонального ультрацентрифугирования;
- метод изопикнического (или равновесного) ультрацентрифугирования.
Метод зонального ультрацентрифугирования для разделения частиц в зависимости от коэффициента седиментации применяется с 1953 г. При этом исследуемую суспензию наслаивают на преформированный градиент. Градиент обычно готовят пологим, и если центрифугирование продолжать длительно, то все частицы могут осесть. Поэтому центрифугирование надо прекращать до момента оседания частиц. Но вместе с тем времени должно быть достаточно для того, чтобы частицы могли мигрировать через градиент. В результате указанной процедуры в центрифужной пробирке формируются зоны, каждая из которых состоит из частиц с близкими седиментационными свойствами.
Для извлечения вируса из центрифужной пробирки содержимое ее фракционируют. Обычно это осуществляется путем прокалывания дна пробирки и последовательного сбора фракций.
Рассмотрим принцип работы самоустанавливающегося изоплотностного градиента (рис. 2.1).

Рис. 2.1. Схематическое изображение разделения двух вирусов с различной плавучей плотностью путем равновесного ультрацентрифугирования в градиенте плотности CsCl
Левую центрифужную пробирку наполняют водным раствором CsCl (р = 1,28 г/мл), в котором суспензируется некоторое количество вируса осповакцины и вируса гриппа. После центрифугирования в течение 20 ч при 41 000 об/мин молекулы CsCl концентрируются на дне пробирки, образуя градиент плотности. При этом вирионы из нижней части градиента всплывают (так как они легче, чем находящийся здесь раствор CsCl), а вирионы из верхней части градиента, наоборот, осаждаются – до зоны, которая имеет ту же плотность, что и частицы вируса. В данном случае это зоны с плотностью 1,28 г/мл (вирус осповакцины) и 1,25 г/мл (вирус гриппа).
Разрешение, достигаемое при ультрацентрифугировании в градиентах плотности CsCl и Cs2SО4, очень велико. Например, при помощи этого метода удается легко разделить частицы бактериофагов, отличающиеся друг от друга по плотности всего на 0,05 г/мл. Этому различию в плотности соответствует относительное различие в содержании ДНК порядка 1%.
Адсорбционная хроматография. Метод основан на различной степени адсорбции вирусов и примесей при фильтровании через слой твердого адсорбента. Решающее значение имеют поверхностные свойства вирусной частицы и адсорбента, а также состав буфера, в котором суспензирован вирус. При элюировании соответствующим буфером вирусные частицы могут быть отделены от примесей. В качестве адсорбентов в вирусологической практике обычно используются фосфат кальция, гидроксилапатит, фосфат алюминия, цеолит.
Хроматография на молекулярных ситах (гельфильтрация). Метод основан на способности пористых материалов разделять смесь веществ по размеру и молекулярной массе компонентов. Молекулярные сита не обладают сорбционным сродством к фракционируемым веществам. Обычно в качестве таких пористых материалов применяют гранулированные гели полисахаридов (сефадексы, агароза), полиакриламид (биогели) и пористое порошковое стекло.
Схематически процесс гельфильтрации можно представить следующим образом (рис. 2.2). Молекулы более крупные, чем размер пор в гранулах, не проникают внутрь них и поэтому движутся по колонке с жидкой фазой вне гранул. Мелкие молекулы проникают внутрь гранул и движутся относительно медленнее. Степень проникновения зависит от размера и формы молекул. Вследствие этого элюирование молекул из слоя гранул геля происходит в порядке уменьшения размера молекул. Когда из колонки элюируются все молекулы, она вновь готова к следующему эксперименту. Эта автоматическая регенерация – одно из преимуществ гельфильтрации.

Рис. 2.2. Схема фракционирования вируса и примеси на колонке с молекулярным ситом
Метод гельфильтрации нашел широкое применение в вирусологической практике, так как он наиболее безвреден для лабильных вирусов. Кроме того, он очень удобен при использовании на последней стадии очистки многих вирусов, поскольку при этом можно удалить из препаратов сульфат аммония и другие низкомолекулярные вещества (например, использующиеся для формирования градиентов плотности).
Ионообменная хроматография. Ионообменниками называют такие соединения, которые содержат фиксированные заряженные функциональные группы и подвижные противоионы. Последние могут обратимо обмениваться с другими ионами того же заряда, не изменяя физических свойств нерастворимой матрицы. Ионообменниками могут быть органические и неорганические соединения – алюмосиликаты, синтетические смолы, полисахариды, целлюлоза и т.д.
Тип ионообменника определяется активностью групп в матрице. Введение фенольных, карбоксильных или сульфогрупп придает матрице катионообменные свойства, а введение алифатических или ароматических аминогрупп – анионообменные свойства (табл. 2.1).
Разделение компонентов при этом виде хроматографии осуществляется не за счет разницы в их размерах, а за счет различий в их зарядах. Фракционирование вируссодержащих смесей, нанесенных на колонки, осуществляется пропусканием через колонку буферных растворов с возрастающей ионной силой или же растворов с возрастающей (или убывающей) величиной pH.
Применяя ионообменники, удается сравнительно легко и быстро проводить препаративную очистку и концентрирование различных вирусов. В то же время имеются сообщения и о неудачах при использовании метода ионообменной хроматографии для очистки вирусов. Некоторые вирусы при элюции с ионообменников теряют до 90% активности.
Таблица 2.1. Основные типы целлюлозных ионообменников

Критерии чистоты вирусных препаратов
Вирусный препарат можно считать чистым, если в нем не обнаруживаются какие-либо посторонние примеси. Определение степени загрязненности зависит от чувствительности применяемых методов исследования. Следует помнить, что применяя какой-либо один метод, нельзя доказать гомогенность препарата.
Важным критерием чистоты считается кристаллизация. Часто как доказательство чистоты вирусного препарата используется наличие спектра поглощения в ультрафиолете, характерного для нуклеопротеидов.
Важнейшим методом оценки гомогенности вирусной суспензии является наблюдение за скоростью седиментации частиц при ультрацентрифугировании в градиенте плотности сахарозы. Требованием для гомогенного препарата является симметричность соответствующего ему пика на седиментационной диаграмме.
Еще более чувствительным критерием гомогенности служит наличие одного пика при равновесном ультрацентрифугировании в градиенте плотности CsCl или Cs2SC>4.
Применение метода электронной микроскопии для выявления примесей целесообразно, если этот материал имеет достаточный размер и по внешнему виду отличается от вируса.
Примесь клеточных веществ, которые способны диффундировать и обладают антигенными свойствами, можно выявить с помощью очень чувствительных серологических методов, таких, как иммунодиффузия и иммуноэлектрофорез.
Для вирусов с хорошо установленным элементарным составом (например, ВТМ) такие методы, как определение отношения фосфора к азоту, позволяют обнаружить примеси, содержащие азот или фосфор, если они присутствуют в значительном количестве. При определенных обстоятельствах могут быть применены также более сложные химические методы, например анализ концевых групп белков, позволяющих обнаружить всего-навсего одну аминокислоту.
Из вышеизложенного следует, что для вирусных препаратов нет одного вполне удовлетворительного метода определения чистоты. Поэтому в практической работе используют и критически сопоставляют результаты, полученные при помощи как можно большего числа разнообразных методов.
Лабораторные методы при диагностике вирусных инфекций включают:
• выделение и идентификацию возбудителя;
• обнаружение и определение титров противовирусных AT;
• обнаружение Аг вирусов в образцах исследуемого материала;
• микроскопическое исследование препаратов исследуемого материала.
Забор материала для выявления вирусов
При заборе материала для исследований необходимо выполнять следующие условия:
• образцы следует отбирать как можно раньше либо с учётом ритма циркуляции возбудителя;
• материал следует отбирать в объёме, достаточном для всего комплекса исследований;
• образцы следует доставлять в лабораторию незамедлительно (!), при относительно кратковременной транспортировке (не более 5 сут) образцы сохраняют на льду, при более длительной — при температуре -50 С.
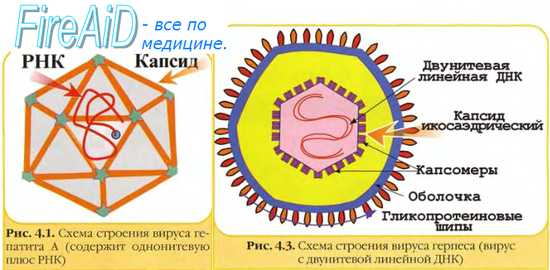
Выделение и культивирование вирусов
Выделение и идентификация возбудителя — золотой стандарт в диагностике вирусных инфекций.
Культуры клеток для выявления вирусов
Вирусы размножаются только в живых клетках, и выделение возбудителя в заражённой культуре клеток — один из основных методов диагностики вирусных инфекций. Поскольку большинство патогенных вирусов отличает тканевая и типовая специфичность, то почти к каждому вирусу можно подобрать соответствующие клеточные или тканевые чультуры, а также создать стандартные условия культивирования (наличие клеток одного типа). Размножение вируса обеспечивают чувствительные (пермиссивные) клетки. Поэтому при выделении неизвестного возбудителя проводят одномоментное заражение 3~4 культур клеток, предполагая, что одна из них может оказаться пермиссивной. Культуры клеток получают диспергированием соответствующих органов и тканей, но чаще используют эмбриональные ткани (человека и животных) либо трансформированные опухолевые клетки. При помещении на соответствующую плоскую поверхность клеточные культуры обычно растут в виде монослоя. Первично-трипсинизированные культуры. Суспензии клеток получают гомогенизированием соответствующих тканей, предварительно обработанных трипсином. Культуры часто представлены клетками смешанного типа и не подлежат повторному культивированию. Жизнеспособность таких культур составляет 2-3 нед.
Полуперевиваемые линии клеток представлены диплоидными клетками человека и животных. Культуры ограниченно пригодны к повторному диспергированию и росту (как правило, не более 20-30 пересевов), сохраняя при этом жизнеспособность и не подвергаясь спонтанной трансформации.
Перевиваемые линии клеток (гетероплоидные культуры) представлены клетками, подвергнутыми длительному культивированию и спонтанным трансформациям. Культуры способны к многократному диспергированию и перевиванию. Работа с ними менее трудоёмка по сравнению с приготовлениями первичных культур; перевиваемые клетки относительно одинаковы по своей морфологии и стабильны по свойствам.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Техника забора материала для бакпосева с глаз. Методы исследования глазных мазков
При заборе клинического материала от больного и при последующей работе с ним необходимо помнить о потенциальной опасности любых биологических материалов, полученных от инфекционных больных. Использование защитной спецодежды, как минимум, перчаток и халата, а в случае возможности возникновения аэрозолей — защитных очков или масок, является обязательным. Направляемый на исследование заразный материал должен быть соответствующим образом упакован для предотвращения заражения окружающих и контаминации самого материала посторонними биологическими агентами. На каждую пробу, направляемую в лабораторию, заполняется соответствующее направление.
При определении перечня необходимых лабораторных исследований учитывают необходимость этиологической расшифровки диагноза и установления ведущих патогенетических звеньев данного заболевания, а также предполагаемый дифференциальный диагноз.
Забор клинического материала следует производить до назначения антимикробных (антибактериальных или противовирусных) препаратов. Основное внимание необходимо обратить на получение материала из основного очага локализации предполагаемого возбудителя. Кратность проведения исследования зависит от метода исследования, сроков забора материала, особенностей заболевания и т. д. Количество клинического материала определяется выбором методов исследования и разумной достаточностью, поскольку недостаточное количество материала может определять ложноотрицательный результат.
При взятии материала приготавливают мазки для первичной бактериоскопии и производят высевы на сывороточный и тиогликолевый бульоны (2 пробирки). Мазки высушивают, стекло маркируют. Нативный материал (тампон с материалом в пробирке) и посевы доставляют в лабораторию для дальнейшего бактериологического исследования.
Методы исследования глазных мазков
Проведение традиционных бактериологических исследований при инфекционных поражениях глаз не отличается от аналогичных исследований при бактериальных инфекциях другой локализации.
Для диагностики вирусных инфекций наряду с традиционными иммунологическими исследованиями с целью обнаружения специфических антител чаще всего используют метод флюоресцирующих антител. Материалом для исследования являются соскобы конъюнктивы или эпителия роговицы.
Вирусный антиген обнаруживается в соскобах эпителия конъюнктивы и роговицы больного глаза при поверхностных и глубоких кератитах, при иридоциклитах. Специфическое свечение в ряде случаев может выявляться даже у реконвалесцентов, перенесших вирусную инфекцию с поражением глаз.
В повседневной практике применяют как прямой, так и непрямой метод флюоресцирующих антител. Непрямой метод не уступает прямому в частоте выявления вирусного антигена, однако при нем фоновое свечение и неспецифическая флюоресценция выражены сильнее, что затрудняет оценку результатов. Использование специфических антител позволяет проводить серотипирование возбудителя без выделения самого вируса.
Еще одним методом диагностики вирусных поражений органа зрения является традиционная реакция непрямой гемагглю-тинации. В качестве метода экспресс-диагностики она может быть использована, например, для диагностики герпетических поражений глаза, особенно на поздних этапах заболевания. Для анализа получают небольшое количество слезной жидкости, в которой определяют наличие антигена вируса герпеса. Для РНГА используют герпетический гамма-глобулиновый эритроцитарный диагностикум.
Метод выделения вируса может быть использован только при наличии специальной вирусологической лаборатории. Он дорогостоящ, занимает достаточно длительное время и требует высокой квалификации специалистов. В качестве исходного материала могут использоваться смывы с конъюнктивы, соскобы с конъюнктивы и роговицы, мазки-отпечатки и т. д.
Цитологический метод исследования глазных мазков. Исследование фиксированных и окрашенных соскобов конъюнктивы и роговицы может служить вспомогательным методом в диагностике вирусных поражений глаз. Одновременно отмечается усиление амитотического деления эпителиальных клеток и появление многоядерных клеток. При этом регулярно отмечаются базофилия их цитоплазмы, наличие внеклеточного детрита. Внутриядерные включения были описаны в роговичных соскобах кроликов, зараженных вирусом простого герпеса.
Определенные трудности связаны с диагностикой паразитарных заболеваний глаза. Так, при онхоцеркозе используют обнаружение микрофилярий в срезах кожи, в тканях и средах глаза, в моче и крови. Выявление паразитов в глазу позволяет установить диагноз и оценить тяжесть поражения органа зрения и при других паразитарных заболеваниях. Для диагностики ряда паразитарных инвазий применяют внутрикожные пробы (лоаоз и др.).
Серологические методы исследования глазных мазков позволяют выявить в сыворотке крови специфические антитела. Определенное диагностическое и прогностическое значение имеет изучение иммуноглобулинов в слезной жидкости.
В большинстве случаев диагностика инфекционных поражений органа зрения проводится в соответствии с рекомендациями, приведенными в указаниях и рекомендациях по диагностике той или иной конкретной инфекции с обязательными дополнительными исследованиями биологических материалов, полученных при проведении осмотра пораженного глаза.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лабораторные исследованияпри проведении идентификации вирусов и диагностике вирусных инфекций включают следующие этапы: выделение, культивирование, индикация (выявление) и идентификация вирусов.
2.3.1 Культивирование вирусов
Вирусы не растут на искусственных питательных средах, а размножаются только внутриклеточно. Крупным достижением было предложение Р. Гудпасчура в 1932 г. использовать для культивирования вирусов куриные эмбрионы. Окончательное решение проблемы культивирования вирусов оказалось возможным лишь после того, как были разработаны основные способы культивирования клеток вне организма.
Использование куриных эмбрионов. Куриные эмбрионы – практически идеальные модели для культивирования некоторых вирусов (например, гриппа и кори). Замкнутая полость эмбриона препятствует проникновению микроорганизмов извне, а также развитию спонтанных вирусных инфекций. Эмбрионы применяют для первичного выделения вирусов из патологического материала; для пассирования и сохранения их, а также для получения необходимых количеств вируса. Некоторые возбудители (например, герпесвирусы) вызывают характерные изменения (по ним можно распознавать заболевание).
Для заражения обычно используют куриные эмбрионы 7–12-дневного возраста. Перед заражением определяют жизнеспособность эмбриона путем овоскопирования (просматривают в проходящем свете). Живые эмбрионы при овоскопировании проявляют двигательную активность, хорошо виден сосудистый рисунок. Простым карандашом очерчивают границы воздушной камеры.
Куриные эмбрионы заражают вируссодержащим материалом в асептических условиях стерильными инструментами, предварительно обработав скорлупу над воздушным пространством йодом и спиртом. Заражение проводят на хорион-аллантоисную оболочку, в амниотическую или аллантоисную полость, либо в желточный мешок (рисунок 29). Выбор метода заражения зависит от биологических свойств вируса.
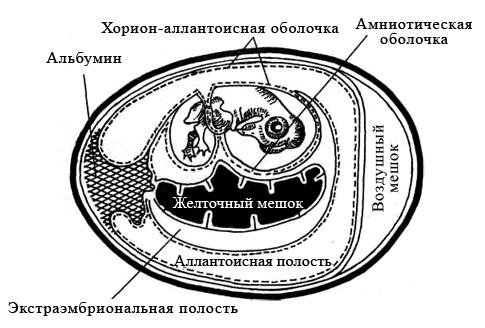
Рисунок 29 – Схематическое изображение развивающегося куриного эмбриона
Культура клеток. Вначале был использован метод переживающих тканей. Он заключался в том, что в колбу, содержащую питательную среду, вносили кусочек ткани. Клетки некоторых тканей в таких условиях могут переживать (но не размножаться) до 30 дней, а в них могут размножаться вирусы. Однако этот способ давал очень небольшой выход вирусов. Необходимо было разработать условия, при которых клетки ткани могли бы свободно размножаться.
Для получения культур клеток необходимо было решить четыре главных задачи:
– получить в необходимом количестве свободные (т. е. изолированные друг от друга) клетки;
– создать такие питательные среды и условия, в которых клетки могли бы активно размножаться;
– обеспечить условия, при которых в культурах клеток не могли бы размножаться бактерии;
– определить методы, с помощью которых можно было бы распознавать рост вируса в культуре клеток и идентифицировать его.
Для выделения изолированных (разобщенных), но жизнеспособных клеток из разрушенных тканей, стали использовать обработку их слабым раствором трипсина, разрушающего межклеточные мостики. Для культивирования клеток были предложены различные среды, содержащие все необходимые для размножения клеток питательные вещества (аминокислоты, основания, витамины и другие), минеральные соли, имеющие оптимальную рН и т. д. К питательным средам добавляли индикатор, по изменению цвета которого можно было судить о метаболизме клеток и их размножении. Было установлено, что в качестве основы, на которой клетки размножаются и образуют монослой, может быть использовано хорошо обработанное стекло пробирок и колб. Для подавления возможного роста бактерий вируссодержащий материал перед посевом его в культуры клеток стали обрабатывать антибиотиками.
В 1949 г. Дж. Эндерс, Т. Веллер и Ф. Роббинс показали, что вирус полиомиелита хорошо размножается в первично-трипсинизированных культурах клеток, полученных из почек обезьян. Основной недостаток первично-трипсинизированных клеток заключается в том, что после нескольких пересевов они перестают размножаться. Поэтому предпочтением стали пользоваться культуры таких клеток, которые способны размножаться in vitro бесконечно долго. Такие перевиваемые культуры клеток (клеточные линии характеризуются бессмертием и гетероплоидным кариотипом) получают из опухолевых тканей (HeLa получена из карциномы шейки матки, НЕр-2 – из карциномы гортани; Детройт-6 – из метастаза рака легкого в костный мозг; RН – из опухоли почки человека) или из мутантных клеток с полиплоидным набором хромосом. Однако опухолевые клетки нельзя применять для получения вакцин. Для этих целей используют только культуры таких клеток, которые не содержат никаких контаминантных вирусов и не обладают злокачественностью. Лучше всего этим требованиям отвечают культуры диплоидных клеток.

Полуперевиваемые (диплоидные) культуры клеток – клетки одного генотипа, способные in vitro выдерживать 50–100 пассажей, сохраняя при этом свой исходный диплоидный набор хромосом. Диплоидные линии фибробластов эмбриона человека используются как для диагностики вирусных инфекций, так и при производстве вирусных вакцин. Как оказалось, вирусы могут размножаться не только в культурах клеток, образующих монослой на стекле пробирок, но и в суспензиях живых клеток.
Для обеспечения жизнедеятельности культивируемых клеток необходимы питательные среды. По назначению они делятся на ростовые и поддерживающие. В ростовых питательных средах должно содержаться больше питательных веществ, обеспечивающих активное размножение клеток и формирование монослоя. Поддерживающие среды обеспечивают переживание клеток в уже сформированном монослое в период размножения в них вирусов.
2.3.2 Выделение вирусов
Выделение вирусов в культурах клеток. При выделении вирусов из различных инфекционных материалов (кровь, моча, слизистые отделяемые, смывы из органов) применяют культуры клеток, обладающих наибольшей чувствительностью к предполагаемому вирусу. Для заражения используют культуры в пробирках с хорошо развитым монослоем клеток. Перед заражением клеток питательную среду удаляют и в каждую пробирку вносят по 0,1–0,2 мл взвеси исследуемого материала, предварительно обработанного антибиотиками для уничтожения бактерий и грибов. После 30-60 мин контакта вируса с монослоем клеток удаляют избыток материала, в культуру вносят поддерживающую среду и пробы оставляют в термостате до выявления признаков размножения вируса.
Выделение вирусов на лабораторных животных. При невозможности выделить и идентифицировать вирус стандартными методами in vitro инфекционный материал вводят чувствительным к возбудителю животным, и после развития типичного инфекционного процесса проводят повторное заражение чувствительных клеточных культур. Наиболее часто используют мышей, кроликов и обезьян; для выделения некоторых вирусов (например, вирусов Коксаки) заражают мышат-сосунков. Вследствие дороговизны и сложности содержания лабораторных животных, практически повсеместно их вытеснили клеточные культуры. Тем не менее животные модели активно используют для изучения особенностей патогенеза и формирования иммунных реакций при вирусных инфекциях.
Таким образом, для выделения чистых культур вирусов в лабораторных условиях в настоящее время используются следующие живые объекты (биологические модели): 1) культура клеток (тканей, органов); 2) куриные эмбрионы; 3) лабораторные животные.
2.3.3 Индикация вирусов
Индикация вирусов в культурах клеток. Индикатором наличия вируса в зараженных культурах клеток может служить:
1) развитие специфической дегенерации клеток – цитопатическое действие вируса (ЦПД), имеющее три основных типа: крупно- или мелкоклеточная дегенерация; образование многоядерных гигантских клеток (симпластов); развитие очагов клеточной пролиферации, состоящих из нескольких слоев клеток (гроздевидная дегенерация клеток).
Различают два механизма гибели клеток, вызываемой вирусами, – некроз и апоптоз. Некроз происходит из-за необратимых нарушений целостности клеточных мембран, апоптоз – вследствие фрагментации ядерной ДНК под действием клеточной эндонуклеазы.
Цитопатические эффектыоценивают при микроскопии клеточных культур. По степени поражения клеток выделяют вирусы с высокой или умеренной цитопатогенностью:
2) обнаружение внутриклеточных включений, располагающихся в цитоплазме и/или в ядрах пораженных клеток;
3) положительная реакция гемагглютинации (РГА) или гемадсорбции (РГАдс). Некоторые вирусы, в частности, вирус гриппа, обладают особыми рецепторами (гемагглютининами), с помощью которых они адсорбируются на эритроцитах и вызывают их склеивание (гемагглютинацию). Такие вирусы легко обнаруживаются с помощью реакции гемагглютинации или гемадсорбции (эритроциты адсорбируются на инфицированных вирусами клетках культуры тканей);
4) феномен бляшкообразования. Широкое распространение получил предложенный в 1952 г. Р. Дюльбекко метод бляшек (негативных колоний), позволяющий производить количественное определение вирусов. Для выделения вирусов монослой клеток после удаления питательной среды заражают вируссодержащим материалом и покрывают слоем агара, содержащего индикатор нейтральный красный. Чашки (флаконы) инкубируют при 37 °С. Через 48–96 ч выявляются пятна – бляшки. Они имеют диаметр 1–3 мм и выглядят неокрашенными на розовом фоне. Пятна возникают за счет цитопатического действия вируса;
5) цветная реакция Солка. О росте вирусов в клетках можно судить с помощью индикатора, добавляемого к питательной среде. Если клетки активно осуществляют метаболизм, рН среды сдвигается в кислую сторону, и среда окрашивается в желтый цвет. В случае размножения вируса клетки погибают, рН среды мало меняется, и она сохраняет первоначальный (малиновый) цвет или (при нейтральной рН) приобретает оранжевый;
6) реакция интерференции (используется при отсутствии ЦПД, гемагглютинации и гемадсорбции): исследуемая культура повторно заражается вирусом, вызывающим ЦПД. В положительном случае ЦПД будет отсутствовать (реакция интерференции положительна). Если в исследуемом материале вируса не было, наблюдается ЦПД.
Кроме того, для обнаружения вируса в культурах клеток могут быть использованы различные серологические реакции.
Индикация вирусов на лабораторных животных. Индикация вируса основана на обнаружении у животных признаков инфекционного заболевания, регистрации их гибели, изучении характера патоморфологических и патогистологических изменений в тканях и органах, выявлении положительной реакции гемагглютинации.
2.3.4 Методы идентификации вирусов
Определение типа вируса (его идентификация) основано на нейтрализации биологической активности вируса с помощью типоспецифических сывороток. Конечный результат ее может быть установлен на основании следующих признаков:
1) нейтрализация цитопатического действия: в культуральную среду, содержащую изучаемый вирус, вносят коммерческую сыворотку (например, к вирусу краснухи при подозрении на неё), инкубируют и заражают вторую культуру; через 1–2 дня в неё вносят известный цитопатогенный вирус. При наличии цитопатогенного эффекта делают вывод о том, что первая культура была заражена вирусом, соответствовавшим антителам примененной сыворотки;
2) нейтрализация реакции гемадсорбции;
3) изменение проявления цветной пробы;
4) задержка (торможение) реакции гемагглютинации: смешивают культуральную среду, содержащую возбудитель, с известной коммерческой антисывороткой и вносят в культуру клеток. После инкубации определяют способность культуры к гемагглютинации и при её отсутствии делают заключение о несоответствии вируса антисыворотке.
5) нейтрализация в опытах на животных.
Таким образом РН (реакция нейтрализации) основана на подавлении соответствующей реакции, феномена, развития инфекционного процесса после внесения в культуру или введения в организм животного смеси вируса со специфичными AT, содержащимися в диагностической сыворотке.
Вопросы для самоконтроля
1 Назовите основные принципы классификации вирусов.
2 Приведите русские и латинские названия основных семейств вирусов человека и животных.
3 Назовите типовых представителей основных семейств вирусов и заболевания, вызываемые ими.
4 Каковы особенности морфологии и ультраструктуры вирусов человека и животных (основных семейств)?
5 Назовите РНК-геномные и ДНК-геномные фитовирусы.
6 Какие этапы включают в себя лабораторные исследования при идентификации вирусов и диагностике вирусных инфекций?
7 Какие биологические модели используются для выделения и культивирования вирусов человека и животных?
8 Как происходит заражение куриных эмбрионов в лабораторных условиях?
9 Какие методы получения культуры клеток вы знаете?
10 Как проводят идентификацию вирусов в курином эмбрионе и на лабораторных животных?
11 Какие существуют методы индикации вирусов на культуре клеток?
12 В чем заключается назначение и сущность реакций нейтрализации вирусов?
Лабораторные методы при диагностике вирусных инфекций включают:
• выделение и идентификацию возбудителя;
• обнаружение и определение титров противовирусных AT;
• обнаружение Аг вирусов в образцах исследуемого материала;
• микроскопическое исследование препаратов исследуемого материала.
Забор материала для выявления вирусов
При заборе материала для исследований необходимо выполнять следующие условия:
• образцы следует отбирать как можно раньше либо с учётом ритма циркуляции возбудителя;
• материал следует отбирать в объёме, достаточном для всего комплекса исследований;
• образцы следует доставлять в лабораторию незамедлительно (!), при относительно кратковременной транспортировке (не более 5 сут) образцы сохраняют на льду, при более длительной — при температуре -50 С.

Выделение и культивирование вирусов
Выделение и идентификация возбудителя — золотой стандарт в диагностике вирусных инфекций.
Культуры клеток для выявления вирусов
Вирусы размножаются только в живых клетках, и выделение возбудителя в заражённой культуре клеток — один из основных методов диагностики вирусных инфекций. Поскольку большинство патогенных вирусов отличает тканевая и типовая специфичность, то почти к каждому вирусу можно подобрать соответствующие клеточные или тканевые чультуры, а также создать стандартные условия культивирования (наличие клеток одного типа). Размножение вируса обеспечивают чувствительные (пермиссивные) клетки. Поэтому при выделении неизвестного возбудителя проводят одномоментное заражение 3~4 культур клеток, предполагая, что одна из них может оказаться пермиссивной. Культуры клеток получают диспергированием соответствующих органов и тканей, но чаще используют эмбриональные ткани (человека и животных) либо трансформированные опухолевые клетки. При помещении на соответствующую плоскую поверхность клеточные культуры обычно растут в виде монослоя. Первично-трипсинизированные культуры. Суспензии клеток получают гомогенизированием соответствующих тканей, предварительно обработанных трипсином. Культуры часто представлены клетками смешанного типа и не подлежат повторному культивированию. Жизнеспособность таких культур составляет 2-3 нед.
Полуперевиваемые линии клеток представлены диплоидными клетками человека и животных. Культуры ограниченно пригодны к повторному диспергированию и росту (как правило, не более 20-30 пересевов), сохраняя при этом жизнеспособность и не подвергаясь спонтанной трансформации.
Перевиваемые линии клеток (гетероплоидные культуры) представлены клетками, подвергнутыми длительному культивированию и спонтанным трансформациям. Культуры способны к многократному диспергированию и перевиванию. Работа с ними менее трудоёмка по сравнению с приготовлениями первичных культур; перевиваемые клетки относительно одинаковы по своей морфологии и стабильны по свойствам.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

