Что такое геморрагическая инфекция у новорожденных
Обновлено: 25.04.2024
Геморрагическая болезнь новорожденных (ГрБН) (код МКБ – Р53) или витамин-К-дефицитный геморрагический синдром – приобретенное или врожденное заболевание, проявляющееся повышенной кровоточивостью у новорожденных и детей первых месяцев жизни вследствие недостаточности факторов свертывания крови (II, VII, IX, X), активность которых зависит от витамина К [5, 7, 10, 26, 29, 41, 32].
Классификация
1. Ранняя форма - симптомы появляются в течение 24 часов после рождения. Ранняя форма часто связана с приемом матерью препаратов, нарушающих метаболизм витамина К. Эта форма болезни не может быть предупреждена путем назначения витамина К после родов. Характерны кровавая рвота, легочное кровотечение, мелена, кровоизлияние в органы брюшной полости, надпочечники [5, 10, 27, 35, 43, 44, 48].
2. Классическая форма проявляется кровоточивостью на 2-7 сутки жизни. Наиболее часто развивается у новорожденных при недостаточном поступлении молока и отсутствии профилактического применения витамина К сразу после рождения. Характерны желудочно-кишечные кровотечения, кожные геморрагии, кровотечения из пупочной ранки, кровотечения из носа и нарушение свертывания крови в местах инъекций. Внутричерепные кровоизлияния менее типичны для классической формы ГрБН [5, 10, 27, 35, 43, 44, 48].
3. Отсроченная или поздняя форма характеризуется появлением симптомов в период с 8 дня до 6 месяцев жизни [19, 41], хотя, как правило, манифестация приходится на возраст 2-12 недель [5, 27, 41, 46]. Заболевание встречается у детей, находящихся на исключительном грудном вскармливании и не получивших профилактику витамином К после рождения. В половине случаев поздняя форма ГрБН развивается на фоне заболеваний и состояний ребенка, способствующих нарушению синтеза и всасывания витамина К (холестаз, синдром мальабсорбции). При этой форме часто регистрируются внутричерепные кровоизлияния (50 – 75 %), кожные геморрагии, кровотечения из мест инъекций, пупочной ранки и желудочно-кишечного тракта (ЖКТ) и т.д. [11, 35, 42, 43, 46].
Без профилактики частота ранней и классической ГрБН составляет 0,25 – 1,7%, поздней – 4,4 – 7,2 на 100 000 новорожденных [43]. В странах, где витамин К назначается парентерально непосредственно после рождения, частота ГрБН равна 0,01% и менее. Частота заболевания не зависит от пола и расы ребенка.
Этиология и патогенез
Биологическая роль витамина К состоит в активировании гамма-карбоксилирования остатков глутаминовой кислоты в протромбине (фактор II), проконвертине (фактор VII), антигемофильном глобулине В (фактор IX) и факторе Стюарта-Прауэра (фактор Х), а также в антипротеазах С и S плазмы, играющих важную роль в антисвертывающей системе [31, 51], а также остеокальцине и других белках. При недостатке витамина К в печени происходит синтез неактивных факторов II, VII, IX и X, неспособных связывать ионы кальция и полноценно участвовать в свертывании крови [5].
В природе встречается несколько типов витамина К. Витамин К1 или филохинон широко представлен в продуктах питания (зеленые овощи, растительные масла, молочные продукты). Витамин К2 или менахинон синтезируется кишечной микрофлорой и всасывается в крайне малых количествах. Одним из путей преобразования витаминов К1 и К2 в депонированную форму является их метаболизирирование в кишечнике в менадион (витамин К3). Из циркулирующего в крови менадиона затем во внепеченочных тканях синтезируется депонированная форма -менахинон-4.
Менадион – синтетический водорастворимый аналог витамина К, иногда называемый витамином К3, в настоящее время не используется для профилактики ГрБН в развитых зарубежных странах [45]. Менадион действует не сам, а пройдя метаболический путь превращения в печени в филлохинон (К1) и менахинон (К2), поэтому эффект его после поступления в организм развивается медленно [3].
Перенос витамина К через плаценту ограничен, поэтому его запасы в печени новорожденных, как и концентрация в крови пуповины очень низкие [43, 52]. Кроме того, витамин К относится к группе жирорастворимых, поэтому всасывание его в кишечнике возможно только при наличии солей желчных кислот. Возможности депонирования витамина К в организме очень низкие, а период полураспада витамин К-зависимых факторов свертывания очень короткий. Вследствие всего вышеперечисленного дефицит витамина К при недостаточном его поступлении развивается очень быстро.
У здоровых новорожденных содержание в плазме крови витамин К-зависимых факторов свертывания составляет 30-60% от уровня взрослых. Их концентрация увеличивается постепенно и достигает уровня взрослых к 6 неделе жизни. Практически у всех здоровых доношенных новорожденных в первые пять дней жизни отмечается сопряженное снижение уровня прокоагулянтов, физиологических антикоагулянтов и плазминогена [4].
Для новорожденного единственным источником витамина К является его экзогенное поступление: с женским молоком, искусственной питательной смесью или в виде лекарственного препарата. Количество витамина К, получаемого ребенком, зависит от характера вскармливания. Уровень витамина К1 в грудном молоке составляет от 1 до 10 мкг/л [21, 26], в среднем 2-2,5 мкг/л [22, 33], что существенно ниже чем в искусственных молочных смесях (около 50 мкг/л - в смесях для доношенных детей; 60-100 мкг/л - в смесях для недоношенных).
Таким образом, новорожденные дети в силу своих физиологических характеристик свертывающей системы и метаболизма витамина К, имеют предрасположенность к развитию витамин-К-дефицитного геморрагического синдрома. При этом значимыми факторами, способствующими развитию ГрБН, являются исключительное грудное вскармливание и отсутствие профилактического назначения витамина К сразу после рождения [25, 27].
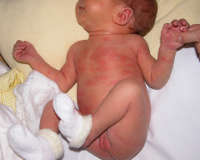
Эритема новорожденных – это транзиторное покраснение кожи, связанное с адаптацией ребенка к внеутробной жизни и сопровождающееся полиморфными высыпаниями. Основным симптомом является розово-красный цвет кожных покровов, отмечающийся в первые часы или на 2-3 сутки жизни ребенка. На фоне покраснения кожи в ряде случаев обнаруживается мелкая серо-желтая сыпь. Общее состояние, как правило, не страдает. Диагностика эритемы новорожденных основана на характерных симптомах, появляющихся в определенном возрасте (первые дни жизни), при этом клинические и лабораторные признаки воспаления и инфекций отсутствуют. Лечение обычно не требуется, по показаниям назначаются десенсибилизирующие препараты.
МКБ-10
Общие сведения
Эритема новорожденных относится к типичным адаптационным реакциям ребенка в первые дни жизни, поэтому фактически считается нормой в педиатрии. Встречается более чем у половины детей, чаще у малышей, находящихся на грудном вскармливании. Развитие эритемы в некоторой степени зависит от соматического состояния матери, поэтому можно говорить об увеличении частоты встречаемости в последние 10-20 лет в связи с ростом заболеваемости матерей сахарным диабетом, ожирением и другими социально значимыми нозологиями. Врачам следует сохранять настороженность в отношении эритемы новорожденных, особенно ее токсической формы, поскольку не исключено влияние данного состояния на дальнейшее формирование аллергического статуса ребенка.

Причины
Ведущая причина возникновения эритемы новорожденных – послеродовая адаптация организма к внешней среде, то есть к жизни вне материнской утробы. Первичные проявления во многом обусловлены разницей температур матки и окружающего воздуха, вследствие чего периферические сосуды ребенка расширяются для большего притока крови и, соответственно, согревания. Поэтому кожные покровы выглядят покрасневшими. Дальнейшее развитие эритемы новорожденных имеет аллергический генез. По большей части речь идет об алиментарном пути проникновения аллергенов, но также имеет место и контактный механизм. Определенную роль всегда играют патологии беременности – гипоксия плода, фетоплацентарная недостаточность и др.
Патогенез
После рождения ребенок впервые получает пищу через желудочно-кишечный тракт, незнакомый до настоящего момента с грудным молоком. Важно понимать, что само по себе грудное вскармливание не вызывает аллергию, но ее проявления практически неизбежны из-за огромного количества компонентов пищи, абсолютно новых для малыша. Воздушная среда тоже может оказывать раздражающее действие на кожу, но механизмы адаптации выстраиваются уже ко 2-3 дню жизни, поэтому проявления эритемы новорожденных постепенно нивелируются.
Классификация
Эритема новорожденных бывает физиологической и токсической. Классификация условна, поскольку токсическая эритема новорожденных многими специалистами не связывается с процессами адаптации ребенка в первые дни жизни, а считается отдельной нозологией. Кроме того, обе формы данного состояния требуют разной врачебной тактики.
- Физиологическая эритема. Клиническая картина обусловлена в большей степени температурным фактором.
- Токсическая эритема. Кожные проявления связаны с аллергической сенсибилизацией. Эритема может быть ограниченной, распространенной и генерализованной в зависимости от степени выраженности кожных проявлений и ухудшения общего состояния.
Симптомы эритемы новорожденных
Физиологическая эритема проявляется в первые часы жизни ребенка общим покраснением кожных покровов, больше в области ладоней и стоп. Как правило, в течение первых суток симптомы исчезают. Токсическая эритема новорожденных дебютирует обычно на 2-3 сутки (по мере формирования аллергического ответа). В отличие от физиологической эритемы, характерным признаком является сыпь. Высыпания представлены мелкими серо-желтыми бугорками с ярко-красным венчиком вокруг них. Образования всегда локализуются на ограниченном участке кожи и могут быть как единичными, так и множественными.
Общее состояние ребенка не страдает, температура может быть незначительно повышена. Генерализованная токсическая эритема новорожденных встречается относительно редко, в подобных случаях имеет место не только обильная сыпь по всему телу, но и ухудшение общего состояния – слабость, повышение температуры.
Диагностика
При постановке диагноза врач-педиатр учитывает возраст ребенка и частое сочетание с другими транзиторными состояниями: маститом новорожденных, гормональным кризом, олигурией, мочекислым инфарктом и т. д. Дифференциальная диагностика кожных элементов обычно не вызывает затруднений, поскольку характерные проявления вирусных заболеваний выглядят иначе и всегда сопровождаются другими общими симптомами. Физиологическая и токсическая эритема новорожденных различаются по времени появления и типу изменений кожи. При выраженной сенсибилизации проводится анализ крови малыша и матери на различные аллергены. Полностью исключить инфекции позволяет результат общего анализа крови ребенка.
Лечение эритемы новорожденных
В большинстве случаев состояние не требует врачебного вмешательства. Симптомы купируются в течение одного или нескольких дней. Ускорению восстановления нормального цвета кожных покровов способствуют воздушные ванны и соблюдение гипоаллергенной диеты кормящей матерью. Токсическая эритема новорожденных может потребовать назначения десенсибилизирующих препаратов (обычно в каплях) при обильных высыпаниях и беспокойстве ребенка, обычно связанном с зудом.
С целью снижения местного раздражения рекомендуется свободное пеленание. По показаниям проводится коррекция дисбиоза, поскольку большинство аллергенов попадают в организм ребенка именно алиментарным путем. Прогноз состояния благоприятный.
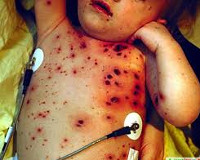
Геморрагическая болезнь новорожденных – патология, возникающая при дефиците факторов свертывания крови на фоне эндогенной или экзогенной недостаточности витамина К. Проявляется рвотой с примесью крови, кровавым дегтеобразным стулом, кожными геморрагиями, гематомами и внутренними кровоизлияниями. Редко сопровождается геморрагическим шоком, развитием желтухи и образованием эрозий слизистых оболочек ЖКТ. Диагностика базируется на определении количества тромбоцитов, исследовании коагулограммы, проведении УЗД и нейросонографии. Лечение заключается в заместительной терапии синтетическими аналогами витамина К, остановке внутренних кровотечений и коррекции гиповолемии.
Общие сведения
Геморрагическая болезнь новорожденных – геморрагический диатез, характеризующийся дефицитом II (протромбина), VII (проконвертина), IX (антигемофильного глобулина В) и X (фактора Стюарта-Пауэра) факторов свертывания при недостаточности витамина К в организме ребенка. Впервые патология описана в 1894 году Ч. Товнсендом, однако введенный термин изначально использовался для всех врожденных геморрагических состояний. Распространенность – 0,3-0,5% среди всех новорожденных. После введения обязательный профилактики аналогами витамина К при рождении заболеваемость снизилась до 0,02%. Порядка 3-6% случаев геморрагической болезни новорожденных являются следствием приема матерью фармакотерапевтических средств в период беременности.

Причины геморрагической болезни новорожденных
Причина геморрагической болезни новорожденных – недостаточность синтеза II, VII, IX и X факторов свертывания крови. Образование этих факторов проходит в тканях печени путем γ-карбоксилирования глутаминовой кислоты под воздействием витамина К. При эндогенной или экзогенной недостаточности витамина К вырабатываются функционально незрелые факторы, имеющие более сильный отрицательный заряд на своей поверхности. Подобные факторы не могут связываться с Ca ++ , а затем и с фосфатидилхолином. В результате не образуется фибрин, и не формируется красный тромб.
Первичный, или экзогенный, дефицит витамина К обусловлен недостаточностью его поступления в организм при вынашивании ребенка. Провоцирующими факторами геморрагической болезни новорожденных выступают нарушения со стороны матери: употребление антиконвульсивных средств (карбамазепина, конвулекса), антикоагулянтов и антибактериальных препаратов широкого спектра действия (цефалоспоринов, тетрациклинов, сульфаниламидов), преждевременные роды, заболевания печени, энтеропатии, эклампсия, дисбактериоз, нерациональное питание.
Вторичный, или эндогенный, дефицит вызван недостаточным синтезом полипептидных предшественников плазменных факторов свертывания (ПППФ) в тканях печени ребенка. Данная форма заболевания, как правило, провоцируется нарушениями со стороны новорожденного: заболеваниями печени (гепатитом), пороками развития (аномалиями строения желчевыводящих путей), функциональной незрелостью паренхимы печени, синдромом мальабсорбции, антибиотикотерапией, отсутствием профилактического введения викасола (аналога витамина К) после родов, искусственным или продолжительным парентеральным вскармливанием. Первые несколько дней жизни ребенка его ЖКТ находится в стерильном состоянии – микрофлора, способствующая усвоению витамина К, еще не успевает сформироваться, что также усугубляет вторичный эндогенный дефицит данного соединения.
Классификация геморрагической болезни новорожденных
С учетом периода возникновения первых симптомов геморрагическая болезнь новорожденных имеет следующие формы:
- Ранняя. Симптомы возникают в первые 12-36 часов с момента родов. Встречается редко. Обычно является последствием медикаментозной терапии матери.
- Классическая. Манифестация симптомов происходит на 2-6 сутки. Наиболее распространенная форма.
- Поздняя. Развивается после 1 недели жизни, редко возникает в возрасте до 4-х месяцев. Как правило, формируется на фоне провоцирующих заболеваний или отсутствия профилактических инъекций витамина К.
Симптомы геморрагической болезни новорожденных
Поздняя форма имеет клинику, аналогичную классической, но обычно возникает на 7-14 день жизни и чаще протекает с осложнениями. Примерно у 15% детей с данной формой существует риск развития геморрагического шока, проявляющегося общей слабостью, бледностью кожных покровов, падением АД и снижением температуры тела.
Диагностика геморрагической болезни новорожденных
Диагностика геморрагической болезни новорожденных заключается в выяснении факторов риска, проведении объективного обследования, изучении результатов лабораторных и инструментальных методов исследования. При сборе анамнеза неонатологу или педиатру удается обнаружить предрасполагающие факторы: прием матерью медикаментов, нарушение диеты, сопутствующие заболевания и т. д. Также при опросе важно установить первые симптомы заболевания ребенка и их выраженность в момент возникновения.
Физикальное обследование дает возможность определить диффузные геморрагии на коже (редко – локально, на ягодицах), желтуху при гипербилирубинемии, нарушение общего состояния и симптомы гиповолемии при геморрагическом шоке. Лабораторные анализы направлены на оценку системы гемостаза. Проводится определение уровня тромбоцитов, тромбинового времени и количества фибриногена. Определяется время ретракции кровяного сгустка (показатели в пределах нормы), активированное частичное тромбопластиновое время (АЧТВ), время свертываемости крови по Бюркеру и время рекальцификации плазмы (результаты указывают на дефицит факторов свертывания). В ОАК возможны признаки анемии. УЗИ и нейросонография могут выявлять кровоизлияния в надкостницу костей черепа, ткани ЦНС и другие органы.
Лечение геморрагической болезни новорожденных
Этиотропное лечение геморрагической болезни новорожденных предполагает заместительную терапию аналогами витамина К. В педиатрии используют синтетические препараты витамина К (викасол). Длительность введения – от 2 до 4 дней в зависимости от результатов контрольных тестов. При наличии гематемезиса проводят промывание желудка физиологическим раствором, вводят аминокапроновую кислоту через зонд. При подтвержденном желудочно-кишечном кровотечении показана энтеральная смесь, содержащая тромбин, адроксон и аминокапроновую кислоту. Лечение геморрагического шока подразумевает восстановление ОЦК при помощи инфузионной терапии с использованием 10% раствора глюкозы, 0,9% NaCl, свежезамороженной плазмы и протромбинового комплекса (РР5В).
Прогноз и профилактика геморрагической болезни новорожденных
При неосложненной геморрагической болезни новорожденных прогноз благоприятный. При развитии кровоизлияний в ткани головного мозга у 30% детей наблюдаются тяжелые повреждения ЦНС. В отдельных случаях возможен летальный исход. Рецидивов не возникает. Формирование других нарушений гемостаза после выздоровления не характерно.
Профилактика проводится всем детям, относящимся к группе риска. В группу риска входят недоношенные пациенты со сроком гестации от 22 до 37 недель, дети с родовой травмой новорожденных, больные, находящиеся на искусственном или парентеральном вскармливании, новорожденные, получающие антибактериальные средства, и малыши, рожденные от матери с факторами риска. Профилактические меры заключаются в одноразовом введении викасола, раннем и полноценном грудном вскармливании. На данный момент аналоги витамина К рекомендовано вводить при рождении абсолютно всем детям. Со стороны матери следует максимально ограничить прием провоцирующих медикаментов, проводить адекватное лечение сопутствующих заболеваний во время беременности, регулярно посещать женскую консультацию и проходить соответствующие обследования (УЗИ, ОАК, ОАМ и другие).
Гемофилия – наследственная патология системы гемостаза, в основе которой лежит снижение или нарушение синтеза VIII, IX или XI факторов свертывания крови. Специфическим проявлением гемофилии служит склонность больного к различным кровотечениям: гемартрозам, внутримышечным и забрюшинным гематомам, гематурии, желудочно-кишечным кровотечениям, длительным кровотечениям при операциях и травмах и др. В диагностике гемофилии первостепенное значение имеет генетическое консультирование, определение уровня активности факторов свертываемости, ДНК-исследование, анализ коагулограммы. Лечение гемофилии предполагает проведение заместительной терапии: трансфузии гемоконцентратов с факторами свертывания VIII или IX, свежезамороженной плазмы, антигемофильного глобулина и др.
Общие сведения
Гемофилия – заболевание из группы наследственных коагулопатий, обусловленное дефицитом факторов свертывания плазмы крови и характеризующееся повышенной склонностью к геморрагиям. Распространенность гемофилии А и В составляет 1 случай на 10000-50000 представителей мужского пола. Чаще всего дебют заболевания приходится на ранний детский возраст, поэтому гемофилия у ребенка является актуальной проблемой педиатрии и детской гематологии. Кроме гемофилии, у детей встречаются и другие наследственные геморрагические диатезы: геморрагическая телеангиэктазия, тромбоцитопатия, болезнь Гланцмана т. п.

Причины гемофилии
Гены, обусловливающие развитие гемофилии, сцеплены с половой Х-хромосомой, поэтому заболевание наследуется по рецессивному признаку по женской линии. Наследственной гемофилией болеют практически исключительно лица мужского пола. Женщины являются проводниками (кондукторами, носителями) гена гемофилии, передающими заболевание части своих сыновей.
У здорового мужчины и женщины-кондуктора с одинаковой вероятностью могут родиться как больные, так и здоровые сыновья. От брака мужчины, больного гемофилией со здоровой женщиной рождаются здоровые сыновья или дочери-кондукторы. Описаны единичные случаи гемофилии у девочек, рожденных от матери-носителя и больного гемофилией отца.
Врожденная гемофилия встречается почти у 70 % пациентов. В этом случае наследуется форма и тяжесть гемофилии. Около 30% наблюдений приходится на спорадические формы гемофилии, связанные с мутацией в локусе, кодирующем синтез плазменных факторов свертывания крови на Х-хромосоме. В дальнейшем такая спонтанная форма гемофилии становится наследственной.
Свертываемость крови, или гемостаз, служит важнейшей защитной реакцией организма. Активизация системы гемостаза происходит в случае повреждения сосудов и начала кровотечения. Свертываемость крови обеспечивается тромбоцитами и особыми веществами – плазменными факторами. При дефиците того или иного фактора свертывания своевременный и адекватный гемостаз становится невозможным. При гемофилии в связи с дефицитом VIII, IX или других факторов нарушается первая фаза свертывания крови - образование тромбопластина. При этом увеличивается время свертывания крови; иногда кровотечение не останавливается в течение нескольких часов.
Классификация гемофилии
В зависимости от дефицита того или иного фактора свертываемости крови, различают гемофилию А (классическую), В (болезнь Кристмаса), С и др.
- Классическая гемофилия составляет подавляющее большинство (около 85%) случаев синдрома и связана с дефицитом VIII фактора свертывания (антигемофильного глобулина), приводящим к нарушению образование активной тромбокиназы.
- При гемофилии В, составляющей 13% случаев заболевания, имеет место недостаток IX фактора (плазменного компонента тромбопластина, фактора Кристмаса), также участвующего в образовании активной тромбокиназы в I фазе свертывания крови.
- Гемофилия С встречается с частотой 1-2% и обусловлена недостаточностью XI фактора свертывания крови (предшественника тромбопластина). На остальные разновидности гемофилии приходится менее 0,5% случаев; при этом может отмечаться дефицит различных плазменных факторов: V (парагемофилия), VII (гипопроконвертинемия), Х (болезнь Стюарта – Прауэр) и др.
Тяжесть клинического течения гемофилии зависит от степени недостаточности коагуляционной активности плазменных факторов свертывания крови.
- При гемофилии тяжелой степени уровень недостающего фактора составляет до 1%, что сопровождается развитием тяжелого геморрагического синдрома уже в раннем детском возрасте. У ребенка с тяжелой гемофилией возникают частые спонтанные и посттравматические кровоизлияния в мышцы, суставы, внутренние органы. Сразу после рождения ребенка могут обнаруживаться кефалогематомы, длительные кровотечения из пуповинного отростка, мелена; позднее - продолжительные кровотечения, связанные с прорезыванием и сменой молочных зубов.
- При среднетяжелой степени гемофилии у ребенка уровень плазменного фактора составляет 1-5%. Заболевание развивается в дошкольном возрасте; геморрагический синдром выражен умеренно, отмечаются кровоизлияния в мышцы и суставы, гематурия. Обострения случаются 2-3 раза в год.
- Легкая форма гемофилии характеризуется уровнем фактора выше 5%. Дебют заболевания возникает в школьном возрасте, часто в связи с травмами или операциями. Кровотечения более редкие и менее интенсивные.
Симптомы гемофилии
У новорожденных детей признаками гемофилии могут служить длительное кровотечение из культи пуповины, подкожные гематомы, кефалогематомы. Кровотечения у детей первого года жизни могут быть связаны с прорезыванием зубов, оперативными вмешательствами (инцизией уздечки языка, циркумцизио). Острые края молочных зубов могут стать причиной прикусывания языка, губ, щек и кровотечений из слизистых оболочек полости рта. Однако в грудном возрасте гемофилия дебютирует редко в связи с тем, что материнском молоке содержится достаточное количество активной тромбокиназы.
Вероятность посттравматических кровотечений значительно возрастает, когда ребенок с гемофилией начинает вставать и ходить. Для детей после года характерны носовые кровотечения, подкожные и межмышечные гематомы, кровоизлияния в крупные суставы. Обострения геморрагического диатеза случаются после перенесенных инфекций (ОРВИ, ветрянки, краснухи, кори, гриппа и др.) вследствие нарушения проницаемости сосудов. В этом случае нередко возникают самопроизвольные диапедезные геморрагии. Ввиду постоянных и длительных кровотечений у детей с гемофилией имеется анемия различной степени выраженности.
По степени убывания частоты кровоизлияния при гемофилии распределяются следующим образом: гемартрозы (70—80%), гематомы (10-20%), гематурия (14-20%), желудочно-кишечные кровотечения (8%), кровоизлияния в ЦНС (5%).
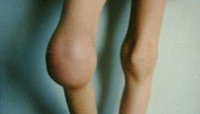
Гемартрозы являются наиболее частым и специфическим проявлением гемофилии. Первые внутрисуставные кровоизлияния у детей с гемофилией случаются в возрасте 1-8 лет после ушибов, травм или спонтанно. При гемартрозе выражен болевой синдром, отмечается увеличение сустава в объеме, гиперемия и гипертермия кожи над ним. Рецидивирующие гемартрозы приводят к развитию хронического синовита, деформирующего остеоартроза и контрактур. Деформирующий остеоартроз приводит к нарушению динамики опорно-двигательного аппарата в целом (искривлению позвоночника и таза, гипотрофии мышц, остеопорозу, вальгусной деформации стопы и др.) и к наступлению инвалидности уже в детском возрасте.
При гемофилии часто возникают кровоизлияния в мягкие ткани – подкожную клетчатку и мышцы. У детей обнаруживаются непроходящие синяки на туловище и конечностях, часто возникают глубокие межмышечные гематомы. Такие гематомы склонны к распространению, поскольку излившаяся кровь не сворачивается и, проникая вдоль фасций, инфильтрирует ткани. Обширные и напряженные гематомы могут сдавливать крупные артерии и периферические нервные стволы, вызывая интенсивные боли, паралич, атрофию мышц или гангрену.
Довольно часто при гемофилии возникают кровотечения из десен, носа, почек, органов ЖКТ. Кровотечение может быть инициировано любыми медицинскими манипуляциями (внутримышечной инъекцией, экстракцией зуба, тонзиллэктомией и др.). Крайне опасными для ребенка с гемофилией являются кровотечения из зева и носоглотки, поскольку могут привести к обструкции дыхательных путей и потребовать экстренной трахеостомии. Кровоизлияния в мозговые оболочки и головной мозг приводят к тяжелым поражениям ЦНС или летальному исходу.
Гематурия при гемофилии может возникать самопроизвольно или вследствие травм поясничной области. При этом отмечаются дизурические явления, при образовании кровяных сгустков в мочевыводящих путях - приступы почечной колики. У больных с гемофилией нередко обнаруживаются пиелоэктазия, гидронефроз, пиелонефрит.
Желудочно-кишечные кровотечения у пациентов с гемофилией могут быть связаны с приемом НПВС и др. лекарств, с обострением латентного течения язвенной болезни желудка и двенадцатиперстной кишки, эрозивным гастритом, геморроем. При кровоизлияниях в брыжейку и сальник развивается картина острого живота, требующая дифференциальной диагностики с острым аппендицитом, кишечной непроходимостью и др.
Характерным признаком гемофилии является отсроченный характер кровотечения, которое обычно развивается не сразу после травмы, а через некоторое время, иногда спустя 6-12 и более часов.
Диагностика гемофилии
Диагностика гемофилии проводится при участии ряда специалистов: неонатолога, педиатра, генетика, гематолога. При наличии у ребенка сопутствующей патологии или осложнений основного заболевания проводятся консультации детского гастроэнтеролога, детского травматолога-ортопеда, детского отоларинголога, детского невролога и др.
Супружеские пары, находящиеся в группе риска по рождению ребенка с гемофилией, должны пройти медико-генетическое консультирование еще на этапе планирования беременности. Выявить носительство дефектного гена позволяет анализ генеалогических данных и молекулярно-генетическое исследование. Возможно проведение пренатальной диагностики гемофилии с помощью биопсии хориона или амниоцентеза и исследования ДНК клеточного материала.
После рождения ребенка диагноз гемофилии подтверждается с помощью лабораторных исследований гемостаза. Основные изменения показателей коагулограммы при гемофилии представлены увеличением времени свертывания крови, АЧТВ, тромбинового времени, МНО, времени рекальцификации; уменьшением ПТИ и др. Решающее значение при диагностике формы гемофилии принадлежит определению снижения прокоагулянтной активности одного из факторов свертывания ниже 50%.
При гемартрозах ребенку с гемофилией проводится рентгенография суставов; при внутренних кровотечениях и забрюшинных гематомах – УЗИ брюшной полости и забрюшинного пространства; при гематурии – общий анализ мочи и УЗИ почек и т. д.
Лечение гемофилии
При гемофилии полное избавление от заболевания невозможно, поэтому основу лечения составляет заместительная гемостатическая терапия концентратами VIII и IX факторов свертывания крови. Необходимая доза концентрата определяется степенью выраженности гемофилии, тяжестью и видом кровотечения.
При незначительных наружных кровотечениях (порезах, кровотечениях из полости носа и рта) может использоваться гемостатическая губка, наложение давящей повязки, обработка раны тромбином. При неосложненном кровоизлиянии ребенку необходим полный покой, холод, иммобилизация больного сустава гипсовой лонгетой, в дальнейшем – УВЧ, электрофорез, ЛФК, легкий массаж. Больным с гемофилией рекомендуется диета, обогащенная витаминами А, В, С, D, солями кальция и фосфора.
Прогноз и профилактика гемофилии
Длительная заместительная терапия приводит к изоиммунизации, образованию антител, блокирующих прокоагулянтную активность вводимых факторов, и неэффективности гемостатической терапии в обычных дозах. В таких случаях больному с гемофилией проводится плазмаферез, назначаются иммунодепрессанты. Поскольку больным с гемофилией проводится частое переливание компонентов крови, не исключается риск инфицирования ВИЧ-инфекцией, гепатитами В, С и D, герпесом, цитомегалией.
Легкая степень гемофилии не влияет на продолжительность жизни; при тяжелой гемофилии прогноз ухудшается при массивных кровотечениях, обусловленных операциями, травмами.
Профилактика предполагает проведение медико-генетического консультирования супружеских пар, имеющих отягощенный семейный анамнез по гемофилии. Дети, больные гемофилией, всегда должны иметь при себе специальный паспорт, где указан тип заболевания, группа крови и Rh-принадлежность. Им показан охранительный режим, профилактика травм; диспансерное наблюдение педиатра, гематолога, детского стоматолога и др. специалистов; наблюдение в условиях специализированного гемофильного центра.
Категории МКБ: Гематемезис новорожденных (P54.0), Геморрагическая болезнь плода и новорожденного (P53), Желудочно-кишечное кровотечение у новорожденного (P54.3), Кровотечение из прямой кишки у новорожденного (P54.2), Мелена новорожденного (P54.1)
Общая информация
Краткое описание
Геморрагическая болезнь новорожденного – заболевание, проявляющееся повышенной кровоточивостью вследствие неполноценной активности витамин К-зависимых факторов свертывания крови.
Классификация
Ранняя геморрагическая болезнь плода и новорожденного: проявляется в первые сутки после рождения, что обусловлено низким уровнем витамина К у плода (не более 50% уровня взрослого).
Классическая геморрагическая болезнь новорожденного: проявляется на первой неделе после рождения вследствие незначительного поступления витамина К с грудным молоком и отсутствием должной кишечной микрофлоры, участвующей в синтезе витамина К.
Поздняя геморрагическая болезнь новорожденных – проявляется между 2 и 12 неделей жизни и обусловлена вторичным нарушением синтеза полипептидных предшественников факторов свертывания крови вследствие заболевания печени (гепатит, атрезия желчных ходов, длительное парентеральное питание или синдром мальабсорбции и др.).
Диагностика
• При ранней форме ГрБ характерно появление кровоточивости в первые часы или сутки после рождения в виде кожных геморрагий, внутричерепных кровоизлияний, кефалогематомы.
• Классическая форма ГрБ новорожденных проявляется кровоточивостью на 2-5 день жизни. Характерно появление мелены, гематомезис, кожные геморрагии (экхимозы, петехии), носовые кровотечения и др. У детей с тяжелой родовой травмой, гипоксией высок риск кровоизлияний под апоневроз, внутренних гематом и др.
• Поздняя форма ГрБ новорожденных реализуется на фоне переносимых заболеваний.
Данные анамнеза, позволяющие еще до рождения выявить новорожденных, у которых возможно появление признаков кровоточивости представлены в пункте 11 А (А. Анализ факторов риска).
Полный осмотр новорожденного проводится через 2 часа после рождения, при котором можно выявить уже в первые часы или сутки кожные геморрагии, внутричерепные кровоизлияния, кефалогематомы при адекватно проведенных родах.
• При отсутствии доступа или невозможности забора крови из вены, ее можно взять из артериального катетера в необходимом количестве (1 мл).
• При признаках ДВС синдрома дополнительно исследуют следующие параметры: продукты деградации фибриногена (ПДФ), D-димер.
• Проведение дополнительных исследований зависит от результатов предыдущих исследований и рекомендации консультанта гематолога.
Границы нормы
Дифференциальный диагноз
Дифференциальный диагноз проводится между следующими заболеваниями: наследственные геморрагические заболевания вследствие дефицита факторов свертывания, болезнями печени, ДВС синдромом.
Лечение
• Всем новорожденным с нарушением гемостаза, которые не получили витамин К на момент рождения, необходимо ввести витамин К из расчета 100 мкг/кг внутримышечно.
• Если протромбиновое и активированное частичное тромбопластиновое время находятся за пределами верхней границы нормы, необходимо ввести СЗП внутривенно в течение 30 минут из расчета 10-15 мл/кг.
• Повторно провести исследование протромбинового и активированного частичного тромбопластинового времени и при сохранении их нарушений – повторить прежнюю дозу СЗП.
• Если отсутствует эффект после введения СЗП, применяют криопреципитат из расчета 5 мл/кг в течение 30 минут.
• Повторно провести исследование протромбинового и активированного частичного тромбопластинового времени и при сохранении их нарушений – ввести криопреципитат в той же дозе.
• При сохранении показаний необходимо повторять исследование на свертываемость крови каждые 12 часов.
Другие виды лечения: нет.
Для профилактики геморрагической болезни новорожденного после рождения необходимо ввести витамина К в/м 1 мг однократно (возможно пероральное применение препарата согласно инструкции).
Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе:
Препараты (действующие вещества), применяющиеся при лечении
| Витамин K (Vitamin K ) |
| Криопреципитат |
| Плазма свежезамороженная |
Госпитализация
Информация
Источники и литература
Информация
Условия пересмотра протокола: пересмотр протокола через 3 года и/или при появлении новых методов диагностики и/или лечения с более высоким уровнем доказательности.
Читайте также:

