Гипотеза о невидимых возбудителях инфекционных заболеваний
Обновлено: 05.05.2024
24 марта 1882 года, когда Роберт Кох объявил о том, что сумел выделить бактерию, вызывающую туберкулёз, ученый достиг величайшего за всю свою жизнь триумфа.
Почему все же именно открытие возбудителя туберкулеза называют научным подвигом?
Дело в том, что возбудители болезни туберкулеза – чрезвычайно трудный объект для исследования. В первых препаратах для микроскопии, сделанных Кохом из легочной ткани молодого рабочего, умершего от скоротечной чахотки, ни одного микроба обнаружить не удалось. Не теряя надежды, ученый провел окраску препаратов по собственной методике и впервые под микроскопом увидел неуловимого возбудителя туберкулеза.
На следующем этапе необходимо было получить пресловутые микробактерии в чистой культуре. Еще несколько лет назад Кох нашел способ культивирования микробов не только на подопытных животных, но и в искусственной среде, например, на разрезе сваренного картофеля или в мясном бульоне. Он попытался таким же способом культивировать и бактерии туберкулеза, но они не развивались. Однако когда Кох впрыснул содержимое раздавленного узелка под кожу морской свинки, та погибла в течение нескольких недель, а в ее органах ученый нашел огромное количество палочек. Кох пришел к выводу, что бактерии туберкулеза могут развиваться только в живом организме.
Желая создать питательную среду, подобную живым тканям, Кох решил применить сыворотку животной крови, которую ему удалось раздобыть на бойне. И действительно, в этой среде бактерии быстро размножались. Полученными таким образом чистыми культурами бактерий Кох заразил несколько сотен подопытных животных разных видов, и все они заболели туберкулезом. Ученому было ясно, что возбудитель заболевания найден. В это время мир был возбужден открытым Пастером методом предупреждения заразных болезней с помощью прививок ослабленных культур бактерий, вызывающих данную болезнь. Поэтому Кох считал, что ему удастся тем же способом спасти человечество от туберкулеза.


26 декабря 1891 года Эмиль фон Беринг спас жизнь больному ребенку, сделав ему первую прививку от дифтерии.
До начала XX века дифтерия ежегодно уносила тысячи детских жизней, а медицина была бессильна облегчить их страдания и спасти от тяжелой агонии.
Немецкий бактериолог Фридрих Лёффлер в 1884 году сумел открыть бактерии, вызывающие дифтерию — палочки Corynebacterium diphtheriae. А ученик Пастера Пьер Эмиль Ру показал, как действуют палочки дифтерии и доказал, что все общие явления дифтерии — упадок сердечной деятельности, параличи и прочие смертельные последствия – вызваны не самой бактерией, а вырабатываемым ею ядовитым веществом (токсином), и что вещество это, введенное в организм, вызывает эти явления само по себе, при полном отсутствии в организме дифтерийных микробов.
Но Ру не умел обезвредить яд и не мог найти способ спасения больных детей. В этом ему помог ассистент Коха Беринг. В поисках средства, которое убивало бы бактерии дифтерии, Беринг делал прививки зараженным животным из разных веществ, но животные погибали. Однажды для прививки он использовал трихлорид йода. Правда, и на этот раз морские свинки тяжело заболели, но ни одна из них не погибла.
Воодушевленный первой удачей, Беринг, дождавшись выздоровления подопытных свинок, сделал им прививку, содержавшую дифтерийный токсин. Животные превосходно выдержали прививку, несмотря на то, что получили огромную дозу токсина. Затем ученый выяснил, что если сыворотку крови перенесших дифтерию и выздоровевших морских свинок ввести заболевшим животным, те выздоравливают. Значит, в крови переболевших появляется какой-то антитоксин, который нейтрализует токсин дифтерийной палочки.
Уже позже, в 1913 году, Беринг предложил введение смеси токсина и антитоксина для выработки у детей активного иммунитета. И это оказалось наиболее действенным средством защиты (пассивный иммунитет, возникающий после введения одного только антитоксина, недолговечен). Профилактическая сыворотка, которая употребляется теперь против дифтерии, была найдена доктором Гастоном Рамоном, работником Пастеровского института в Париже, много лет спустя после открытия Лефлера, Ру и Беринга.
В конце XIX в. немецкий ученый Пауль Эрлих (1854-1915) положил начало учению об антителах как факторах гуморального иммунитета. Бурная полемика и многочисленные исследования, предпринятые после этого открытия, привели к весьма плодотворным результатам: было установлено, что иммунитет определяется как клеточными, так и гуморальными факторами. Таким образом, было создано учение об иммунитете. П. Эрлих в 1908 г. был удостоен Нобелевской премии по физиологии за создание клеточной теории иммунитета, которую он разделил с Ильей Ильичом Мечниковым. .
1892 год считается годом открытия новых организмов — вирусов .
Впервые существование вируса (как нового типа возбудителя болезней) доказал русский учёный Дмитрий Иосифович Ивановский . Дмитрий Иосифович обнаружил вирусы в результате изучения заболевания табачных растений.
Пытаясь найти возбудителя опасной болезни – табачной мозаики (проявляется на многих, особенно тепличных растениях в виде скручивающихся трубочкой, желтеющих и опадающих листьев, в некрозе плодов, нарастающих боковых почек), Ивановский несколько лет занимался исследованиями в Никитском ботаническом саду под Ялтой и в ботанической лаборатории АН.
Зная из работ голландского ботаника А.Д. Майера о том, что мозаичную болезнь табака можно вызвать переносом сока больных растений здоровым, ученый растирал листья больных растений, процеживал сок через полотняный фильтр и впрыскивал его в жилки здоровых листьев табака. Как правило, инфицированные растения перенимали болезнь.
Ботаник тщательно изучал под микроскопом больные листья, но не обнаружил ни бактерий, ни еще каких-либо микроорганизмов, что неудивительно, так как вирусы размером от 20 до 300 нм (1 нм = 109 м) на два порядка меньше бактерий, и их в оптический микроскоп увидеть нельзя. Считая, что в инфицировании виноваты все-таки бактерии, ботаник стал пропускать сок через специальный фарфоровый фильтр Э. Шамберлана, но, вопреки ожиданиям, инфекционные свойства отфильтрованного сока сохранялись, то есть, фильтр не улавливал бактерии.
1921 год ознаменовался изобретением живой бактериальной вакцины против туберкулеза (БЦЖ).
В 1908 году они работали в Институте Пастера в Лилле. Их деятельность охватывала получение культур туберкулёзной палочки и исследования различных питательных сред. При этом ученые выяснили, что на питательной среде на основе глицерина, жёлчи и картофеля вырастают туберкулёзные палочки наименьшей вирулентности (от лат. virulentus— ядовитый, сумма свойств микроба, определяющая его болезнетворное действие).
С этого момента они изменили ход исследования, чтобы выяснить, нельзя ли посредством повторяющегося культивирования вырастить ослабленный штамм для производства вакцины. Исследования продлились до 1919 года, когда вакцина с невирулентными (ослабленными) бактериями не вызвала туберкулёз у подопытных животных. В 1921 году ученые создали вакцину БЦЖ ( BCG - Bacille bilie' Calmette-Gue'rin) для применения на людях.
Общественное признание вакцины проходило с трудом, в частности, из-за случавшихся трагедий. В Любеке 240 новорождённых были привиты в 10-дневном возрасте. Все они заболели туберкулёзом, 77 из них умерли. Расследование показало, что вакцина была заражена вирулентным (неослабленным) штаммом, который хранился в том же инкубаторе. Вина была возложена на директора больницы, которого приговорили к 2 годам лишения свободы за халатность, повлёкшую смерть.
Многие страны, получившие от Кальметта и Герена штамм БЦЖ (1924-1925 гг.), подтвердили его эффективность и вскоре перешли к ограниченной, а затем и к массовой вакцинации против туберкулеза. В СССР штамм БЦЖ был привезен Л .А. Тарасевичем в 1925 году и обозначен BCG-I.
Вакцина БЦЖ выдержала испытание временем, ее эффективность проверена и доказана практикой. В наши дни вакцина БЦЖ является основным препаратом для специфической профилактики туберкулеза, признанным и используемым во всем мире. Попытки приготовления противотуберкулезной вакцины из других ослабленных штаммов или отдельных фракций микробных клеток пока не дали значимых практических результатов.
В 1923 году французский иммунолог Г. Рамон получил столбнячный анатоксин, который стал применяться для профилактики заболевания. Научное изучение столбняка началось во второй половине XIX века. Возбудитель столбняка был открыт почти одновременно русским хирургом Н. Д. Монастырским (в 1883 году) и немецким ученым А. Николайером (в 1884 году). Чистую культуру микроорганизма выделил в 1887 г. японский микробиолог С. Китазато, он же в 1890 г. получил столбнячный токсин и (совместно с немецким бактериологом Э. Берингом) создал противостолбнячную сыворотку.

По современным подсчётам, вакцина стоила бы $7 млрд, если бы была запатентована на момент выпуска.
12 апреля 1955 г . в США успешно завершилось крупномасштабное исследование, подтвердившее эффективность вакцины Джонаса Солка – первой вакцины против полиомиелита . Эксперименты по созданию противополиомиелитной вакцины Солк начал в 1947 году. Вакцина из предварительно умерщвленных формалином полиовирусов была испытана Американским национальным фондом по борьбе с полиомиелитом. Впервые вакцина, созданная из предварительно умерщвленных формалином полиовирусов, прошла испытание в 1953-54 гг. (тогда ее тестировали добровольцы), а с 1955 года она получила уже широкое применение.
В исследовании приняло участие около 1 млн детей в возрасте 6-9 лет, из которых 440 тыс. получили вакцину Солка. По свидетельству очевидцев, родители с воодушевлением делали пожертвования на исследование и охотно записывали своих детей в ряды его участников. Сейчас это трудно представить, но в то время полиомиелит был самой грозной детской инфекцией, и родители со страхом ожидали прихода лета, когда регистрировался сезонный пик инфекции.
Результаты пятилетнего, с 1956 по 1961 год, массового применения вакцины превзошли все ожидания: среди детей в возрастных группах, особенно подверженных инфекции, заболеваемость снизилась на 96%.
В 1991 году Всемирная организация здравоохранения объявила, что в Западном полушарии полиомиелит побежден. В странах Азии и Африки, благодаря массовым вакцинациям, заболеваемость также резко снизилась. Позже вакцина Солка была заменена на более совершенную, разработанную Альбертом Сэйбином. Однако вклад Джонаса Солка в борьбу с полиомиелитом это ничуть не приуменьшило: в этой области он по сей день считается первопроходцем.

По современным подсчётам, вакцина стоила бы $7 млрд, если бы была запатентована на момент выпуска.
В 1981-82 гг. стала доступной первая вакцина против гепатита В. Тогда в Китае приступили к использованию вакцины, приготовленной из плазмы крови, полученной от доноров из числа больных, которые имели продолжительную инфекцию вирусного гепатита В. В том же году она стала доступна и в США. Пик её применения пришёлся на 1982-88 гг. Вакцинацию проводили в виде курса из трёх прививок с временным интервалом. При постмаркетинговом наблюдении после введения такой вакцины отметили возникновение нескольких случаев побочных заболеваний центральной и периферической нервной системы. В исследовании привитых вакциной лиц, проведённом через 15 лет, подтверждена высокая иммуногенность вакцины, приготовленной из плазмы крови.
С 1987 г. на смену плазменной вакцине пришло следующее поколение вакцины против вируса гепатита В, в которой использована технология генной модификации рекомбинантной ДНК в клетках дрожжевого микроорганизма. Её иногда называют генно-инженерной вакциной. Синтезированный таким способом HBsAg выделяли из разрушаемых дрожжевых клеток. Ни один способ очистки не позволял избавляться от следов дрожжевых белков. Новая технология отличалась высокой производительностью, позволила удешевить производство и уменьшить риск, происходящий из плазменной вакцины.
В 1983 году Харальд цур Хаузен ему обнаружил ДНК папилломавируса в биопсии рака шейки матки, и это событие можно считать открытием онкогенного вируса ВПЧ-16.
Еще в 1976 году была выдвинута гипотеза о взаимосвязи вирусов папилломы человека (ВПЧ) с раком шейки матки. Некоторые разновидности ВПЧ безвредны, некоторые вызывают образование бородавок на коже, некоторые поражают половые органы (передаваясь половым путем). В середине семидесятых Харальд цур Хаузен обнаружил, что женщины, страдающие раком шейки матки, неизменно заражены ВПЧ.
В то время многие специалисты полагали, что рак шейки матки вызывается вирусом простого герпеса, но цур Хаузен нашел в раковых клетках не вирусы герпеса, а вирусы папилломы и предположил, что развитие рака происходит в результате заражения именно вирусом папилломы. Впоследствии ему и его коллегам удалось подтвердить эту гипотезу и установить, что большинство случаев рака шейки матки вызваны одним из двух типов этих вирусов: ВПЧ-16 и ВПЧ-18. Эти типы вируса обнаруживаются примерно в 70% случаях рака шейки матки. Зараженные такими вирусами клетки с довольно большой вероятностью рано или поздно становятся раковыми, и из них развивается злокачественная опухоль.
Исследования Харальда цур Хаузена в области ВПЧ-инфекции легли в основу понимания механизмов канцерогенеза, индуцированного вирусом папилломы. Впоследствии были разработаны вакцины, которые позволяют предотвратить инфекцию вирусами ВПЧ-16 и ВПЧ-18. Это лечение позволяет сократить объем хирургического вмешательства и в целом снизить угрозу, представляемую раком шейки матки.
В 2008 году Нобелевский комитет присудил Нобелевскую премию в области физиологии и медицины Харальду цур Хаузену за открытие того, что вирус папилломы может вызывать рак шейки матки.

Новость
Путь прионов
Автор
Редакторы

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific.
Биологическая сущность прионов
Рисунок 1. Метафора нейродегенеративного поражения мозга — это губка, в которую превращается нервная ткань в результате массовой гибели нейронов.
И тогда происходит удивительное событие: нормальные молекулы белка, контактируя с патологическими, сами превращаются в них, изменяя свою пространственную структуру (механизм трансформации остаётся загадкой и по сей день) [1]. Таким образом прион, как самый настоящий инфекционный агент, заражает нормальные молекулы, запуская цепную реакцию, разрушительную для клетки.
Некоторые сведения о прионах
Условия возникновения заболеваний
Условия возникновения прионовых болезней уникальны. Они могут формироваться по трём сценариям: как инфекционные, спорадические и наследственные поражения. В последнем варианте главную роль играет генетическая предрасположенность [2].
В последнее десятилетие интерес к этой теме возобновился в связи с возможностью развития диагностики и эффективной терапии [5]. Появилось множество различных объяснений для возрастных нейродегенеративных болезней, — например, окислительная модификация ДНК, липидов и/или белков; соматические мутации; измененный врождённый иммунитет; экзогенные токсины; несоответствия ДНК—РНК; нарушение работы шаперонов; отсутствие одного из аллелей гена [5]. Альтернативным комплексным разъяснением служит то, что различные группы белков могут формировать прионы. Несмотря на то, что небольшое количество прионов может быть удалено посредством путей белковой деградации, их чрезмерное накопление с течением времени позволяет прионам самостоятельно распространяться в организме (рис. 2), что приводит к нарушению деятельности центральной нервной системы [5].

Группы риска прионных заболеваний
Вот кого прионные заболевания могут настичь с наибольшей вероятностью:
- работники пищевой промышленности;
- ветеринары;
- патологоанатомы;
- хирурги;
- пациенты трансплантолога;
- каннибалы;
- лица, в семье которых были замечены синдромы Герстманна—Штрейслера—Шейнклера или фатальной инсомнии.
Лабораторная диагностика и лечение
Диагностика базируется на внутримозговом заражении мышат или хомяков, у которых медленно (до 150 дней) развивается соответствующее заболевание, если пациент был болен [2]. Часто проводится гистологическое исследование головного мозга погибших животных [2].
К сожалению, до настоящего времени еще не разработаны эффективные методы лечения прионовых болезней, хотя попытки предотвратить конформационный переход нормального белка в аномальный производятся. Поэтому самым надёжным способом предупреждения развития инфекционных форм является профилактика [2].
Перспективы
По-видимому, интерес к прионам не угаснет до тех пор, пока предположения на их счёт полностью не подтвердятся и не будут найдены эффективные способы лечения прионных заболеваний. В статье [6] говорится о необходимости современного исследования, которое требует тщательного рассмотрения чужеродных прионов в экстраневрональных тканях.
В качестве модельных объектов авторы использовали мышей: две линии, которые трансгенно экспрессировали овечий прионный белок, и одну линию, которая экспрессировала человеческий прионный белок (рис. 3). Задачей было сравнить эффективность межвидовой передачи инфекции посредством тканей мозга и селезёнки. Внутримозговое заражение чужеродным прионным белком выражалось в отсутствии или небольшом количестве инфекционного агента в мозгах этих мышей. Однако инфекционные чужеродные прионы обнаруживались в селезёнке на более ранних этапах заражения в сравнении с моментом, когда были использованы нейротропные прионы, тем самым определяя, что лимфатическая ткань может быть более пермиссивной к распространению чужеродных прионов по сравнению с мозгом.

Рисунок 3. Способность приона хомяков Sc237 заражать и передаваться при введении в мозг или селезенку трансгенным мышам, имеющим прионный белок PrP овцы (tg338; белые мыши) или человека (tg7; серые мыши). Число заболевших/инъецированных мышей показано в скобках; ниже приведено среднее время жизни (в днях).
Чем вызвана эта предпочтительная репликация прионов в лимфатических тканях, пока неизвестно. Однако полученные данные показывают, что человек может быть более чувствительным к чужеродным прионам, чем предполагалось ранее на основании присутствия прионов в мозгу, и по этой причине бессимптомный переносчик прионной болезни может быть не распознан. Это ещё раз подтверждает, что такая могущественная биомолекула как прион таит в себе немало загадок, раскрытие которых, возможно, поможет в понимании ряда неразрешимых проблем человечества.
Причины появления новых инфекционных заболеваний. Механизмы
Эндемическими называют инфекции, свойственные определенной территории (местности). При этом количество заражённых людей может варьировать. Иногда возникают эпидемии — массовое и прогрессирующее распространение инфекционных заболеваний в пределах определённой территории, значительно превышающее обычно регистрируемый уровень заболеваемости на этой территории за аналогичный период времени.
Скорость распространения инфекции зависит от способа её передачи. Например, передача возбудителей воздушно-капельным путём происходит быстрее, нежели половым. Контагиозность возбудителя обусловлена скоростью его распространения. Например, контагиозность кори выше, чем эпидемического паротита.
Количественным показателем заразности той или иной инфекции служит индекс контагиозности — выраженная в процентах доля лиц, заболевающих инфекционной болезнью в клинически выраженной форме, из числа восприимчивых к ней в пределах эпидемического очага. При уменьшении числа лиц, подверженных заболеванию, вследствие увеличения смертности, формирования иммунитета у населения число новых случаев заражения также начинает снижаться.
Для прогнозирования исхода эпидемии, а также для разработки методов профилактики и борьбы с заболеванием применяют математическое моделирование.
Установлено, что врачи-инфекционисты в большей степени подвержены риску заражения неизвестными заболеваниями, так как новые инфекции не всегда можно вовремя обнаружить и диагностировать. В основе их возникновения лежат три основных механизма:
• появление новых возбудителей;
• заселение микроорганизмами новых территорий;
• возникновение новой симптоматики.

Появление новых возбудителей инфекционных заболеваний
Со временем число инфицированных постепенно возрастало, и вирус смог распространиться по всему миру (см. рис. в гл. 44). Другой пример — ранее неизвестный коронавирус, также полученный человеком от животных в Южном Китае и вызывающий тяжёлый острый респираторный синдром.
Медицинское вмешательство или изменение условий окружающей среды может создать благоприятные условия для межвидовой передачи возбудителей. Например, существует предположение, что снижение иммунитета при ксенотрансплантации способствует заражению человека вирусами животных и передаче их другим людям, а вырубка дождевых лесов Южной Америки привела к заражению человека Trypanosoma cruzi.
Заселение новых территорий как причина новых инфекционных заболеваний
Климатические и демографические изменения позволяют микроорганизмам заселять новые территории. Например, вирус лихорадки Западного Нила в настоящее время активно распространяется по территории США. Климатические изменения, в частности глобальное потепление, способствуют распространению микроорганизмов, которым необходима высокая температура среды обитания.
Возникновение инфекций, ранее редко встречающихся
Изменения в программах вакцинации населения могут позволить ранее контролируемым инфекциям вновь возникнуть и поразить разные возрастные категории (например, коклюш и корь в Великобритании).
Изменение сельского хозяйства и пищевой промышленности как причина новых инфекционных заболеваний
Поражение микроорганизмами домашнего скота и птицы (например, штаммами Salmonella enteritidis) приводит к заражению продуктов питания и распространению инфекции. В развитых индустриальных странах широкое употребление в пишу продуктов, приготовленных из полуфабрикатов, привело к повышению риска заражения листериозом, в связи с чем были пересмотрены условия хранения пищевой продукции.
Изменение возбудителей инфекционных заболеваний
Некоторые возбудители, заселяя новые территории обитания, вызывают вспышки заболеваний, вытесняя другие, порой родственные микроорганизмы. Этот факт можно объяснить более слабой вирулентностью или контагиозностью последних. Так, Clostridium difficile (тип 027), продуцирующий сильнейший токсин, вызвал вспышку заболевания в Канаде, США и Великобритании, a Acinetobacter baumanni стал причиной множества внутрибольничных инфекций в Лондоне.
Распространение устойчивого к метициллину золотистого стафилококка типов 15 и 16 в большинстве стран привело к преобладанию этих штаммов над всеми остальными.
Биотерроризм как причина новых инфекционных заболеваний
В последнее время политическая нестабильность в мире всё чаще сочетается с возрастающей террористической опасностью. Это привело к повышению вероятности использования возбудителей различных инфекционных заболеваний в качестве биологического оружия. Акт биотерроризма с использованием спор сибирской язвы в США унёс жизни четырёх человек и продемонстрировал потребность в создании эффективных антитеррористических механизмов.
Возможно использование в качестве биологического оружия возбудителей натуральной оспы, туляремии, чумы, геморрагической лихорадки и др. Именно поэтому специалисты в области здравоохранения должны обладать своевременной и полной информацией о необычных инфекционных заболеваниях и их симптомах, а также для своевременной идентификации новых возбудителей работать во взаимодействии со всеми специализированными учреждениями.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Для развития инфекционного заболевания необходимо наличие ряда факторов.
Пути передачи возбудителей инфекционных заболеваний
Существуют различные способы передачи патогенных микроорганизмов. В некоторых случаях эпидемические штаммы хорошо переносят неблагоприятные условия и способны к быстрому распространению.
Большинство патогенных микроорганизмов приспосабливаются к тем или иным способам передачи. Следует отметить, что распространение возбудителей, вызывающих поражение дыхательной системы, облегчается при помощи кашля, который они вызывают. В то же время рвота и диарея, возникающие при заболеваниях, передающихся посредством фекально-орального механизма, способствуют попаданию возбудителей (находящихся в большом количестве в желудочно-кишечном тракте) в окружающую среду.
Внедрение возбудителя инфекции в организм хозяина
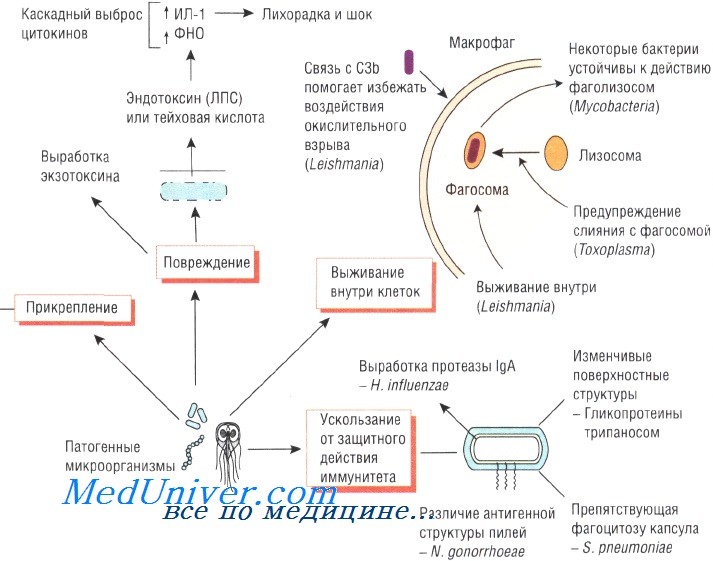
Для роста и размножения микроорганизмы должны проникнуть в ткани хозяина, а потому обладают широким спектром методов и механизмов прикрепления. Выбор органов-мишеней зависит от того, с какими рецепторами может взаимодействовать тот или иной возбудитель. Так, Neisseria gonorrhoeae прикрепляется к слизистой оболочке половых органов при помощи фимбрий, а вирус гриппа взаимодействует с клетками хозяина посредством гемагглютинина.
Эти свойства учитывают при определении сродства к рецепторам и исследовании патогенности видоспецифичных (определённые штаммы поражают определённые организмы) и межвидовых патогенов.
Некоторые бактерии обладают специальными механизмами, позволяющими им достичь эпителия млекопитающих. Например, для достижения энтероцитов Vibrio cholerae вырабатывает муциназу. Взаимодействие Н. pylori с сиалированными белками слизистой оболочки желудка зависит от степени сиалирования поверхностных структур возбудителя.
Патогенез инфекционного заболевания
Giardia lamblia прикрепляется к слизистой оболочке тощей кишки при помощи специальной присоски. Эритроциты, поражённые Plasmodium falciparum, продуцируют белок, стимулирующий адгезию к сосудам мозга, что приводит к развитию церебральной формы малярии.
Некоторые бактерии образуют полисахаридную биоплёнку, облегчающую микробное заселение искусственных протезов и имплантов (например, катетеров), постоянно находящихся в организме. Кроме того, некоторые штаммы стафилококков имеют гены, стимулирующие их прикрепление к пластиковым поверхностям и биомолекулам, покрывающим внутрисосудистые устройства.
При продолжительном повреждении тканей различные штаммы S. aureus могут связываться с некоторыми молекулами организма хозяина (фибронектин, вибронектин и коллаген). Различные штаммы Escherichia coli используют фимбрий, или пили, для прикрепления к маннозе или групповым антигенам крови и, соответственно, они вызывают инфекционные заболевания желудочно-кишечного тракта или мочевыводящих путей. ВИЧ связывается с CD4 и некоторыми другими антигенами.
Таким образом, каждый штамм обладает определёнными генами, обусловливающими его способность к внедрению в организм хозяина.
Инвазия возбудителя инфекционного заболевания
Существует множество механизмов, при помощи которых микроорганизмы преодолевают слизистые оболочки и различные типы клеточных мембран. После этого они должны закрепиться в организме хозяина и начать интенсивно размножаться.
Некоторые бактерии, например рода Helicobacter и Neisseria, продуцируют IgA-протеазу, разрушающую IgA. Таким образом, эти возбудители нейтрализуют одну из важнейших защитных систем слизистой оболочки организма.
Подвижность возбудителя инфекционного заболевания
Способность микроорганизмов передвигаться в поисках новых источников питания или в ответ на хемотаксические сигналы приводит к заметному усилению их патогенности. Например, штаммы Vibrio cholerae, обладающие жгутиками, намного более вирулентны, нежели неподвижные штаммы.
Устойчивость возбудителя инфекции к защитным механизмам иммунной системы
Для выживания в организме хозяина возбудителям необходимо противостоять защитным механизмам иммунной системы. Бактерии, поражающие дыхательную систему, продуцируют IgA-протеазу, разрушающую иммуноглобулины. Staphylococcus aureus секретирует протеин А, связывающий иммуноглобулины и препятствующий опсонизации и активации системы комплемента.
Один из важнейших механизмов противостояния иммунной системе — устойчивость к фагоцитозу. Полисахаридная капсула препятствует захвату Streptococcus pneumoniae полиморфноядерными нейтрофилами. Кроме того, некоторые микроорганизмы
Липополисахариды грамотрицательных бактерий обусловливают их устойчивость к действию комплемента, а Trypanosoma способна изменять свои поверхностные антигены во избежание их взаимодействия с антителами.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

