Может ли кишечная инфекция дать осложнение на почки
Обновлено: 26.04.2024
Высокая заболеваемость и смертность от хронической болезни почек (ХБП) в общей популяции формирует необходимость поиска новых патогенетических механизмов ее течения. Среди факторов, определяющих высокую смертность от сердечно-сосудистых заболеваний у боль
Intestinal microbiota and inflammation in chronic kidney disease T. V. Zueva, T. V. Zhdanova, S. E. Urazlina, E. V. Kuznetsova
High morbidity and mortality from chronic kidney disease (CKD) in the general population form the need to search for new pathogenic mechanisms of its course. The systemic inflammation is the factor conditioning the high mortality from cardiovascular diseases in patients with CKD. The changes in intestinal microbiota lead to the production of intestinal uremic toxins which trigger and support inflammation in CKD. Research in this direction is extremely promising. The presented literature review reveals the causes, mechanisms of inflammation in disorders of the intestinal microbiota, as well as new directions of nephroprotective therapy.
Роль микробиоты кишечника в продукции уремических токсинов (УТ), в прогрессировании хронической болезни почек (ХБП) и развитии кардиоваскулярных осложнений вызывает большой интерес [1]. В последнее время внимание сосредоточено на УТ, которые нелегко удаляются с помощью процедур диализа, таких как белковые молекулы, полученные из кишечника [2]. Состав микробиоты кишечника зависит от внешних и внутренних факторов, ее метаболическая активность может оказывать как благоприятное, так и губительное влияние на организм человека. В последние годы существенное значение в течении ХБП отводится токсинам, вырабатываемым бактериальной флорой кишечника. В основном это конечные продукты гликирования, фенолы и индолы. Есть данные, что бактериальная нагрузка и конечные продукты метаболизма кишечной флоры являются звеном патогенеза ХБП [3]. Дисбактериоз кишечной микрофлоры является одним из факторов риска прогрессирования ХБП [4]. В этом случае желудочно-кишечный тракт становится основным инициатором системного воспаления при ХБП. Наблюдается воспаление кишечной стенки на всем протяжении пищеварительного тракта, разрушается эпителиальный барьер и происходит транслокация бактериальной ДНК и эндотоксина в кровоток [3, 5]. Уровни эндотоксина, обнаруженные в сыворотке крови пациентов с ХБП и диализом, увеличиваются при прогрессировании ХПН и коррелируют с выраженностью системного воспаления. Кроме того, диета при ХБП с низким содержанием растительных волокон и симбиотических организмов (в сочетании с низким содержанием калия, низким содержанием фосфора) может изменить нормальный микробиом кишечника, что приводит к разрастанию бактерий, производящих УТ [5]. В результате ферментации бактериями таких аминокислот, как фенилаланин, тирозин и триптофан, образуются предшественники УТ: пара-крезол (р-крезол), фенол, индол. Эти вещества, попадая в кровоток в виде материнской субстанции или в виде конъюгатов (П-крезил сульфат (ПКС), фенил сульфата, крезол глюкуронида, фенил глюкуронида, индол глюкуронида, индол сульфата), оказывают провоспалительный эффект — стимулируют лейкоцитоз и дисфункцию эндотелия [3, 6, 7]. К наиболее значимым в патогенезе сердечно-сосудистых нарушений относят УТ: индоксил сульфат (ИС) и ПКС, карбокси-метил-пропил-фуранпропио- новую кислоту [8, 9]. Эти токсины индуцируют воспаление и усиливают окислительный стресс, провоцируя развитие гломерулярного склероза и интерстициального фиброза и усугубляя снижение функции почек [8–11]. ИС и ПКС являются независимыми факторами риска сердечно-сосудистых заболеваний (ССЗ) у пациентов с ХБП, особенно тех, кто получает терапию диализом [12]. Сыворотка крови у больных на гемодиализе очищается от ИС и ПКС уже во время первого сеанса диализа. Но их уровень имеет тенденцию возвращаться во время недельных сеансов диализа [13]. Эти протеин-связанные УТ способны индуцировать дисфункцию макрофагов, липопротеины высокой плотности при атеросклеротических повреждениях сосудов [12]. ИС и ПКС негативно коррелируют с почечной функцией. ПКС ингибирует цитокинстимулированную экспрессию эндотелиальных адгезивных молекул и способствует повышению проницаемости эндотелия. Уровень ПКС связан со смертностью больных, получающих терапию гемодиализом [7].
ИС — продукт метаболизма аминокислоты триптофана. Часть триптофана в толстом кишечнике под действием триптофаназы, продуцируемой кишечной флорой, превращается в индол. Часть индола выводится с калом, а часть всасывается и с током крови попадает в печень. В печени в результате окисления и сульфатирования превращается в ИС. ИС из печени поступает в кровь, где не менее 90% его связывается с альбуминами. Путем тубулярной канальцевой экскреции большая часть ИС удаляется почками. Накапливаясь при хронической почечной недостаточности (ХПН), ИС повреждает клеточные структуры: ДНК, белки, липиды, что приводит к гибели клетки и формированию гломерулярного склероза [8, 14]. ИС — белково-связанный, крайне токсичный и трудно элиминируемый при диализе УТ [8, 10, 11]. Уровень ИС и индол-3-уксусной кислоты выше у пациентов, получающих лечение диализом, чем у больных с консервативной стадией ХБП [15]. Уменьшение альбумина сыворотки крови при прогрессировании ХБП способствует ухудшению связывающей способности белковых УТ. Высокий уровень ИС и гипоальбуминемия при ХБП прогностически неблагоприятны в отношении развития кардиальной патологии и смертности от нее [16]. ИС оказывает множественные системные эффекты в организме [10]. В последних популяционных исследованиях доказана кардиоваскулярная токсичность ИС у больных ХБП [10, 14, 17]. ИС относят к васкулярным токсинам, который иницирует оксидативный стресс в клетках эндотелия, повреждая его, вызывает подавление пролиферации и регенерации эндотелия, стимулирует пролиферацию гладкомышечных клеток сосудов, повышает васкулярную жесткость, кальцификацию аорты и кардиальную смертность [8, 10, 18]. Роль активации арил-углеводородных рецепторов (AhR) в развитии воспаления и ССЗ при ХБП недостаточно определена [15]. Есть данные, что именно ИС активирует AhR и экспрессию тканевого фактора, что повышает свертываемость крови и риск возникновения атеросклероза [8, 10, 18]. Установленная взаимосвязь между индол-3-уксусной кислотой и AhR позволяет думать о важной роли УТ в клеточном пути воспаления у пациентов с ХБП [15]. Артериальный тромбоз, связанный с воздействием ИС, возникает за счет повышения уровня комплексного тканевого фактора/фактора VII, ингибитора активатора плазминогена-1
(PAI-1), активации тромбоцитов, а также снижения аортального уровня сиртуина 1 (SIRT1) и сиртуина 3 (SIRT3). Это способствует активации первичного гемостаза и усиленному образованию тромбоцитарной пробки с повышенным количеством фибрина и через факторы свертывания и фибринолиза плазмы влияет на вторичный гемостаз. Повышается кинетика и прочность образования сгустка. Таким образом, у пациентов с ХБП с высоким уровнем ИС повышается риск тромботических осложнений [17]. В эксперименте установлено, что ИС усиливает синтез фибробластов и гипертрофию в кардиомиоцитах, уплотняет и кальцифицирует стенки сосудов, способствует развитию остеодистрофии [8, 14]. ИС усугубляет ремоделирование предсердий через окислительный стресс, воспаление и фиброз [19]. УТ больных ХБП вносят значительный вклад в воспаление астроцитов. Так, ИС играет роль в иммунном ответе и в нейродегенерации у больных ХБП. Нарастание воспаления и окислительного стресса в клетках ЦНС, через активацию ядерного фактора-kB (NF-kB) и AhR индуцируют смерть нейронов [20].
ПКС также является продуктом микробного катаболизма аминокислот тирозина и фенилаланина в толстой кишке. Микробы толстой кишки метаболизируют эти аминокислоты в п-крезол, который затем конъюгируется с сульфатом в печени. В организме большая часть п-крезола представлена его метаболитами ПКС (в стенке кишечника) и п-крезил глюкуронидом (в печени). ПКС вызывает эндотелиальную дисфункцию, обладает протромботическим эффектом и сердечно-сосудистой токсичностью у больных ХБП, в том числе на диализе [14]. ИС и ПКС при ХБП способствуют кальцификации сосудов через активацию воспалительных и коагуляционных путей, и это тесно связано с нарушением гомеостаза глюкозы [21]. Эти токсины нарушают эндотелиальную морфологию артерий. При воздействии ПКС, ИС и неорганического фосфата снижается экспрессия белков VE-кадгерина и повышается белок цитоплазматической пластинки (Zonula Occludens-1, ZO-1). Это определяет патофизиологическую роль уремии в развитии повреждений межклеточных структур и открывает новые возможности для улучшения сердечно-сосудистых исходов у больных ХБП [22].
Фенилацетилглутамин (ФАГ) – еще один продукт катаболизма микробных аминокислот. Микробы толстой кишки метаболизируют фенилаланин до фенилуксусной кислоты, которая затем конъюгируется с глутамином в печени. Высокий уровень ФАГ ассоциируется с риском развития кардиоваскулярной патологии и сердечно-сосудистой смертностью. Триметиламин N-оксид (ТМАО) также образуется под действием микробных метаболитов толстой кишки. Из четвертичных аминов (таких как холин, бетаин и карнитин) микробы толстой кишки производят триметиламин, который окисляется до ТМАО в печени. Уровни ТМАО в плазме повышаются по мере снижения скорости клубочковой фильтрации и примерно в 30 раз выше у диализных пациентов, чем у здоровых. Высокие уровни ТМАО в плазме у диализных пациентов связаны с сердечно-сосудистой смертностью и риском развития первого сердечно-сосудистого события, а в эксперименте на мышах вызывают развитие атеросклероза [14]. Повышение ТМАО определяет неблагоприятные исходы у пациентов с сердечной недостаточностью и ХБП. Кинуренин – конечный продукт катаболизма триптофана. Его уровень не повышается пропорционально снижению функции почек. У диализных пациентов кинуренин связан с сывороточными маркерами гиперкоагуляции. Установлена корреляция между уровнем кинуренина и тромбозом артериовенозной фистулы и стента у пациентов с ХБП. В эксперименте на мышах в ответ на повреждение сосудов повышается уровень кинуренина в плазме, что способствует свертыванию крови [14].
Изучение роли микрофлоры кишечника в системном воспалении у пациентов с ХБП очень актуально. Дисбаланс микробиоты кишечника считается новым фактором риска ССЗ у больных ХБП, поскольку это напрямую связано с повышением выработки УТ, системным воспалением и окислительным стрессом [4–7]. Есть данные, что ухудшение функции сердца и почек нарушает первоначальный состав микробиоты кишечника, способствуя прогрессированию заболеваний [23]. Дисфункция кишечного барьера при ХБП способствует притоку эндотоксина и других вредных продуктов и развитию системного воспаления и уремической интоксикации [24]. УТ кишечного происхождения играют значимую роль в прогрессировании ХБП и развитии кардиоваскулярных осложнений [7]. Следовательно, нарушение микрофлоры кишечника может лежать в патофизиологии кардиоренального синдрома. Влияя на микробиоту кишечника, можно остановить этот порочный цикл и способствовать снижению хронических сердечно-сосудистых и почечных заболеваний [23].
Литература
Т. В. Зуева 1 , кандидат медицинских наук
Т. В. Жданова, доктор медицинских наук, профессор
С. Е. Уразлина
Е. В. Кузнецова, кандидат медицинских наук
ФГБОУ ВО УГМУ Минздрава России, Екатеринбург
Микробиота кишечника и воспаление при хронической болезни почек/ Т. В. Зуева, Т. В. Жданова, С. Е. Уразлина, Е. В. Кузнецова
Для цитирования: Лечащий врач № 1/2020; Номера страниц в выпуске: 32-35
Теги: болезни почек, микробиоценоз кишечника, сердечно-сосудистые заболевания
Функции почек при острых кишечных инфекциях. Влияние кишечных инфекций на почки
Своеобразное изменение функций почек наблюдается у больных острой кишечной инфекцией. Среди них следует особо выделить холеру, при которой поражения почек обусловлены гиповолемическим шоком, тогда как при сальмонеллезах и сепсисе поражения почек обусловлены инфекционно-токсическим шоком. При этих заболеваниях поражение почек в начале болезни, по сравнению с ведущими клиническими проявлениями, отодвигается на второй план и часто протекает субклинически. Лишь в разгар заболевания оно достигает клинической манифестаций вплоть до развития тяжелой ОПН. Еще ранее авторы отмечали, что при холере по мере усиления диарейного синдрома и особенно после присоединения рвоты уменьшается объем выделяемой мочи вплоть до анурии, которая наступает в стадии алгида.
При выздоровлении больных (реактивной стадии) наблюдается полиурия с выделением до 8 л мочи в сутки (Н.К. Розенберг). В современных условиях при адекватной регидратационной терапии солевыми растворами больных холерой Эль-Тор, основанной на строгом учете водных потерь с испражнениями, рвотой, потом и при дыхании и их почасовой коррекции, явления полиурии практически отсутствуют, за исключением случаев с сопутствующей патологией почек, как, например, у больной холерой Эль-Тор серотипа Инаба, страдавшей несахарным мочеизнурением, общие потери воды, включая мочеотделение, за 5 дней лечения с целью их компенсации потребовали введения 94 л солевых растворов. При холере ведущим механизмом поражения почек является острая изотоническая дегидратация.
В течение всего острого периода диареи на фоне адекватной регидратационной терапии диурез у него был снижен до 300-700 мл/сутки, протеинурия - 0,165 г/л, остаточный азот крови - 0,655 г/л. При патоморфологическом исследовании обнаружен некроз канальцев. Второй больной холерой скончался на 6-й день болезни при явлениях ОПН и уремии (мочевина крови-2,53 г/л, остаточный азот-0,89 г/л), несмотря на восстановление водно-солевого состава крови, на фоне адекватного лечения солевыми растворами. В почках обнаружены зернистая и вакуольная дистрофия эпителия проксимальных канальцев с мелкими очагами некроза. В коре почек - очаговое застойное капиллярное полнокровие с мелкими кровоизлияниями. В слизистой оболочке тонкой кишки обнаружены очаги геморрагического некроза (М.С. Брумштейн, Н.Б. Шалыгина).
Можно утверждать что произошла эволюция характера поражения почек при холере и ряде других инфекционных болезней на фоне современных методов лечения. Сегодня при рациональной терапии инфекций удается избежать осложнений, в частности, ОПН, и тем самым спасти жизнь многим больным.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Острая почечная недостаточность при кишечных инфекциях. Диагностика ОПН при инфекциях
При острых кишечных инфекциях, прежде всего при сальмонеллезе, может развиться патология почек. Степень нарушения функции почек зависит от тяжести течения болезни, в том числе от выраженности и длительности нарушений гемодинамики, а также от преморбидного состояния почек. По данным О.С.Буханцевой (1971), при пищевых токсикоинфекциях и сальмонеллезах в остром периоде выявлялись олигурия (77,8 %), патологические изменения мочевого осадка (47 %). Последние характеризовались протеинурией, микрогематурией, лейкоцитурией и цилиндрурией. Отмечалось снижение клубочковой фильтрации у 68,4 % обследованных лиц. При тяжелом течении пищевых токсикоинфекций и сальмонеллезов величина клубочковой фильтрации снижалась до 45,6 мл/мин, а при среднетяжелом — до 74,3 мл/мин. Вместе с тем выявлялось повышение канальцевой реабсорбции воды и концентрационного индекса креатинина у 87,7 % обследованных. Коэффициент очищения мочевины в остром периоде болезни был ниже нормы у 63,9 % больных. Сходные результаты были получены А.И.Ляшук (1973).
По данным Ю.Ю.Черниковой (1984), при среднетяжелом течении пищевых токсикоинфекций нарушаются реабсорбционная, азотовыделительная и ионрегулирующая функции почек, уменьшается объем внутриклеточной жидкости, снижается абсолютное содержание натрия в циркулирующей крови, а также концентрация калия и хлора. Автором были выявлены три типа нарушений кислотовыделительной функции почек, из которых наиболее неблагоприятными для регуляции КОС являлись парадоксальная ацидурия и тубулярный ацидоз. Аккомодационная способность почек, выявленная с помощью нагрузки бикарбонатом натрия, снижалась.
Однако у части больных с острыми кишечными инфекциями патологические изменения в почках достигают Уровня ОПН. Последняя справедливо расценивается как осложнение острых кишечных инфекций.
При пищевых токсикоинфекциях и сальмонеллезах острая почечная недостаточность нами была выявлена у 246 больных (0,8 %). Различались преренальная и ренальная форма ОПН. Преренальная форма ОПН отмечалась у 76,4 % из них и была связана с резкими нарушениями почечного кровотока при расстройствах гемодинамики.
Снижение систолического давления ниже 70 мм ртст резко ограничивало фильтрационный процесс в почках Как правило, преренальная форма ОПН наблюдалась при тяжелом течении пищевых токсикоинфекций с обезвоживанием II —III степени и нестабильной гемодинамикой Нарушения мочевыделения сопровождались снижением очистительной способности почек и приводили к повышению концентрации креатинина и мочевины в крови. По нашим наблюдениям, выявлялась достоверно низкая концентрация ионов натрия, калия и хлора, что в сочетании с повышенной реабсорбцией их в канальцах приводило к уменьшению выведения с мочой Суточная экскреция ионов натрия, калия и хлора снижалась. Уменьшение фильтрации и усиление реабсорбции носили компенсаторный характер, направленный на сохранение электролитного гомеостаза.
Выраженность преренальной формы ОПН может быть различной — от клинически латентной до значительной. У некоторых больных преренальная форма ОПН возникала при ИТШ, преимущественно с выраженным обезвоживанием. При этом кровоток в почках уменьшался не только в связи с общей циркуляторной недостаточностью, но и в результате селективной вазоконстрикции почечных сосудов. Эта компенсаторная реакция, направленная на "централизацию кровообращения", сопровождалась нарушением функционального состояния почек, особенно коркового слоя, на долю которого приходится до 90 % почечного кровотока. Развивались олигурия и азотемия. Эта начальная стадия преренальной формы ОПН обратима, но при сохраняющейся циркуляторной недостаточности может трансформироваться в ренальную форму ОПН — "ишемическую".
Эта форма проявляется усугублением олигурии, достигающей стадии анурии, а также нарастанием азотемии, протекающих в условиях коррекции гемодинамики. Тщательный учет диуреза помогает выявлять олигурию (диурез менее 500 мл/сут). При этом наблюдается стойкое снижение относительной плотности мочи (до 1003—1010), что свидетельствует о нарушении концентрационной функции почек. В мочевом осадке выявляются эритроциты, зернистые цилиндры и повышенное количество лейкоцитов. Диагностика ОПН должна быть ранней, и этому способствует исследование почасового диуреза. Снижение его ниже 35—45 мл/ч является признаком олигурии. Однако обычные анализы мочи информативны лишь у 2/3 больных. Наиболее информативны показатели концентрации креатинина в сыворотке крови (норма до 0,06—0,07 ммоль/л), несколько менее информативны показатели концентрации мочевины (норма до 8,3 ммоль/л). Азотемия во многих случаях предшествует снижению диуреза.
Для клинической картины ОПН характерны тошнота, повторная рвота, икота, анорексия, усталость, вялость, головная боль, заторможенность, сонливость, снижение диуреза. У некоторых больных возможно развитие анемии и изменений в свертывающей системе.
Таким образом, ОПН свойственны олигурия (у 80 % пациентов), метаболический ацидоз (чаще декомпенсированный), гиперкалиемия, гиперазотемия, угроза гипергидратации.
Необходимо иметь в виду, что критическими показателями при ОПН являются концентрация креатинина 0,6 ммоль/л, концентрация мочевины 30 ммоль/л, концентрация калия 6 ммоль/л.
Ренальная форма ОПН, по нашим наблюдениям, отмечалась у 23,6 % больных. Она была следствием поражения нефрона и канальцевого эпителия. Чаще всего эта форма ОПН наблюдалась при ИТШ, протекавшем без выраженного обезвоживания. Синдром "шоковой почки" наиболее часто развивался в фазе гиперкоагуляции ДВС. При этом микротромбы локализовались почти всегда в почечных клубочках, что определяло олигурию и снижение скорости фильтрации.
Распространенный гломерулотромбоз создавал условия для возникновения кортикального некроза канальцев и рассматривался как морфологический маркер синдрома "шоковой почки".
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.








Современные методы лечения




Острая кишечная инфекция
Кишечные инфекции – одно из самых распространенных заболеваний в мире.
Острые кишечные инфекции (ОКИ) – группа острых инфекционных заболеваний человека, вызываемых различными инфекционными агентами (преимущественно бактериями), с алиментарным механизмом заражения, проявляющиеся лихорадкой и кишечным синдромом с возможным развитием обезвоживания и тяжелым течением в детской возрастной группе и у пожилых людей.
Заболеваемость кишечными инфекциями в мире, и в частности в России, достаточно высока. Ежегодно на планете заболевают более 500 млн. человек. Показатель заболеваемости в России доходит до 400 и более случаев на 100 тыс. населения.
Причины кишечных инфекций
Пищеварительный тракт состоит из ротовой полости, глотки, пищевода, желудка, тонкого кишечника (включающего 12-типерстную кишку, тощую кишку, подвздошную кишку), толстого кишечника. В слюне ротовой полости присутствует вещество – лизоцим, обладающее бактериостатическим действием. Это первый защитный барьер. Слизистая оболочка желудка имеет железы, вырабатывающиежелудочный сок (состоящий из соляной кислоты и пепсина). Соляная кислота является вторым барьером для патогенных микроорганизмов, который могут в нем погибнуть (однако это происходит не всегда). Слизистая тонкого кишечника покрыта многочисленными ворсинками, участвующими в пристеночном пищеварении, выполняющими защитную и транспортную функции. Кроме того, слизистая кишечника содержит секреторный иммуноглобулин – IgA, играющий роль в иммунитете организма человека.
Микрофлора, населяющая кишечник, делится на облигатную (обязательную для присутствия в кишечнике), к которой относятся бифидобактерии, лактобактерии, кишечные палочки, бактероиды, фузобактерии, пептококки. Облигатная флора составляет 95-98% от всех представителей. Функция облигатной флоры – защитная за счет конкурентного присутствия и участие в процессах пищеварения. Другая группа микроорганизмов, населяющих кишечник, называется факультативной (добавочной) флорой, к которой относятся стафилококки, грибы, условно-патогенные микроорганизмы (клебсиеллы, стрептококки, протей, синегнойная палочка, клостридии и другие). Добавочная флора также может участвовать в процессе пищеварения за счет выработки определенных ферментов, однако условно-патогенная при определенном росте может вызвать развитие кишечного синдрома. Вся остальная флора, попадающая извне, называется патогенной и вызывает острую кишечную инфекцию.
Какие возбудители могут явиться причиной острой кишечной инфекции?
Выделяют несколько видов кишечных инфекций в зависимости от этиологии:
- Кишечная инфекция бактериальная: cальмонеллез (Salmonellae enteritidis et spp.), дизентерия (Shigellae sonnae et spp.), иерсиниоз (Iersiniae spp.), эшерихиоз (Esherihiae coli энтероинвазивные штаммы), кампилобактериоз (энтерит, вызванный Campylobacter), острая кишечная инфекция, вызванная синегнойной палочкой (Pseudomonas aeruginosa), клостридиями (Clostridium), клебсиеллами (Klebsiellae), протеем (Proteus spp.), стафилококковое пищевое отравление (Staphilococcus spp.), брюшной тиф (Salmonellae typhi), холера (Vibrio cholerae), ботулизм (отравление ботулотоксином) и прочие.
- ОКИ вирусной этиологии (ротавирусы, вирусы группы Норфолк, энтеровирусы, коронавирусы, аденовирусы, реовирусы).
- Грибковые кишечные инфекции (чаще грибы рода Candida).
- Протозойные кишечные инфекции (лямблиоз, амебиаз).
Причины возникновения кишечных инфекций

Источник инфекции – больной клинически выраженной или стертой формой кишечной инфекции, а также носитель. Заразный период с момента возникновения первых симптомов болезни и весь период симптомов, а при вирусной инфекции – до 2х недель после выздоровления. Больные выделяют возбудителей в окружающую среду с испражнениями, рвотными массами, реже с мочой.
Механизм заражения – алиментарный (то есть через рот). Пути инфицирования – фекально-оральный (пищевой или водный), бытовой, а при некоторых вирусных инфекциях – воздушно-капельный. Большинство возбудителей острой кишечной инфекции высокоустойчивы во внешней среде, хорошо сохраняют свои патогенные свойства на холоде (в холодильнике, например). Факторы передачи – пищевые продукты (вода, молоко, яйца, торты, мясо в зависимости от вида кишечной инфекции), предметы обихода (посуда, полотенца, грязные руки, игрушки, дверные ручки), купание в открытых водоемах. Основное место в распространении инфекции отводится соблюдению или не соблюдению норм личной гигиены (мытье рук после туалета, ухода за больным, перед едой, дезинфекция предметов обихода, выделение личной посуды и полотенца заболевшему, сокращение контактов до минимума).
Восприимчивость к кишечным инфекциям всеобщая независимо от возраста и пола. Наиболее восприимчивы к кишечным патогенам – дети и лица преклонного возраста, лица с заболеваниями желудка и кишечника, люди, страдающие алкоголизмом.
Иммунитет после перенесенной инфекции нестойкий, строго типоспецифический.
Общие симптомы острых кишечных инфекций
Инкубационный период (с момента попадания возбудителя до появления первых признаков болезни) длится от 6 часов до 2х суток, реже дольше.
Для практически любой кишечной инфекции характерно развитие 2х основных синдромов, но в различной степени выраженности:
- Инфекционно-токсического синдрома (ИТС), который проявляется температурой от субфебрильных цифр (37? и выше) до фебрильной лихорадки (38° и выше). При некоторых инфекциях температуры нет совсем (например, холера), также отсутствие температуры или небольшой кратковременный подъем характерен для пищевого отравления (стафилококкового, например). Температура может сопровождаться симптомами интоксикации (слабость, головокружение, ломота в теле, подташнивание, иногда на фоне высокой температуры рвота). Часто инфекционно-токсический синдом является началом острой кишечной инфекции, длится от нескольких часов до суток, реже дольше.
- Кишечного синдрома. Проявления кишечного синдрома могут быть разными, но есть схожесть симптоматики. Этот синдром может проявляться в виде синдрома гастрита, гастроэнтерита, энтерита, гастроэнтероколита, энтероколита, колита.
Синдром гастрита характеризуется появлением болей в области желудка (эпигастрии), постоянной тошноты, рвоты после приема пищи и питья воды, причем ее может вызвать даже глоток жидкости. Рвота может быть многократной, приносящей недолговременное облегчение. Возможно разжижение стула и в течение короткого промежутка времени, иногда однократно.
Синдром гастроэнтерита сопровождается болями в животе в области желудка и околопупочной области, рвотой, появлением частого стула сначала кашицеобразного характера, а затем с водянистым компонентом. В зависимости от причины возникновения в стуле может меняться цвет (зеленоватый при сальмонеллезе, светло-коричневый при эшерихиозе, к примеру), а также появляться слизь, непереваренные остатки пищи.
Синдром энтерита характеризуется появлением только нарушений стула в виде частого водянистого стула. Частота зависит от вида возбудителя и степени инфицирующей дозы его, попавшей к конкретному больному.
Синдром гастроэнтероколита проявляется и рвотой, и частым жидким стулом, боли в животе становятся разлитого характера и практически постоянными, акты дефекации становятся болезненными, не приносящими облегчения, нередко примеси крови и слизи в стуле. Некоторые акты дефекации со скудным слизистым отделяемым.
Синдром энтероколита характеризуется только выраженным болевым синдромом по всему периметру живота, частым стулом вперемешку со скудным отделяемым.
Синдром колита проявляется боями в нижних отделах живота, преимущественно слева, акты дефекации болезненные, содержимое скудное с примесью слизи и крови, ложные позывы на стул, отсутствие облегчения в конце дефекации.
Такие синдромы как гастроэнтерит, гастроэнтероколит и энтероколит характерны для сальмонеллеза, энтероколит и колит – для дизентерии, эшерихиозы сопровождаются развитием гастроэнтерита, энтерит – ведущий синдром холеры, синдром гастрита может сопровождать пищевое отравление, однако это может быть и гастроэнтерит, вирусные кишечные инфекции протекают чаще в виде гастроэнтеритов.
Осложнения острых кишечных инфекций
- Дегидратация (обезвоживание) – патологическая потеря воды и солей неестественным путем (рвота, жидкий стул). Выделяют 4 степени обезвоженности у взрослых: - 1 степень (компенсированная) – потеря массы тела до 3% от исходной; 2 степень (переходная) – потеря массы тела 4-6% от исходной; 3 степень (субкомпенсированная) – 7-9% от исходной; 4 степень (декмпенчированная) – более 10% потери массы тела от исходной. Помимо снижения веса беспокоит сухость кожи и слизистых, жажда, снижение эластичности кожи, нарушения гемодинамики (учащение пульса, снижение АД).
- Одно из проявлений молниеносной дегидратации: дегидратационный шок с возможным летальным исходом. Имеет место глубокое обезвоживание и расстройства гемодинамики (критическое падение артериального давления).
- Инфекционно-токсический шок: возникает на фоне высокой температуры, чаще в начале болезни и сопровождается высокой токсинемией (высокой концентрацией токсинов бактерий в крови), серьезными нарушениями гемодинамики и возможным летальным исходом.
- Пневмония (воспаление легких).
- Острая почечная недостаточность.
Не секрет, что появление частого жидкого стула для большинства людей – не повод для обращения к врачу. Большинство стараются различными препаратами и методами остановить диарею и восстановить нарушенное состояние здоровья. Вместе с тем, простая (как кажется на первый взгляд) кишечная инфекция может обернуться серьезной проблемой с длительной потерей трудоспособности.
Симптомы, с которыми нужно обратиться к врачу незамедлительно:
- ранний детский возраст (до 3х лет) и дошкольный возраст ребенка;
- лица преклонного возраста (старше 65 лет);
- частый жидкий стул более 5 раз в сутки у взрослого;
- многократная рвота;
- высокая лихорадка с диареей и рвотой;
- кровь в стуле;
- схваткообразные боли в животе любой локализации;
- выраженная слабость и жажда;
- наличие хронических сопутствующих болезней.
Что нельзя категорически делать при подозрении на острую кишечную инфекцию:
Если появился частый жидкий стул, сопровождаемой болями в животе и температурой, то:
- Нельзя применять болеутоляющие лекарственные средства. В случае скрытых симптомов какой-либо хирургической патологии (холецистит, аппендицит, кишечная непроходимость и другие) снятие болевого синдрома может затруднить постановку диагноза и отложить оказание своевременной специализированной помощи.
- Нельзя самостоятельно применять закрепляющие средства (вяжущие) – такие как иммодиум или лоперамид, лопедиум и другие. При острой кишечной инфекции основная масса токсинов возбудителей концентрируется в кишечнике, и применение таких препаратов способствует их накоплению, что усугубит состояние пациента. Течение кишечной инфекции будет благоприятным при своевременном опорожнении содержимого кишечника вместе с токсинами патогенов.
- Нельзя делать самостоятельно клизмы, особенно с горячей водой.
- Нельзя применять греющие процедуры на живот (грелка с горячей водой, например), что безусловно способствует усилению воспалительного процесса, что усугубит состояние пациента.
- При наличии симптомов острой кишечной инфекции и подозрении на хирургическую патологию нельзя медлить и пытаться лечить подручными средствами (народные, гомеопатические и другие). Последствия промедления с обращением за медицинской помощью могут быть очень печальными.
Профилактика острой кишечной инфекции сводится к следующим мероприятиям:
Что такое пиелонефрит острый? Причины возникновения, диагностику и методы лечения разберем в статье доктора Закуцкий А. Н., уролога со стажем в 16 лет.
Над статьей доктора Закуцкий А. Н. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
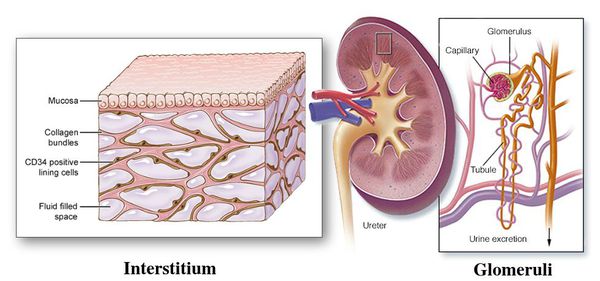
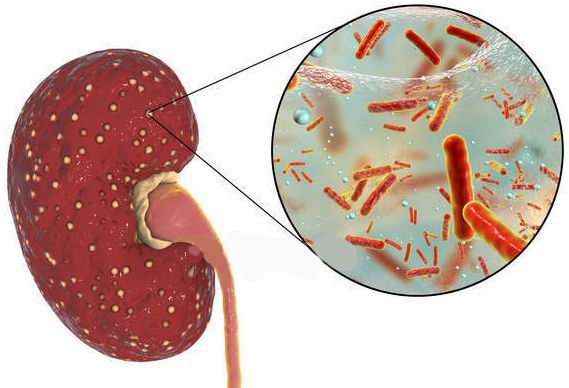
Причина пиелонефрита — бактериальная инфекция. Среди возбудителей заболевания лидирует кишечная палочка (Escherichia coli). Реже встречаются другие микробы, такие как протей, энтерококк, синегнойная палочка и стафилококк. [4]
Острый пиелонефрит может возникнуть в любом возрасте и у любого пола. Чаще всего заболевание возникает у женщин активного репродуктивного возраста, что объясняется особенностями строения женской мочеполовой системы. Однако нередко пиелонефрит выявляют у детей и половозрелых мужчин, поэтому возраст и пол заболевавшего не могут быть использованы в качестве дифференциального признака данного заболевания.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы острого пиелонефрита
Для острого пиелонефрита типично сочетание высокой температуры с болями в области воспалённой почки. Если почка располагается на своём месте, то боль беспокоит в проекции рёберно-позвоночного угла. При опущении почки боль возникает по фланкам живота. Пиелонефрит может затрагивать как одну почку, так и обе почки, соответственно боль может беспокоить как с одной стороны, так и с обеих сторон одновременно.
Выраженность боли может быть различной — от умеренной до интенсивной. Как правило, боль носит постоянный характер и не зависит от положения тела или движений. Иными словами, невозможно найти такое положение в кровати, когда боль будет беспокоить меньше или пройдет совсем. Также верно и то, что движения туловищем в виде сгибания, разгибания или поворотов не приводят к обострению болей.
В отдельных случаях боль носит приступообразный характер. Это характерно для пиелонефритов, которые возникают на фоне закупорки мочевых путей камнем. Если при классической почечной колике боль между приступами отступает совсем, то при сопутствующем пиелонефрите болевой синдром сохраняется и между приступами.
Развитие острого пиелонефрита может сопровождаться изменения со стороны мочеиспускания, хотя это не является обязательным условием. Можно отметить появление мути в моче и неприятного запаха. Кроме того, воспалённая моча потенциально способна спровоцировать учащённое мочеиспускание. В целом мочевые симптомы выходят на первый план только в том случае, если острый пиелонефрит осложняет уже имеющееся воспаление мочевого пузыря. [1] [4]
Патогенез острого пиелонефрита
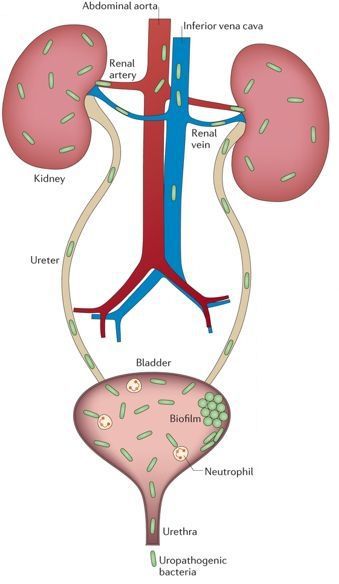
Уриногенный путь передачи особенно характерен для детей из-за широкого распространения пузырно-мочеточникового рефлюкса. Так называют заброс мочи из мочевого пузыря обратно в почку. Несмотря на широкое распространение рефлюкса именно в детском возрасте, многие взрослые страдают аналогичным заболеванием. Особенно часто рефлюкс, то есть обратный заброс мочи, наблюдается при переполнении мочевого пузыря. Поэтому очень важно своевременно опорожнять мочевой пузырь. [8]
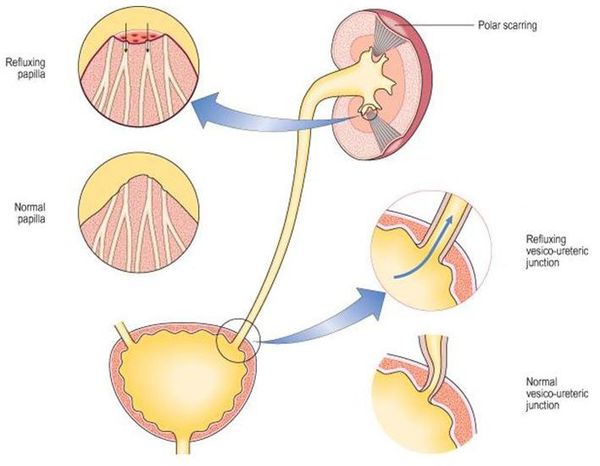
Классификация и стадии развития острого пиелонефрита
Традиционно острый пиелонефрит подразделяют на серозный и гнойный, хотя гнойный пиелонефрит является скорее осложнением острого пиелонефрита.
Существует несколько форм гнойного пиелонефрита:
- апостематозный пиелонефрит;
- абсцесс почки;
- карбункул почки;
- некротический папиллит;
- эмфизематозный пиелонефрит.
Если гнойников много, и они небольшие по размеру, то говорят об апостематозном пиелонефрите. В том случае, если гнойник большой и одиночный, то мы имеем дело с абсцессом почки.
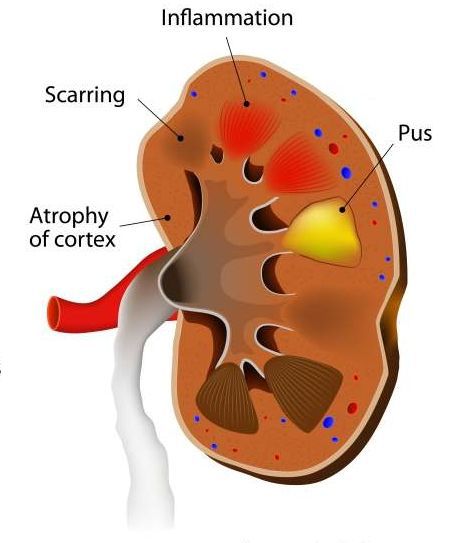
Почечный абсцесс нужно дифференцировать с карбункулом почки. Карбункул — это часть почечной паренхимы, погибшая вследствие закупорки крупного почечного сосуда микробным эмболом. Рано или поздно погибшие от эмболии ткани подвергаются гнойному расплавлению, что приводит к абсцедированию карбункула.
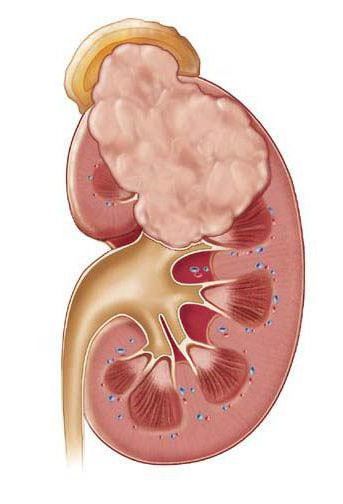
Особой формой острого пиелонефрита является некротический папиллит — это грозное и смертельно опасное заболевание. К счастью, эта болезнь встречается настолько редко, что даже опытные урологи со стажем работы в несколько десятков лет могут вспомнить лишь несколько случаев данной формы острого пиелонефрита. При некротической папиллите происходит некроз, то есть омертвление и гибель почечного сосочка. Это сопровождается почечной недостаточностью и появлением крови в моче. Причина некротического папиллита сходна с причиной карбункула: закупорка почечного сосуда микробным эмболом. Только при папиллите страдает сосуд, питающий почечный сосочек. [4]
Осложнения острого пиелонефрита
Местные осложнения острого пиелонефрита включают апостематоз, абсцесс почки, эмфизематозный пиелонефрит, а также тромбоз почечных сосудов либо в виде карбункула почки, либо в виде некротизирующего папиллита. [10]
Эмфизематозный пиелонефрит является исключительно редким заболеванием и отличается от прочих гнойных осложнений пиелонефрита появлением пузырьков газа. Воздушные скопления могут быть в почечной паренхиме, полостной системе почек или даже в паранефральной клетчатке. К счастью, эмфизематозный пиелонефрит встречаются существенно реже других гнойных осложнений почки. [7]
Среди системных осложнений нужно отметить острую почечную недостаточность и синдром системной воспалительной реакции (сепсис). Именно поэтому часть пациентов нуждается в госпитализации в урологические стационары. В условиях стационара проводится регулярный контроль анализов и УЗИ для своевременного выявления осложнений острого пиелонефрита. [4]
Некоторые осложнения пиелонефрита в большей степени ассоциированы с хронической формой этого заболевания, но так как острый пиелонефрит может перейти в хронический, то нельзя не упомянуть о таком важном осложнении как мочекаменная болезнь. В некоторых ситуациях воспаление почечной паренхимы вызывают уреаза-продуцирующие микробы. Уреаза — это фермент, который позволяет бактериям расщеплять мочевину из мочи. После срабатывания фермента мочевина расщепляется до углекислоты и аммиака. Именно эти два компонента запускают сложный биохимический каскад, который приводит к образованию инфекционных камней: струвита и гидроксиапатита. К счастью, самый частый возбудитель пиелонефрита — кишечная палочка — не умеет производить уреазу, этой способностью обладают другие более редкие возбудители пиелонефрита — протей, клебсиелла и синегнойная палочка.
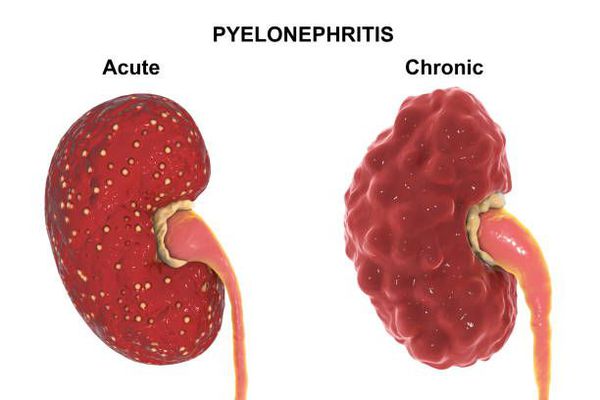
Диагностика острого пиелонефрита
Минимальный объём обследований:
- общий анализ мочи;
- посев мочи на флору с определением чувствительности к антибиотикам;
- клинический анализ крови;
- анализ крови на креатинин;
- УЗИ почек и мочевого пузыря.
Общий анализ мочи
Типичным для пиелонефрита является повышение уровня лейкоцитов и обнаружение бактерий. Могут быть и другие неспецифичные для данного заболевания изменения, включая повышенный уровень белка или положительный тест на нитриты. Обнаружение большого количества эритроцитов требует проведения дифференциальной диагностики с мочекаменной болезнью и гломерулонефритом.
Посев мочи на флору и чувствительность к антибиотикам
Этот анализ имеет смысл сдавать до назначения антибиотиков. Посев мочи позволяет выявить возбудитель пиелонефрита и определить наиболее эффективные антибактериальные препараты.
Клинический анализ крови
Неспецифическим признаком пиелонефрита является повышенный уровень лейкоцитов со сдвигом лейкоцитарной формулы влево. Как правило, больной с острым пиелонефритом повторяет клинический анализ крови два или три раза во время лечения. Данный анализ позволяет оценить эффективность антибактериальной терапии и своевременно сигнализировать о развитии гнойных осложнений в воспаленной почке.
Анализ крови на креатинин
Этот анализ является обязательным для всех пациентов с пиелонефритом прежде всего потому, что в ряде случаев острый пиелонефрит может осложниться развитием острой почечной недостаточности. Кроме того, анализ крови на креатинин необходим для решения вопроса о рентгенологическом исследовании почек с применением контраста.
УЗИ почек и мочевого пузыря
Ультразвуковое исследование позволяет исключить обструктивный пиелонефрит, связанный с нарушением оттока мочи из почки. Кроме того, УЗИ почек необходимо для своевременного выявления апостематоза, абсцесса и карбункула в паренхиме почки. Все вышеперечисленные термины используются для описания осложнений острого пиелонефрита.
Важнейшим преимуществом ультразвукового исследования является возможность повторения этого исследования в динамике без нанесения какого-либо вреда или даже дискомфорта организму. Важно помнить, что нормальные результаты УЗИ не исключают наличие острого пиелонефрита.
Рентгеновское обследование почек: внутривенная урография или компьютерная томография почек с внутривенным контрастированием.
Рентгеновское обследование почек является самым точным и достоверным методом диагностики. Традиционный рентген в виде внутривенной урографии подразумевает обязательное внутривенное введение йодсодержащего контраста. Это не всегда возможно из-за сопутствующих причин: аллергия на йод, приём гормонов щитовидной железы и повышенный уровень креатинина в крови. По сути, в настоящее время внутривенная урография необходима только для установления степени нефроптоза при опущении почек.
Значительно более широко применяется КТ почек (компьютерная томография). КТ относится к рентгеновским методам исследования, однако его информативность значительно выше, чем у обычного рентгена. Вопрос о введении йодсодержащего внутривенного контраста решается лечащим урологом индивидуально с каждым пациентом. [2] [4]
Лечение острого пиелонефрита
Стационарное лечение обычно требуется для беременных, детей, пожилых людей, пациентов с ослабленным иммунитетом, плохо контролируемым диабетом, после трансплантации почек и, конечно же, всех людей с обструкцией мочевых путей. Также желательно госпитализировать людей с острым пиелонефритом единственной существующей или единственно функционирующей почки. Здоровые, молодые, небеременные женщины, которые болеют неосложнённым пиелонефритом, могут лечиться амбулаторно.
Обычно острый пиелонефрит требует исключительно медикаментозного лечения. Показания к хирургическому лечению возникают крайне редко.
Первоначальный выбор антибиотика при остром пиелонефрите является эмпирическим. Через 4-7 дней антибактериальная терапия может быть скорректирована по результатам посева мочи. Эмпирический выбор антибиотика остаётся на усмотрение лечащего врача.
В национальных рекомендациях в качестве средства выбора при остром пиелонефрите указаны фторхинолоны второго и третьего поколения. [4] Тоже самое сказано и в рекомендациях Европейской ассоциации урологов. Между тем, ещё в 2016 году FDA (Управление по контролю качества пищевых продуктов и лекарственных препаратов) рекомендовала отказаться от использования данных антибиотиков из-за большого количества осложнений в отношении связок, суставов и периферических нервов. [6] Поэтому в качестве первой линии терапии рекомендуют использовать цефалоспорины третьего поколения.
Часто можно встретить комбинацию из двух антибиотиков для лечения острого пиелонефрита. Как правило, комбинируют цефалоспорины с фторхинолонами или аминогликозидами. Аминогликозиды в виде амикацина обладают явным нефротоксическим действием, поэтому их использование для эмпирической терапии оправдано только в тяжёлых случаях. В целом выбор антибиотика — на усмотрение лечащего врача. [9]
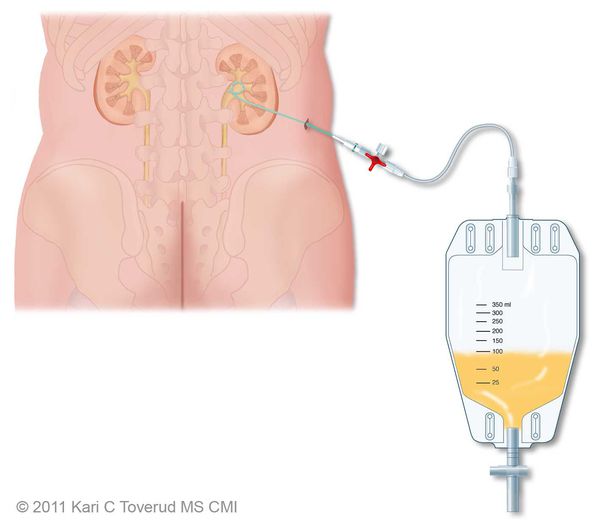
Показания к оперативному лечению возникают при гнойной форме воспаления и остром вторичном пиелонефрите. При вторичном пиелонефрите главная цель хирургического вмешательства состоит в дренировании мочи. Это можно сделать как путём установки почечного стента, так и благодаря чрезкожной пункционной нефростомии.
Гнойная форма острого пиелонефрита требует ревизии и декапсуляции почки, вскрытия гнойных очагов или даже нефрэктомии при гнойном разрушении большей части почки. [4]
Прогноз. Профилактика
Прогноз при пиелонефрите благоприятный. Большинство острых пиелонефритов успешно лечатся амбулаторно, и лишь небольшая доля случаев требует госпитализации. Тем не менее сохраняется определённый процент летальный исходов. Причиной неблагоприятного течения заболевания являются возраст старше 65 лет, присоединение острой почечной недостаточности, несвоевременно выявленные гнойные осложнения, требующие хирургического вмешательства, и тяжёлые сопутствующие заболевания наподобие декомпенсированного сахарного диабета. [5]
Составление плана индивидуальной профилактики начинается с изучения истории конкретного заболевания. В частности, необходимо ответить на вопрос, каким образом бактерии попали в почку: с кровью или с мочой? При гематогенном пути заражения необходимо санировать имеющиеся в организме очаги хронической инфекции, исключить переохлаждение и проводить профилактику сезонных простудных заболеваний. При уриногенном пути заражения необходимо заняться профилактикой воспалительных заболеваний мочевого пузыря.
В случае вторичной формы острого пиелонефрита целесообразно восстановить нормальный отток мочи из поражённой почки.
Вне зависимости от пути попадания микробов в почку всем пациентам рекомендуется потреблять достаточное количество жидкости и разнообразные урологические сборы растительного происхождения. [4]
Читайте также:

