Сепсис при циррозе печени
Обновлено: 13.05.2024
Для цитирования: Сандлер Ю.Г., Винницкая Е.В., Хайменова Т.Ю., Бордин Д.С. Клинические аспекты повреждения печени при COVID-19 // Эффективная фармакотерапия. 2020. Т. 16. № 15. С. 18–23.
- Аннотация
- Статья
- Ссылки
- Английский вариант
SARS-CoV-2 – COVID-19 представляет серьезную угрозу для мирового общественного здравоохранения. В настоящее время COVID-19 рассматривается как системное заболевание с нарушением функции иммунной системы, поражением в первую очередь легких, а также сердца, почек, кишечника, печени и селезенки. Повреждение печени происходит в основном при тяжелом течении COVID-19. Сегодня не до конца понятно, относятся ли изменения лабораторных показателей печени у пациентов с COVID-19 к диагностированным ранее заболеваниям печени, или они отражают повреждение печени при COVID-19. В статье приведены работы, посвященные изучению поражений печени в период заболевания COVID-19 у пациентов без предшествующей патологии или с уже существующей патологией печени. Проанализированы и обобщены потенциальные механизмы поражения печени, обусловленного вирусом SARS-CoV-2, что расширяет наши знания о COVID-19.
- КЛЮЧЕВЫЕ СЛОВА: SARS‐CoV‐2, COVID-19, печень, дисфункция, сердечно-сосудистые заболевания, гипертензия, болезнь Крона, язвенный колит
SARS-CoV-2 – COVID-19 представляет серьезную угрозу для мирового общественного здравоохранения. В настоящее время COVID-19 рассматривается как системное заболевание с нарушением функции иммунной системы, поражением в первую очередь легких, а также сердца, почек, кишечника, печени и селезенки. Повреждение печени происходит в основном при тяжелом течении COVID-19. Сегодня не до конца понятно, относятся ли изменения лабораторных показателей печени у пациентов с COVID-19 к диагностированным ранее заболеваниям печени, или они отражают повреждение печени при COVID-19. В статье приведены работы, посвященные изучению поражений печени в период заболевания COVID-19 у пациентов без предшествующей патологии или с уже существующей патологией печени. Проанализированы и обобщены потенциальные механизмы поражения печени, обусловленного вирусом SARS-CoV-2, что расширяет наши знания о COVID-19.
В настоящее время COVID-19 рассматривается как системное заболевание с нарушением функции иммунной системы, поражением в первую очередь легких, а также сердца, почек, кишечника. Тяжелые формы заболевания сопровождаются гипериммунным воспалением, дисбалансом ренин-ангиотензин-альдостероновой системы, развитием эндотелиальной дисфункции и особых форм васкулопатий (тромботическая микроангиопатия и внутрисосудистая коагулопатия). Это состояние, по мнению ряда экспертов, следует именовать тромбовоспалительным процессом, или COVID-19-ассоциированной коагулопатией [1, 2].
- легкая (без пневмонии или легкая пневмония) – 81% случаев;
- тяжелая (например, одышка, гипоксия или > 50% поражения легких при визуализации в течение 24–48 часов) – 14%;
- крайне тяжелая (с развитием острого респираторного синдрома, дыхательной недостаточности или полиорганной дисфункции) – 5%.
Общий коэффициент летальности составил 2,3%; в некритических ситуациях летальные исходы не зафиксированы [4].
К факторам риска развития тяжелого течения COVID-19 относятся преимущественно возраст (старше 65 лет) и коморбидные состояния [3]:
- сердечно-сосудистые заболевания, прежде всего артериальная гипертензия;
- сахарный диабет;
- хроническая болезнь легких;
- рак (в частности, гематологические злокачественные новообразования, рак легкого и метастазирование);
- хроническое заболевание почек;
- ожирение;
- курение;
- иммунодефицитные состояния;
- хронические заболевания печени [5].
Вероятно, у некоторых пациентов с хроническими заболеваниями желудочно-кишечного тракта (ЖКТ) (болезнь Крона, язвенный колит) или печени (цирроз печени) могут наблюдаться повышенный риск возникновения COVID-19 и более тяжелые формы заболеваний [6].
Восприимчивость ЖКТ к инфекции SARS-CoV-2 может быть обусловлена наличием рецепторов ангиотензинпревращающего фермента 2 (АПФ2) в кишечнике. Как известно, АПФ2 является рецептором вируса SARS-CoV-2. Пищеварительные симптомы, связанные с инфекцией SARS-CoV-2, могут быть вызваны прямой вирусной атакой, а также повреждением тканей и органов вследствие иммунного ответа [7]. Вирусный нуклеокапсидный белок был обнаружен в цитоплазме эпителиальных клеток желудка, двенадцатиперстной и прямой кишок. Понимание патогенеза заболеваний органов пищеварения, связанных с вирусом SARS-CoV-2, расширяется, но его влияние на существующие хронические заболевания ЖКТ остается неясным.
Частота повреждений печени у пациентов с COVID-19, по данным различных исследований, варьируется от 14 до 53% [8].
Рассматривается несколько возможных механизмов повреждающего воздействия коронавирусной инфекции на печень [9–13].
Прямое воздействие SARS-CoV-2 на печень
Механизмы прямого воздействия вируса SARS-CoV-2 на печень (прямая цитотоксичность вследствие активной репликации вируса в клетках печени) недостаточно изучены. В более ранних исследованиях, связанных с инфицированием коронавирусами рода Betacoronavirus (SARS-CoV (2002–2003 гг.) и MERS-CoV (2012 г.)), повреждение печени встречалось достаточно часто и ассоциировалось с тяжестью заболевания [14, 15].
Как известно, SARS-CoV, равно как и SARS-CoV-2, используют АПФ2 в качестве рецепторов для внедрения в клетку, которые широко распространены в клетках сердца, почек, кровеносных сосудов, особенно альвеолярных эпителиальных клетках, а также печени, поджелудочной железы, эпителия кишки, что обеспечивает системность повреждения [16].
Однако не до конца ясно, может ли повреждение печени вызываться непосредственно коронавирусом SARS-CoV-2. Предыдущие данные по секвенированию RNA-seq в базе данных атласа белка человека подтверждают экспрессию АПФ2 в печени SARS-CoV [17]. При этом низкая частота экспрессии АПФ2 наблюдается только в холангиоцитах, но не в гепатоцитах, клетках Купфера или эндотелиальных клетках. Кроме того, SARS-CoV через специфический белок 7a способен индуцировать апоптоз в клеточных линиях различных органов (включая легкие, почки, печень) каспазозависимым путем. Это свидетельствует о возможности непосредственного воздействия SARS-CoV на ткань печени.
Экспрессия АПФ2 в ткани печени в отношении нового коронавируса проанализирована на основании данных секвенирования РНК. Объективная оценка специфической экспрессии АПФ2 в здоровой ткани печени на основании данных RNA-seq двух независимых когорт позволила идентифицировать специфическую экспрессию АПФ2 на холангиоцитах и минимально в гепатоцитах. Результаты показали, что вирус способен напрямую связываться через АПФ2 с холангиоцитами, но не обязательно с гепатоцитами [16]. Уровень экспрессии АПФ2 в клетках желчных протоков значительно выше, чем в гепатоцитах, но сопоставим с уровнем в альвеолярных клетках 2-го типа в легких, что делает печень потенциальной мишенью для вируса [16].
Исходя из этих данных, можно предположить, что нарушения в биохимических показателях печени у пациентов с COVID-19 связаны не с повреждением гепатоцитов, а с дисфункцией холангиоцитов и другими причинами, такими как лекарственная гепатотоксичность и системная воспалительная реакция, вызывающими повреждение печени.
Метод RNA-Seq также использовали для анализа экспрессии АПФ2 и факторов транскрипции, связанных с его экспрессией в тканях печени в различные периоды после гепатэктомии на мышиной модели острого повреждения печени с частичной гепатэктомией [18]. Экспериментальные результаты продемонстрировали, что повышенная регуляция экспрессии АПФ2 при остром повреждении печени может быть вызвана компенсаторной пролиферацией гепатоцитов. При этом, как правило, у пациентов с COVID-19 повышаются в основном уровни аминотрансфераз, но не щелочной фосфатазы [19].
При аутопсии пациентов с SARS-CoV методом ОТ-ПЦР геном SARS-CoV был обнаружен не только в легких, но также в паренхиматозных клетках, в том числе гепатоцитах, эндотелии сосудов различных органов. При биопсии печени у пациентов с атипичной пневмонией с SARS-CoV выявлены выраженные митозы, ацидофильные тела, клетки Купфера, баллоноподобные гепатоциты. Это позволило предположить, что SARS-CoV индуцирует апоптоз клеток печени и тем самым способствует ее повреждению [14].
Результаты посмертных биопсий у пациентов с COVID-19 показали умеренный микровезикулярный стеатоз, умеренную лобулярную и портальную активность. Это говорит о том, что повреждение могло быть вызвано инфекцией SARS-CoV-2, но не позволяет исключить и лекарственное повреждение печени, а также развитие гипоксических состояний. Результаты аутопсии печени включают гепатомегалию, дегенерацию гепатоцитов, очаговый некроз, нейтрофильную, лимфоцитарную и моноцитарную инфильтрацию, синусоидальную дилатацию, застой и микротромбозы. Однако гистологических признаков повреждения печени, приводящих к печеночной недостаточности, повреждений желчных протоков не наблюдалось [20–22].
Иммуноопосредованное повреждение печени
Иммуноопосредованное повреждение печени может быть связано с синдромом активации макрофагов, в контексте гипервоспалительного синдрома, характеризуемого цитокиновым штормом COVID-19-ассоциированной коагулопатии и полиорганной недостаточности в рамках тяжелого и крайне тяжелого течения COVID-19 [23–25].
Нередко системные вирусные инфекции сопровождаются транзиторным повышением трансаминаз, что отражает общую иммунную активацию, гипериммунное воспаление на фоне циркулирующих цитокинов в отсутствие нарушения функции печени. Этот феномен называется bystander hepatitis [26].
Более высокая частота повреждений печени отмечается у тяжелых пациентов с инфекцией SARS-CoV2. Крайне тяжелый COVID-19 служит независимым фактором риска повреждения печени. В случаях COVID-19 с летальным исходом частота поражений печени может достигать 58,1–78% [20].
Цитокиновый шторм характеризуется синтезом значительного количества биомаркеров воспаления, в частности С-реактивного белка, сывороточного ферритина, лактатдегидрогеназы, D-димера, интерлейкинов 1-бета, 6, 2, фактора некроза опухоли альфа, хемокинов, и сопровождается снижением содержания Т-лимфоцитов в крови [23, 27].
Недавние исследования показали, что инфекция SARS-CoV-2 может в первую очередь поражать Т-лимфоциты, особенно CD4+ и CD8+ Т-клетки, которые активно вовлекаются в патологический процесс COVID-19 [28].
Синдром системной воспалительной реакции и сепсис – явления не редкие при крайне тяжелом течении COVID-19. Известно, что сепсис определяется как нерегулируемый иммунный ответ на инфекцию, которая приводит к полиорганной дисфункции [30].
При сепсисе печень играет важную роль в иммунной защите и метаболической адаптации к воспалению. При этом печень служит мишенью для сепсис-индуцированной полиорганной недостаточности. Патофизиология связанных с сепсисом повреждений печени включает гипоксическое повреждение из-за ишемии и шока, холестаз из-за изменения метаболизма желчи, гепатоцеллюлярное повреждение из-за лекарственной токсичности [31]. Следовательно, сепсис у пациентов с COVID-19 может быть одной из причин поражения печени и существенно ухудшает прогноз COVID-19.
Тяжелая гипоксия (аноксия)
Отличительной чертой COVID-19 является дыхательная недостаточность. Поэтому гипоксический гепатит из-за аноксии часто встречается в тяжелых случаях. Тяжелая гипоксия, аноксия, гиповолемия считаются основной причиной ишемического/гипоксического повреждения печени в случаях COVID-19 с острой легочной недостаточностью и/или шоком. Данное повреждение печени связано с метаболическим ацидозом, перегрузкой кальцием и изменениями проницаемости митохондриальной мембраны и обычно проявляется высоким цитолизом [32].
Кроме того, предполагают, что неструктурные белки SARS-CoV-2 видоизменяют структуру гемоглобина в эритроците, что приводит к нарушению транспорта кислорода, диссоциации железа, образованию порфирина, повышению уровня ферритина. Такое воздействие может привести к усилению воспалительных процессов в легких, развитию окислительного стресса, гипоксемии, гипоксии, симптомов острого респираторного дистресс-синдрома и полиорганной кислородной недостаточности [33].
Лекарственное повреждение печени
Наиболее частая причина развития повреждений печени при COVID-19 ассоциируется с лекарственно-индуцированными повреждениями печени, которые являются следствием применения этиотропного лечения инфекции SARS-CoV-2 и патогенетической терапии COVID-19 [19, 20].
В период пандемии в первоначальных клинических руководствах рекомендовались препараты для лечения SARS-Cov-2-инфекции, причем некоторые из них, в том числе лопинавир/ритонавир, гидроксихлорохин, азитромицин, умифеновир, фамипиравир, рекомбинантный интерферон бета-1b, обладают потенциальной гепатотоксичностью [26].
Гепатотоксичность гидроксихлорохина описана в единичных клинических наблюдениях при лечении больных системной красной волчанкой, поздней кожной порфирией, ревматоидным артритом, малярией. По данным регистра LiverTox, гидроксихлорохин относится к категории С и, вероятно, способен вызывать идиосинкразическое поражение печени [34].
Лопинавир/ритонавир – антиретровирусный препарат с известным и хорошо изученным межлекарственным взаимодействием с препаратами иммуносупрессивного действия. Его не следует назначать одновременно с ингибиторами mTOR (сиролимус, эверолимус). При одновременном использовании с ингибиторами кальциневрина (циклоспорин, такролимус) необходимо тщательно контролировать концентрацию лопинавира/ритонавира. Имеются данные о применении препарата у пациентов с циррозом печени. Риск гепатотоксичности низкий у пациентов с хроническими заболеваниями печени (ХЗП). Не рекомендуется применение у пациентов с декомпенсированным циррозом печени. По данным регистра LiverTox, лопинавир – категория D, ритонавир – категория C [26, 34].
Вероятно, помимо прямой лекарственной гепатотоксичности следует отдельно выделить возможность развития идиосинкразического (иммуноопосредованного) повреждения печени, наиболее частой причиной которого являются антибиотики [35].
Следует помнить о межлекарственном взаимодействии у коморбидных пациентов и чаще пользоваться Ливерпульской базой данных по применению препаратов, которые могут использоваться при лечении COVID-19 [36].
Соответственно все пациенты, получающие этиотропную и патогенетическую терапию по поводу COVID-19, нуждаются в мониторировании печеночных показателей для предотвращения тяжелого лекарственного гепатита на этапе как стационарного лечения, так и последующего амбулаторного наблюдения.
Реактивация ранее существовавшего заболевания печени
С учетом высокого бремени ХЗП в мире: неалкогольная жировая болезнь печени (НАЖБП) в рамках метаболического синдрома (сахарный диабет, ожирение), цирроз печени в исходе хронических вирусных гепатитов B, C – данные заболевания могут быть основными причинами повреждения печени у пациентов с COVID-19. Не исключено, что пациенты с ХЗП более восприимчивы к повреждению печени от SARS-CoV-2. Однако в настоящее время сведения о наличии прямого влияния ранее существовавшего заболевания печени на течение COVID-19 и наоборот ограниченны. В ряде исследований у 2–11% пациентов с COVID-19 имели место ХЗП [8, 13].
Пациенты с ХЗП могут быть более уязвимы к тяжелым клиническим последствиям COVID-19, включая гипоксию и гипоксемию из-за тяжелой пневмонии или цитокиновго шторма [28, 29, 37].
Следует отметить, что все пациенты с уже установленным циррозом печени (ЦП) по любой причине декомпенсации подвержены высокому риску заболеваемости и смертности независимо от вирусной эпидемии. Пациенты с ЦП могут быть более восприимчивы к инфекциям из-за системного иммунодефицита, поэтому предотвращение инфицирования SARS-CoV-2 имеет первостепенное значение. Так, Y. Xiao и соавт. отмечали декомпенсацию ЦП у 17% больных COVID-19, не соблюдавших профилактические мероприятия [38].
До настоящего времени не получено однозначных данных относительно возникновения печеночной недостаточности у пациентов с хроническим гепатитом B (ХГВ) или C (ХГС) на фоне SARS-CoV-2. Пациенты с атипичной пневмонией (SARS-CoV-инфекция 2002 г.), имевшие ХГВ или ХГС, были более склонны к развитию повреждения печени и тяжелого гепатита, что, вероятно, связано с усилением репликации вируса гепатита во время инфекции SARS-CoV [39].
Скорее всего ни ХГВ, ни ХГС не увеличивают риск тяжелого течения COVID-19 [19]. Так, ХГВ, распространенность которого в Китае выше, чем в Европе, по-видимому, не влияет на исход COVID-19.
Не следует забывать, что биологические препараты, которые могут использоваться в патогенетической терапии COVID-19, такие как тоцилизумаб, сарилумаб, способны также вызывать реактивацию скрыто протекающего гепатита B или E, а следовательно, ухудшать функцию печени.
Достоверных данных о том, что пациенты с аутоиммунными заболеваниями печени (АИЗП) имеют более высокий риск инфицирования или развития тяжелого течения COVID-19, не получено. Как показывает предварительный опыт (Бергамо, Ломбардия), пациенты со стабильным течением АИЗП при длительной поддерживающей иммуносупрессивной терапии имеют низкий риск осложнений и/или прогрессирования [40]. Однако не исключено, что обострение аутоиммунного гепатита может потребовать более высокой дозы ГКС, а следовательно, потенциально увеличит риск инфекции.
Что касается холестатических повреждений печени, пока не доказано, что инфекция SARS-CoV-2 обостряет холестаз [13].
1. Cuker A., Peyvandi F. Coronavirus disease 2019 (COVID-19): Hypercoagulability. Literature review, 2020.
Е.Г. Быкова (1), А.Л. Петров (2)
1) Северо-Западный государственный медицинский университет им. И.И. Мечникова, Санкт-Петербург, Россия; 2) Городская многопрофильная больница № 2, Санкт-Петербург, Россия
Введение
Несмотря на успехи, связанные с лечением септических пациентов, уровень летальности среди них остается высоким, а средняя продолжительность пребывания в стационаре по меньшей мере в 3 раза превышает таковую для несептических больных [1, 2]. Причем при латентном течении сепсиса летальность в 1,5 раза выше (52–56%), чем при клинически очевидных проявлениях синдрома (34,7–36,9%) [3]. Особенности развития и трудности диагностики септического процесса обусловлены сложностью своевременного распознавания перехода локального инфекционного процесса в генерализованный, в ряде случаев (до 21%) установить очаг так и не удается, что еще в большей степени усложняет диагностику. Полиморфизм клинических проявлений сепсиса зависит от источника инфекции (абдоминальный, респираторный, ангиогенный, мочевой, ожоговый и т.д.), вирулентности микроорганизмов и состояния макроорганизма [4, 5]. Клинический и биологический фенотипы сепсиса могут видоизменяться под воздействием предшествовавших острых и хронических заболеваний, медикаментозного лечения и интервенционных вмешательств [6–8].
На 3-м Международном консенсусе определений сепсиса и септического шока в 2016 г. были пересмотрены некоторые термины и критерии диагноза [9, 10]. Согласно современным представлениям, сепсис определяется как жизнеугрожаемая острая органная дисфункция, возникающая в результате нарушения регуляции ответа макроорганизма на инфекцию. То есть развитие сепсиса обусловлено не прямым цитоповреждающим эффектом микроорганизма и/или их токсинов, а особенностями активации эндогенного ответа на инфекционный агент с повреждением собственных тканей в результате прогрессирующего воспаления [8]. Именно поэтому важным фактором риска септического процесса служит отягощенный преморбидный фон: злокачественные новообразования, сахарный диабет, хроническая болезнь почек, цирроз печени, конкурентные повреждения (включая хирургию), агрессивная медикаментозная терапия. Инфекция служит пусковым механизмом, а отягощенный преморбидный фон повышает восприимчивость организма к инфекции, извращая ответ на нее, значимо ухудшая течение и прогноз заболевания. Тяжесть органной дисфункции может быть измерена с помощью шкал APACHE III, SOFA или qSOFA. Поскольку начальные проявления, вызванные сепсисом, могут быть не столь явными и маскироваться симптомами основного заболевания, вероятность органной дисфункции необходимо рассматривать у каждого пациента с инфекционным процессом. Следует отметить, что эти рекомендуемые шкалы не являются изолированным критерием сепсиса [11]. Ключевой в их практическом применении является возможность выявления признаков повреждения при проведении тщательного обследования с целью исключения септического очага. Кроме того, количественная оценка полиорганной недостаточности в динамике позволяет оценивать не только тяжесть состояния, но и эффективность проводимой терапии.
Следует подчеркнуть, что синдром системного воспалительного ответа (ССВО) был частью дефиниций сепсиса до 2016 г. [12, 13]. Показатели ССВО в определенной степени отражают выраженность воспаления, но не позволяют определять жизнеугрожаемость ситуации. Кроме того, сам ССВО нередко играет компенсаторную роль, сдерживая патологический процесс и органно-системные повреждения. Не следует забывать, что некоторые пациенты принимают лекарства, влияющие на частоту сердечных сокращений, дыханий или температуру тела, следовательно, симптомы, отвечающие критериям ССВО, нивелируются, несмотря на наличие инфекции и недостаточности органов [13]. И наконец, в клинической практике встречаются случаи септического процесса без признаков ССВО. Ввиду низкой специфичности этого критерия в настоящее время он не считается основным в диагностике сепсиса [14].
Клинический случай
Пациентка Б. 57лет (30.05.2016) госпитализирована в отделение травматологии. На протяжении предшествовавших 1,5 месяцев ее беспокоил болевой синдром в области левого тазобедренного сустава (ТБС; в анамнезе эндопротезирование этого сустава [2015] по поводу коксартроза). Вышеописанные жалобы появились после серии вывихов, свершавшихся при опоре на чрезмерно согнутую в ТБС ногу с последующим самопроизвольным вправлением. В тот же период отмечала появление озноба, однако температуру тела не контролировала, самостоятельно принимала нестероидные противовоспалительные препараты (НПВП). При обращении за медицинской помощью (за пределами РФ, выписной эпикриз не представлен) после проведения рентгенологического исследования органов грудной клетки (ОГК) была диагностирована пневмония, назначен курс левофлоксацина (5 дней) с клиническим улучшением. 30.05.2016 произошло развитие очередного вывиха левого протезированного ТБС без самостоятельного вправления, в связи с чем пациентка госпитализирована в отделение травматологии. 31.05.2016 под внутривенной анестезией выполнено закрытое вправление вывиха левого эндопротеза, наложена деротационная шина. С 07.06.2016 жалобы на учащенное, болезненное мочеиспускание, окрашивание мочи в красный цвет (с 31.05 по 05.06 выполнялась катетеризация мочевого пузыря), озноб, повышение температуры тела до 38,6°С. В общем анализе мочи протеинурия – 0,438 г/л, эритроцитурия – 40–50–60 в п/зр. Клинический анализ крови: эритроциты –3,39×1012/л, Hb – 87,8 г/л, лейкоциты – 3,89×109/л, п/я – 5%, с/я – 72%, лимфоциты – 13%, моноциты – 8%, эозинофилы – 1%, базофилы – 1%, тромбоциты – 90,0×109/л; по данным ультразвукового исследования (УЗИ) почек и мочевого пузыря: патологических изменений, конкрементов не выявлено. Рентгенография ОГК – в нижней доле правого легкого определялся инфильтрат с реакцией плевры. Полученные данные были расценены как правосторонняя нижнедолевая пневмония, назначен амоксициллин/клавулановая кислота. 10.06.2016 на фоне повышения температуры тела до 37,6°С выполнен забор крови на стерильность и чувствительность к антибиотикам.
К концу третьих суток антибактериальной терапии произошла нормализация температуры тела, в контрольном клиническом анализе крови лейкоциты 6,51×109/л, СОЭ – 66 мм/ч, в общем анализе мочи сохранялись эритроцитурия и протеинурия. 15.06.2016 снята иммобилизирующая шина с расширением двигательного режима, антибактериальная терапия продолжалась.
17.06.2016 пациентка была переведена в отделение терапии с жалобами на выраженную общую слабость, повышенную потливость, одышку смешенного характера в покое, увеличение живота в объеме, отеки нижних конечностей, боль в области протезированного сустава. Объективно на момент перевода: состояние тяжелое, сознание заторможено, температура тела – 37,9°С. Кожные покровы и видимые слизистые оболочки бледные, субиктеричные. Отеки голеней. Гематома по наружной поверхности левого бедра на уровне ТБС размером 5,0×5,0 см, там же старый послеоперационный рубец. Пульс симметричный, 100 ударов в минуту, ритмичный. Артериальное давление – 90/60 мм рт.ст. Тоны сердца приглушены, систолический шум на верхушке, не проводится. Частота дыхательных движений – 28 в минуту, в акте дыхания участвует вспомогательная мускулатура. Дыхание жесткое, в нижнебоковых отделах резко ослаблено, там же выслушиваются разнокалиберные влажные хрипы. При пальпации живот мягкий, безболезненный, притупление перкуторного звука в отлогих отделах, увеличение в объеме за счет асцита. Печень не выступает из-под края реберной дуги. Селезенка: нижний полюс плотный, выступает из-под края реберной дуги на 2 см.
Получены результаты посева венозной крови от 10.06.2016: Staphylococcus aureus, чувствительный к ципрофлоксацину, клиндамицину, линкомицину, гентамицину, ванкомицину.
С целью поиска очага инфекции дополнительно выполнены:
1. Эхо-КГ: изменений на клапанном аппарате, регургитаций не выявлено, сократительная функция миокарда сохранна, легочная гипертензия – 55 мм рт.ст.
2. Спиральная КТ ОГК: двусторонние распространенные интерстициальные изменения, вероятно, отек легких, минимальный правосторонний организующийся плеврит.
3. Спиральная КТ ОБП: плотность печени понижена, воротная вена диаметром 1 см, внутрипеченочные желчные протоки не расширены. Селезенка – 240×62 мм. Асцит+.
4. Спиральная КТ ТБС: состояние после эндопротезирования левого ТБС. КТ-картина застарелого раскалывающегося перелома бедренной кости вокруг ножки эндопротеза.
Полученные клинико-лабораторные данных расценены как генерализованный септический процесс у пациентки с двусторонней полисегментарной стафилококковой пневмонией. С учетом тяжести состояния, сопутствующей патологии пациентка переведена в отделение реанимации и интенсивной терапии. Произведена замена проводимой антибактериальной терапии на ванкомицин и цефтриаксон. К 19.30 отрицательная динамика: нарастание явлений дыхательной недостаточности, оглушение сознания до сопора, кислотно-основное состояние – компенсированный метаболический ацидоз, гипотония (артериальное давление – 70/40 мм рт.ст.), тахикардия (100 ударов в минуту), анурия. Выполнена интубация, начаты искусственная вентиляция легких, инфузия растворов, внутривенное введение дофамина, фуросемида. Несмотря на проведенную комплексную интенсивную терапию, в 07.00 констатирована биологическая смерть.
Из заключения патологоанатомического вскрытия: непосредственной причиной смерти стала прогрессирующая полиорганная, преимущественно легочно-сердечная, а также печеночно-клеточная и почечная недостаточность, осложнившая течение сочетанных заболеваний.
В проекции протеза левого ТБС выявлен тотальный септический аутолиз организующейся гематомы (4,0×2,0×1,5 см). Что в условиях бактеремии привело к развитию сепсиса с развитием синдрома диффузного альвеолярного повреждения легких, лейкемоидной реакции и проявлениям геморрагического синдрома. Смешанный (моно-, мультилобулярный), преимущественно мелкоузловой атрофический цирроз печени. Индекс гистологической активности (по Knodell) – 7, стадия (по Desmet V.) – 4.
Осложнение основного заболевания: формирующаяся ацинарная бронхопневмония. Легочно-сердечная недостаточность: интерстициальный отек легких. Портальная гипертензия: варикозное расширение вен пищевода, асцит (500 мл), гиперспленизм (масса – 1850 г). Печеночно-клеточная, почечная недостаточность.
При ретроспективном анализе данного клинического случая позднее диагностирование септического состояния было обусловлено несколькими причинами: из признаков ССВО на начальных этапах определялось только повышение температуры тела с положительным ответом на антибактериальную терапию; забор крови на посев и стерильность был произведен однократно, имела место поздняя готовность этого результата; для исключения или подтверждения септического процесса по техническим причинам не определялся прокальцитонин; не проводилась в динамике оценка органной недостаточности по шкалам APACHE III и SOFA; при проведении спиральной КТ ТБС не были выявлены признаки септического очага. Также, по нашему мнению, одной из причин несвоевременного распознавания септического процесса и позднего начала адекватной антибактериальной терапии послужила недооценка тяжести коморбидного фона пациентки [15].
Заключение
Информированное согласие пациента отсутствует.
Литература
1. Kaukonen K.M., Bailey M., Suzuki S., et al. Mortality related to severe sepsis and septic shock among critically ill patients in Australia and New Zealand, 2000-2012. JAMA. 2014;311(13):1308–16. Doi: 10.1001/jama.2014.2637.
2. Levy M.M., Artigas A., Phillips G.S., et al. Outcomes of the Surviving Sepsis Campaign in intensive care units in the USA and Europe: a prospective cohort study. Lancet Infect Dis. 2012;12(12):919–24. Doi: 10.1016/S1473-3099(12)70239-6.
3. Liu V., Escobar G.J., Greene J.D., et al. Hospital Deaths in Patients With Sepsis From 2 Independent Cohorts. JAMA. 2014;312(1):90–2. Doi: 10.1001/jama.2014.5804.
4. Sjoding M.W., Prescott H.C., Wunsch H., et al. Longitudinal changes in ICU admissions among elderly patients in the United States. Crit Care Med. 2016;44(7):1353–60. Doi: 10.1097/CCM.0000000000001664.
5. Vincent J.L., Abraham E. The last 100 years of sepsis. Am J Respir Crit Care Med. 2006;173(3):256–63. Doi: 10.1164/rccm.200510-1604OE.
6. Kempker J.A., Martin G.S. The changing epide-miology and definitions of sepsis. Clin Chest Med. 2016;37(2):165–79. Doi: 10.1016/j.ccm.2016.01.002.
7. Мальцева Л.А., Базиленко Д.В. Патогенез тяжелого сепсиса и септического шока: анализ современных концепций. Медицина неотложных состояний. 2015;7(70):35–40.
8. Руднов В.А., Кулабухов В.В. Эволюция представлений о сепсисе. История продолжается. Инфекции в хирургии. 2015;2:6–10.
9. Seymour C.W., Liu V.X., Iwashyna T.J., et al. Assessment of clinical criteria for sepsis: for the Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016;315(8):762–74. Doi: 10.1001/jama.2016.0288.
10. Singer M., Deutschman C.S., Seymour C.W., et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. 2016;315(8):801–10. Doi: 10.1001/jama.2016.0287.
11. Vincent J.L., Moreno R., Takala J., et al. The SOFA (Sepsis-related Organ Failure Assessment) score to describe organ dysfunction failure. On behalf of the Working Group on Sepsis-Related Problems of the European Society of Intensive Care Medicine. Intensive Care Med. 1996;22(7):707–10.
12. Kaukonen K.M., Bailey M., Pilcher D., et al. Systemic inflammatory response syndrome criteria in defining severe sepsis. N Engl J Med. 2015;372;(17):1629–38. Doi: 10.1056/NEJMoa1415236.
13. Алиев С.А., Алиев Э.С., Ибрагимов Ф.И. Сепсис: эволюция взглядов, унификация критериев в свете современных представлений. Обзор литературы. Вестник хирургической гастроэнтерологии. 2017;2:8–16.
14. Карсанов А.М., Маскин С.С., Слепушкин В.Д. и др. Клинико-эпидемиологическое значение системного воспаления и сепсиса. Вестник хирургии. 2015;4:99–103.
15. Круглякова Л.В. Бактериальные осложнения цирроза печени. Амурский медицинский журнал. 2018;3(23):61–5.
17. Wong F., Bernardi M., Balk R., et al. Sepsis in cirrhosis: report on the 7th meeting of the International Ascites Club. Gut. 2005;54(5):718–25. Doi: 10.1136/gut.2004.038679.
19. Малаева Е.Г. Тактика ведения асцита у пациентов с циррозом печени. Проблемы здоровья и экологии. 2012;3(33):28–35.
Для цитирования: Яковлев А.Б. Дерматологические симптомы цирроза печени: значимость междисциплинарной проблемы. РМЖ. 2014;20:1471.
Печень взрослого человека весит около 1,5 кг. Она покрыта тонкой прочной соединительнотканной оболочкой – глиссоновой капсулой [1]. Большая часть печени располагается в правой стороне туловища. Печень проецируется на переднюю брюшную стенку надчревной области. Верхняя граница печени в норме начинается в 10-м межреберье справа по средней подмышечной линии. Отсюда она круто поднимается кверху и медиально. По правой сосковой линии граница печени может достигать в норме 4-го межреберья. Далее граница печени опускается влево, пересекает грудину несколько выше основания мечевидного отростка, верхняя граница печени доходит до середины расстояния между левой грудинной и левой сосковой линией.
Нижняя граница печени также начинается в 10-м межреберье справа, но идет наискосок и медиально, пересекает 9-й и 10-й реберные хрящи справа, идет по области над чревьем наискосок влево и вверх, пересекает реберную дугу на уровне 7-го левого реберного хряща и в 5-м межреберье соединяется с верхней границей [2]. Расположение нижней границы печени – одна из наиболее важных клинических характеристик ее размера. В норме она определяется ниже края реберной дуги справа, выступ должен быть не более чем 2 см.
Печень состоит из 2-х главных долей, правая доля значительно крупнее левой. Нижняя поверхность печени называется висцеральной и соприкасается с некоторыми частями ЖКТ и правой почкой. Верхняя поверхность печени гладкая, непосредственно прилежит к диафрагме. На нижней поверхности печени имеется короткая глубокая поперечная борозда – ворота печени.
Относительная массовая доля печени неодинакова в различные периоды жизни человека: у новорожденного печень занимает большую часть брюшной полости, а масса составляет 1:20 массы тела; у взрослого масса печени – 1:50 массы тела, а ее скелетотопия соответствует описанной выше [2].
Печень состоит из паренхимы, формируемой гепатоцитами, и соединительнотканной стромы. Гепатоциты – функциональные клетки печени, выполняющие не менее 500 различных функций – от накопительных (гликоген) до детоксицирующих (глюкуронид).
Гипертрофические поражения ногтей, их чрезмерное уплотнение (склеронихия), гиппократовы ногти для цирроза печени не характерны.
Классическим признаком длительно пьющего человека всегда считалась эритема лица – симптом, описанный во многих художественных произведениях. Между тем сама по себе эритема лица, или розацеа, напрямую не коррелирует с тяжестью поражения печени, а лишь выдает факт злоупотребления алкоголем. Именно под действием алкоголя происходит расширение сосудов лица, которое в дальнейшем становится стойким. Однако считается, что крайняя степень розацеа – ринофима все же определенным образом коррелирует с тяжестью поражения печени и может служить ориентировочным симптомом сформировавшегося цирроза, дающим основание для целенаправленного поиска. Такими ориентировочными симптомами являются многие из описанных кожных изменений. Считается, что ринофима представляет собой завершающую инфильтративно-продуктивную стадию развития розацеа. Процесс может локализоваться в области не только носа (ринофима), но и подбородка (гнатофима), на ушах (отофима), веках (блефарофимоз) [15]. Из 4-х видов ринофимы (гландулярная, фиброзная, фиброангиоматозная, актиническая) для цирроза печени в большей степени характерна форма, связанная с инсоляцией, – актиническая. Но могут наблюдаться все перечисленные формы ринофимы.
Крапивница является неспецифическим синдромом и в целом для цирроза не характерна. Но она может быть одним из признаков активного вирусного гепатита. В далеко зашедших случаях цирротического поражения появление крапивницы обусловлено скорее токсическими влияниями [1, 16].
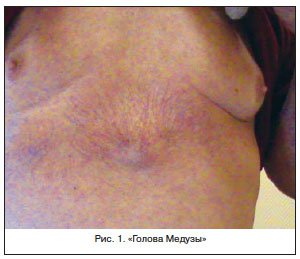
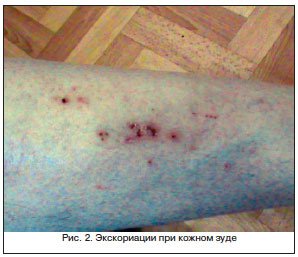
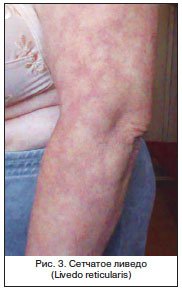
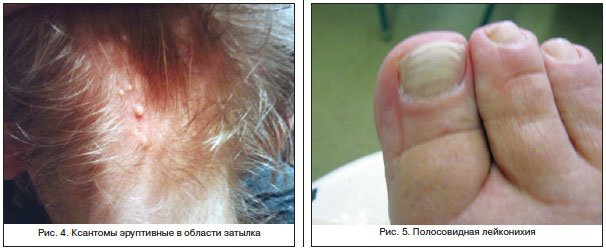
Для цитирования: Сквoрцoв В.В., Гoрбaч А.Н. Сепсис-индуцированная дисфункция печени: современная диагностика и стратегии лечения // Эффективная фармакотерапия. 2020. Т. 16. № 15. С. 80–84.
- Аннотация
- Статья
- Ссылки
- Английский вариант
В статье представлен современный взгляд на патогенез и основные причины дисфункции печени при сепсисе. Освещены вопросы диагностики и современные подходы к лечению.
- КЛЮЧЕВЫЕ СЛОВА: сепсис, дисфункция печени, гепатит, печеночная недостаточность, диализ
В статье представлен современный взгляд на патогенез и основные причины дисфункции печени при сепсисе. Освещены вопросы диагностики и современные подходы к лечению.
Cепсис – патологический процесс, в основе которого лежит реакция организма в виде генерализованного воспаления на инфекционный агент различной природы (бактериальный, вирусный, грибковый). Сепсис, тяжелый сепсис и септический шок являются одними из ведущих причин госпитализации и смерти. Ежегодно во всем мире регистрируют около 20 млн случаев сепсиса, показатели смертности при которых варьируются от 30 до 50% [1, 2].
Изучение патогенеза сепсиса и разработка новых направлений терапии не привели к значительному снижению летальности. В настоящее время она остается высокой.
Основная причина смерти при сепсисе связана с развитием синдрома полиорганной дисфункции, в частности с прогрессирующей печеночной недостаточностью [1, 3, 4].
Тяжелый сепсис и септический шок, будучи наиболее тяжелыми формами воспалительной реакции организма, сопровождаются нарушением функций органов и систем, удаленных от основного очага инфекции. При полиорганной недостаточности с примерно одинаковой частотой нарушаются функции сердечно-сосудистой (60,2%) и центральной нервной системы (60,2%), почек (60,2%), печени (56,1%) [4].
Среди органов, поражаемых при септических состояниях, печень занимает особое место. Участвуя в ответе на системную воспалительную реакцию, она регулирует широкий спектр метаболических и защитных реакций. Установлено, что прогрессирование печеночной недостаточности коррелирует с повышенным риском летального исхода. Поэтому актуальными задачами медицины критических состояний являются своевременная диагностика осложнений септического процесса и их коррекция [3–5].
Эпидемиология
По данным многочисленных исследований, частота сепсиса в индустриально развитых странах достигает 50–100 случаев на 100 тыс. населения [1–3, 5–7].
Доказано, что исходными фоновыми факторами, влияющими на течение инфекционного процесса и развитие осложнений, связанных с нарушением функции печени, служат:
- возраст (в группе риска новорожденные и пожилые пациенты; с каждым годом жизни вероятность смерти при заболевании сепсисом повышается на 0,67%);
- сопутствующая патология (злокачественные новообразования, цирроз печени и др.);
- иммуносупрессия (длительный прием глюкокортикостероидов (ГКС), лучевая или химиотерапия).
Кроме того, на риск развития сепсиса и его тяжесть влияют генетические факторы (дефицит комплемента, неполноценная функция нейтрофилов, дефекты паттерн-распознающих молекул, таких как CD14, TLR, измененная способность к экспрессии цитокинов) [2].
Результаты американского исследования продемонстрировали значимость расовых различий при определении прогноза летальности при сепсисе. Относительный риск смерти по сравнению с белым населением у негроидной расы, американских индейцев и коренных алеутов выше (2,24 и 1,24 соответственно), а у азиатов ниже (0,78). Относительный риск смерти среди мужского населения по сравнению с женским идентичен для всех рас – 1,27 [1, 2].
Этиопатогенез
Сегодня в большинстве многопрофильных медицинских учреждений наблюдается незначительное превалирование грамотрицательного сепсиса. В одномоментном эпидемиологическом исследовании EPIC II (2007 г.) по оценке распространенности инфекций в отделениях реанимации и интенсивной терапии с участием свыше 14 000 пациентов из 76 стран была определена этиологическая структура септических состояний. Грамположительные микроорганизмы стали причиной инфекции в отделении интенсивной терапии в 47% случаев, грамотрицательные – в 62% случаев. Установлена взаимосвязь между локализацией очага инфекции и характером микрофлоры, запускающей инфекционно-воспалительный процесс [2].
Клинически определяют две причины печеночной дисфункции при сепсисе [3, 7, 8]:
- гипоксический гепатит;
- сепсис-ассоциированный холестаз.
Патогенез сепсис-ассоциированного холестаза можно объяснить аналитическими методами, известными как ОМИКс-технологии. Ученым удалось оценить геном (ДНК), сигнальные РНК, аминокислоты (протеом) в клетках ткани печени и организме в целом при развитии сепсиса. Показано, что транскрипционный ядерный фактор NF-kB играет ключевую роль в регуляции активности генов, участвующих в воспалительных, иммунных и метаболических реакциях в печени. Воспалительные сигналы снижают экспрессию гепатоцеллюлярных транспортеров в гепатоцитах. В результате возникает глубокое повреждение механизмов клеточной детоксикации, транспорта желчных кислот и билирубина, что и служит причиной холестаза [4].
Септический процесс вызывает значительные изменения макро- и микроциркуляции в печени. При сепсисе может не нарушаться оксигенация печени, но подавляется утилизация кислорода в митохондриях гепатоцитов, нарушается энергетический метаболизм в результате ингибирования NO митохондриальной функции клеток. Это состояние определяется как цитопатическая гипоксия [3, 4, 7].
Известно несколько защитных механизмов, обеспечивающих постоянство печеночного кровотока.
Второй защитный механизм обеспечивается благодаря фенестрации эндотелиальных клеток, выстилающих синусоиды, через которые происходит интенсивная диффузия кислорода к клеткам печени [3, 7].
Активация и дисфункция эндотелиально-клеточного барьера обусловливают значительное поступление лейкоцитов и тромбоцитов в микрососудистое русло печени, последующее формирование микротромбов и ишемическое повреждение печени. Инфильтрированные в печень активированные нейтрофилы, продуцируя большое количество активных форм кислорода и протеиназ, приводят к ее повреждению. Дефенестрация эндотелиальных клеток синусоидов бактериальными токсинами нарушает не только второй защитный механизм – диффузию кислорода к клеткам печени, но и обмен липопротеинов и макромолекул между кровью и гепатоцитами, что также является дополнительным механизмом гиперлипидемии при сепсисе [3, 4].
При критических ситуациях, таких как септический шок, сосудистые механизмы защиты от снижения портального кровотока изменяются, печеночный артериальный буферный ответ повреждается. Как следствие, развивается гипоксический гепатит [4, 8].
При сепсисе резкий рост числа бактерий в кишечнике, транслокация бактерий и токсинов через кишечную стенку в портальный кровоток вызывают активацию купферовских клеток с выбросом пула цитокинов, воздействующих на РНК, группы провоспалительных цитокинов. Купферовские клетки, увеличиваясь в размерах, вызывают частичную обструкцию синусоидов. Увеличение циркулирующих уровней эндотелина, эндотелий-зависимого фактора вазоконстрикции приводит к сокращению постсинусоидальных сфинктеров. В результате повышается синусоидальное сопротивление и возрастает давление в портальной системе. Происходит перераспределение регионального объема кровотока с доминированием венозной его части. Основным проявлением этого становятся увеличение объема крови во внутренних органах, отек и возрастающие потери в третье пространство, что в немалой степени способствует возникновению септической гиповолемии. Несмотря на максимальное компенсаторное расширение печеночной артерии вследствие эндотоксемии, потеря механизмов активного контроля ведет к неполной компенсации уменьшенного портального и системного кровотока [3–5, 7, 10].
Следовательно, при сепсисе, несмотря на компенсаторные механизмы сосудистой печеночной системы, возникает относительная ишемия печени в условиях повышенного печеночного метаболизма. При этом насыщение крови кислородом снижено. Парциальное давление кислорода в центральной зоне ниже, чем на периферии печеночной дольки. Это способствует чувствительности центральных гепатоцитов к гипоксии, часто приводящей к некрозу [3, 5, 7].
Результаты исследований подтверждают, что в процессе развития сепсиса среди различных функций печени прежде всего нарушается выделительная – устранение эндо- и ксенобиотиков в результате холестаза [10].
Клинические симптомы и диагностика
Нарушения функции печени при сепсисе могут варьироваться от субклинической формы до явной недостаточности [3, 4, 7].
При поступлении в стационар больной может находиться в критическом состоянии, но это необязательное условие, которое отмечается в 50%. Как правило, клинические симптомы повреждения печени становятся очевидными в первый день госпитализации и проявляются тянущей болью в правом подреберье. При осмотре определяется увеличенная болезненная печень. Однако эти симптомы отходят на задний план на фоне клинических признаков тяжелого основного заболевания [5, 6, 11].
В условиях септического шока печеночную дисфункцию принято считать двухфазным процессом с начальным развитием гипоксического гепатита и последующим развитием (спустя несколько дней) желтухи. Обычно признаки желтухи определяются через 2–7 дней от начала развития бактериемии. Тем не менее бактериемия не является предиктором возникновения печеночной недостаточности или холестаза. Примерно 1/3 пациентов с сепсисом имеет признаки холестатической желтухи за 1–9 дней до первых положительных результатов бактериального посева крови [2, 5, 7, 11].
Общепринятыми критериями гипоксического гепатита считаются [3, 7, 9, 12, 13]:
- наличие основного заболевания с типичной клинической картиной шока;
- резкое возрастание уровня трансаминаз (обычно уровень аланинаминотрансферазы превышает уровень аспартатаминотрансферазы более чем в 20 раз относительно нормы; впоследствии (в течение 10–14 дней) отмечается быстрая нормализация значений трансаминаз);
- раннее и острое снижение уровня протромбина;
- исключение других этиологических факторов, способствующих развитию острого гепатита.
К факторам риска, связанным с высокой смертностью больных гипоксическим гепатитом и развившейся печеночной недостаточностью, относятся [8, 12, 13]:
- уровень трансаминаз в сыворотке крови, лактатдегидрогеназы (ЛДГ4 и ЛДГ5), лактата, более чем в два раза превышащий верхнюю границу нормы;
- острое развитие гипербилирубинемии > 34,2 мкмоль/л;
- протромбиновое время или международное нормализованное отношение, более чем в 1,5 раза превышающее контрольные значения;
- состояние септического шока, более 10 баллов по шкале SOFA.
В настоящее время предполагается, что возможно раннее прогнозирование тяжести течения септического процесса при установлении содержания в плазме желчных кислот в ранние часы развития сепсиса. Проанализированные учеными результаты лабораторных исследований были связаны с тяжестью изменений в печени и коррелировали с прогнозом. Полученная информация может иметь значение при выборе лечебной тактики пациентов, находящихся в критическом состоянии [3, 6].
Данные анализы необходимо проводить после установления диагноза сепсиса (таблица). Для диагностики сепсиса целесообразно выполнять количественный прокальцитониновый тест. При концентрации прокальцитонина 2 нг/мл и более тест считается положительным. Прокальцитониновый тест – один из наиболее специфичных и чувствительных маркеров бактериальной инфекции. При неочевидной бактериальной природе синдрома системной воспалительной реакции (ССВР) прокальцитониновый тест позволяет в ранние сроки определить бактериальную природу септического процесса. Для верификации грибковой или вирусной природы инфекционного процесса прокальцитониновый тест может использоваться для дифференцирования природы ССВР и природы инфекции. В качестве диагностического лабораторного теста при грибковой инфекции рекомендовано определение маннанового антигена и антиманнановых антител в качестве дополнительных диагностических тестов [1–3, 5–7].
В настоящее время терапевтические возможности коррекции сепсис-индуцированной дисфункции печени базируются только на общих принципиальных положениях интенсивной терапии. Рекомендации по диагностике и терапии больных сепсисом основаны на достижениях и мировом опыте и сформулированы с позиций доказательной медицины. Основная цель терапии – раннее восстановление гемодинамики. Это позволяет восстановить перфузию печени, что крайне важно в предотвращении ее дисфункции [1, 2, 5, 6].
Исходя из современных представлений, лечение тяжелого сепсиса и септического шока должно начинаться в минимально короткий срок от развития клинической картины и установления диагноза.
Основные направления лечения тяжелого сепсиса и септического шока [1, 2] предполагают:
- санацию (контроль) очага инфекции;
- назначение антибактериальной (противовирусной, антифунгальной) терапии;
- стабилизацию гемодинамики (инфузионная терапия, вазопрессоры, инотропы);
- респираторную поддержку (при необходимости);
- использование дополнительных методов терапии, направленных на нормализацию функционирования органов и систем.
Дискутабельным остается вопрос эффективности использования ГКС при сепсис-индуцированной печеночной дисфункции. Экспериментальные данные свидетельствуют о том, что ГКС могут влиять на иммуномодуляцию вызванного сепсисом холестаза через индукцию гепатобилиарных транспортеров и восстановление транспорта желчи [2].
Искусственные системы поддержки функции печени
В качестве дополнительных методов терапии рассматриваются искусственные системы поддержки печени [1, 14, 15]. В зависимости от используемых технологий их можно разделить:
- на биологические;
- небиологические (искусственные, или свободные от клеточных технологий);
- биоискусственные (гибридные устройства).
Механизм действия биологических систем искусственной поддержки функции печени основан на перфузии крови или плазмы через экстракорпоральный биореактор, содержащий живые культуры клеток печени. Применение этих устройств направлено на поддержку дезинтоксикационной и метаболической функции печени при развитии печеночной недостаточности. Небиологические устройства, наоборот, только удаляют водорастворимые и связанные с белками крови токсины. Биоискусственные или гибридные системы сочетают обе технологии [2, 15].
Доказано, что применение искусственных систем поддержки функции печени позволяет снизить летальность при тяжелой печеночной недостаточности. Одной из таких систем является экстракорпоральный альбуминовый диализ (ECAD), который позволяет удалять низко- и среднемолекулярные альбумин-связанные вещества, такие как эндотоксин, цитокины и NO. В одном из проведенных исследований данный метод применяли в качестве дополнительной терапии пациентов с декомпенсированным циррозом печени и прогрессирующей терминальной стадией печеночной недостаточности. Применение ECAD ассоциировалось с улучшением системной гемодинамики. Метаанализ четырех рандомизированных исследований выявил увеличение выживаемости пациентов с циррозом печени и тяжелой печеночной недостаточностью, прошедших ECAD, по сравнению с группой больных, находившихся на стандартной терапии [15].
Дальнейшее применение данного метода важно для развития эффективного направления в терапии сепсис-индуцированных состояний.
Необходимо развитие такой отрасли, как трансляционная медицина. Она дает представление о молекулярных механизмах повреждения печени при сепсисе. Лучшее понимание патофизиологической реакции печени на септический процесс, раннее выявление дисфункции печени и своевременное адекватное лечение тяжелого сепсиса и септического шока играют решающую роль в увеличении выживаемости [3, 7].
Читайте также:

