Ингибировании репродукции вируса это
Обновлено: 04.05.2024
Ключевые слова: вирус простого герпеса, ВПГ, клеточная культура, масляный экстракт водорослей, противовирусное действие, in vitro.
Для цитирования: Львов Н.Д., Мельниченко А.В., Алимбарова Л.М., Никитина А.А. Ингибиторный эффект препарата на основе масляного экстракта водорослей на репродукцию вируса герпеса в культуре клеток in vitro. РМЖ. 2019;1(II):51-55.
Drug inhibitory effect, based on algae oil extract, on the herpes virus reproduction in cell culture in vitro
N.D. Lvov, A.V. Melnichenko, L.M. Alimbarova, A.A. Nikitina
Gamalei National Research Center for Epidemiology and Microbiology, Moscow
Keywords: herpes simplex virus, HSV, cell culture, algae oil extract, antiviral effect, in vitro.
For citation: Lvov N.D., Melnichenko A.V., Alimbarova L.M., Nikitina A.A. Drug inhibitory effect, based on algae oil extract, on the herpes virus reproduction in cell culture in vitro. RMJ. 2019;1(II):51–55.
В статье представлены результаты оригинального исследования, посвященного изучению влияния препарата на основе масляного экстракта морских водорослей на репродукцию вируса простого герпеса 1, 2 в эксперименте in vitro на чувствительной модели — клеточной культуре.
Введение
Материал и методы
ОП опытных лунок = (ОП среды/ОП контр. лунок – ОП среды) ×100%,
где ОП — оптическая плотность.
Результаты и обсуждение
Определение цитотоксичности МЭВ
На первом этапе исследования необходимо было определить цитотоксичность препарата, т. е. возможность использования препарата без повреждающего действия на клетки и максимально переносимую концентрацию.
Данные представлены в таблице 1. Для адекватной статистической обработки материала на каждую концентрацию препарата отводилось 3–4 лунки, опыты воспроизводились в 3 повторах.
В результате проведенных исследований обнаружено, что препарат МЭВ в концентрации 0,1% оказывает выраженное цитопатическое действие на клетки в первые сутки (нарушение морфологии клетки, снижение жизнеспособности более чем на 90%), а в концентрации 0,001% не оказывает токсического влияния на физиологическое состояние клеток, показатели равнялись контрольным. МЭВ в концентрации 0,01% слаботоксичен, при этом отмечается снижение темпов роста культуры и процента жизнеспособных клеток на 54%. В случае воздействия 1,0 и 0,1% раствором препарата наблюдался выраженный цитотоксический эффект, что отражалось на первые сутки наблюдения статически достоверным снижением как плотности клеточной суспензии, так и жизнеспособности клеток (р <0,0017).
Установлено, что 50% тканевая цитотоксическая доза
ТЦД50/мл составила 0,0055% раствора препарата МЭВ.
В митохондриальном тесте были определены эффективные концентрации препарата, вызывающие 50% ингибирование выживаемости клеток (IC 50). Значения абсорбции представлены в относительных единицах. Для контроля (без препарата, 1% ДМСО) значения линий составляют 0,904±0,05 и 1,03±0,08 (рис. 1).
В дальнейших исследованиях использованы только концентрации препарата МЭВ 0,01–0,00001%, т. к. более высокие концентрации (1,0–0,1%) использовать нецелесообразно, поскольку они оказывалют выраженный цитотоксический эффект на клетки.
Исследование противовирусного действия препарата МЭВ на репродукцию вируса простого герпеса in vitro в культуре клеток
![Таблица 1. Характеристика аллергенов, используемых в лабораторной диагностике [3]](https://www.rmj.ru/upload/medialibrary/3d6/51-5.jpg)
где ТЦД50 (тканевая цитотоксическая доза, вызывающая морфологические изменения ткани и снижающая жизнеспособность клеточной культуры на 50%)
составила 0,0055, ТЦИД50 (ИД 50) (тканевая цитотоксическая доза, ингибирующая репродукцию вируса на 50%) составила 0,001.
Если препарат имеет ХТИ8, то препарат обладает сильным противовирусным действием. По данным литературы, также рассматривается снижение титра вируса при действии препарата не менее чем на 1,25–2,0 lgТЦИД50/мл вирусной активности в условиях одноциклового исследования.
По результатам проведенных исследований ХТИ для препарата МЭВ составил 5,5, что свидетельствует о противовирусной активности препарата.
Исследование инфекционной активности ВПГ в иммуноферментном анализе

На дальнейшем этапе определения противовирусного действия МЭВ проводили ИФА для оценки активности ВПГ в культуре клеток. Результаты представлены в таблице 3.
В результате исследования было выявлено, что при концентрации препарата 0,001%, внесенного за 1 ч до инфицирования вирусом (в условиях эксперимента), отмечается наиболее значительное снижение инфекционной активности вируса (титр вируса составил 1:300 по сравнению с контролем — 1:656 100).
Заключение
Таким образом, препарат МЭВ оказывает максимальное противовирусное действие против ВПГ в концентрации 0,001% при внесении за 1 ч до появления вируса (профилактическая схема) и менее выраженное противовирусное действие по лечебной схеме (после инфицирования вирусом). ХТИ для препарата МЭВ составил 5,5, что свидетельствует о противовирусной активности препарата. МЭВ является новым перспективным препаратом с механизмом действия, отличным от механизма известных лекарств (препараты ряда ациклогуанозина), в лечение ВПГ-инфекции.
Данные исследования представляют собой начальную фазу наших экспериментов в этом направлении, и уже первые шаги показали перспективность МЭВ как антигерпетического препарата.
Типы инфицирования клеток вирусами. Репродуктивный цикл вирусов. Основные этапы репродукции вирусов. Адсорбция вириона к клетке.
По характеру взаимодействия генома вируса с геномом клетки выделяют автономное (геном вируса не интегрирован в геном клетки) и интеграционное (геном вируса интегрирован в геном клетки) инфицирование. Особую форму составляют латентное и персистирующее инфицирование.
Персистирующее инфицирование клеток вирусам. Некоторые РНК-вирусы могут вызывать персистиру-ющие инфекции, проявляющиеся образованием дочерних популяций возбудителя после завершения острой фазы болезни. При этом происходит постепенное выделение вирусных частиц, но инфицированная клетка не лизируется. Нередко дочерние популяции вирионов дефектны (часто наблюдают у лиц с иммунодефицитами). Иногда такие хронические поражения протекают без клинических проявлений. В частности, вирус гепатита В способен вызывать персистирующее поражение гепатоцитов с развитием хронического гепатита; в дальнейшем возможна малигнизация клеток.
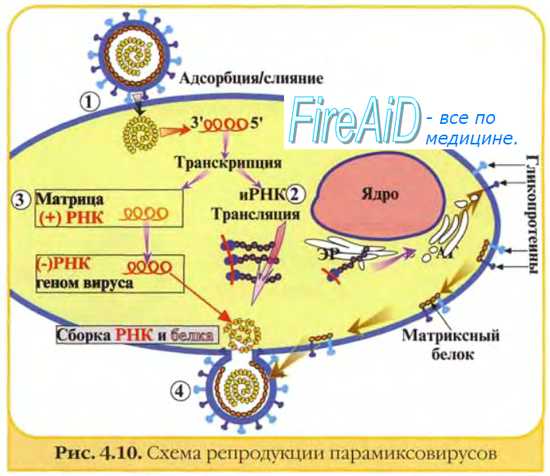
Репродуктивный цикл вирусов
Изображённые на рис. 2-3 этапы репродукции (от адсорбции вирионов до высвобождения дочерней популяции) происходят при продуктивном взаимодействии вируса с клеткой.
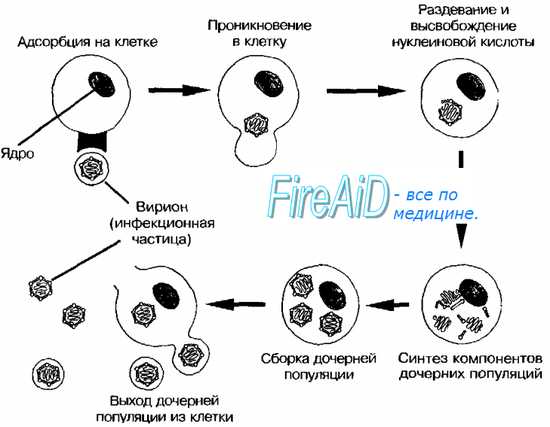
Рис. 2-3. Основные этапы репродукции вирусов.
Адсорбция вириона к клетке
• Процесс адсорбции не зависит от температуры (то есть не требует энергетических затрат) и протекает в две фазы; фаза ионного притяжения обусловлена неспецифическим взаимодействием, фаза прикрепления происходит благодаря структурной гомологии либо комплемен-тарности взаимодействующих молекул.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
ИНГИБИТОРЫ ВИРУСОВ (лат. inhibere удерживать, останавливать) — вирусотропные вещества, образующиеся в организме человека или животного и обладающие способностью в результате взаимодействия с вирусами подавлять их инфекционную активность. Кроме того, И. в. могут подавлять и отдельные функции вирусов, напр, гемагглютинацию, обусловливаемую вирусом гриппа. В отличие от антител (см.), к-рым присуща строгая специфичность, ингибиторы обладают более широким спектром активности в отношении различных видов вирусов, что дало основание называть их неспецифическими факторами иммунитета.
Впервые И. в. были обнаружены в сыворотке крови. В 1910 г. С. Флекснер и Льюис (J. Lewis) описали способность нормальной сыворотки овец нейтрализовать вирус полиомиелита. В последующем ингибиторы к различным вирусам были найдены в сыворотках крови обезьян, кроликов, собак, птиц, коров, лошадей и других животных. В 1942 г. Херст (G. К. Hirst) обнаружил ингибиторы к вирусу гриппа в сыворотке крови здорового человека. Результаты большого числа исследований, проведенных в различных лабораториях, позволяют сделать вывод, что в сыворотках человека и животных содержатся ингибиторы, активные по отношению ко многим как РНК-, так и Д H K-со держащим вирусам. Установлено также, что И. в., выявляемые в сыворотках крови разных животных, различаются как качественно, так и количественно. Так, в сыворотке крови человека содержатся ингибиторы вирусов гриппа А и В, но отсутствуют ингибиторы вируса гриппа С, в сыворотке же крыс содержатся в большом количестве ингибиторы вирусов гриппа С, но мало ингибиторов вирусов гриппа А и В.
Помимо видовых различий в содержании И. в., характерных для различных животных, наблюдаются как индивидуальные колебания у отдельных особей, так и изменения количества И. в. у одного и того же животного в зависимости от возраста и времени года: содержание И. в. в сыворотке лабораторных животных резко уменьшается в зимне-весенние месяцы и возрастает летом и осенью. Аналогичные закономерности возрастной и сезонной динамики установлены и для человека. Сыворотки крови детей первых 2—5 мес. жизни обладают высокой вируснейтрализующей активностью (в этом случае имеют место И. в. материнского происхождения). Затем содержание И. в. резко падает и до 1,5—2 лет сыворотка крови детей характеризуется низким содержанием ингибиторов. Количество И. в. начинает возрастать после 3 лет, достигая высоких показателей к 9—10 годам. У стариков содержание И. в. в сыворотке крови также невелико.
Изучение хим. природы И. в. различных животных и человека позволило прийти к заключению об их неоднородности и достаточно сложном строении. Оказалось, напр., что вирусингибирующая активность сыворотки крови морской свинки В отношении вирусов гриппа А и ECHO связана с липопротеидами, входящими в состав глобулиновой фракции белков сыворотки, а ингибитор вируса Сендай был обнаружен в составе альбуминовой фракции.
Гетерогенность И. в. обусловила появление различных классификаций. В основу одной из них положено распределение И. в. по принципу устойчивости к прогреванию при различной температуре. Так, для ингибиторов миксовирусов и респираторных вирусов Т. Я. Лузяниной предложена следующая классификация. 1. Термолабильныe ингибиторы, которые разрушаются после прогреваний при t° 62—65° в течение часа (бета-ингибиторы). Большинство из них относится к бета-липопротеидам.
2. Термостабильные ингибиторы, которые в свою очередь делятся на две группы — ингибиторы умеренной термостабильности и ингибиторы высокой термостабильности.
И. в. умеренной термостабильности разрушаются после прогревания при t° 75° в течение часа (ингибитор Франсиса, альфа-ингибитор). Они относятся к мукопротеинам, простетической группой которых являются нейраминовая к-та и ее производные.
И. в. высокой термостабильности не разрушаются при t° 100° (гамма-ингибитор). По хим. структуре они относятся к гликопротеинам, преимущественно связаны с альфа2-глобулиновой фракцией сывороток, но обнаруживаются также и среди альбуминовой и бета-глобулиновой фракций.
Помимо сыворотки крови, И. в. найдены также в тканях, секретах и экскретах человека и позвоночных животных. Они обнаружены в экстрактах из тканей легкого, печени, селезенки, почки, мозга, в слюне, моче и т. д. В частности, в слюне здоровых людей найдены ингибиторы, подавляющие репродукцию вируса полиомиелита в различных культурах клеток. Следует заметить, что в ряде случаев ингибиторам, выделяемым из тканей, присуща более сложная структура, чем И. в., получаемых из сывороток крови. Установить какую-либо зависимость между содержанием ингибиторов в сыворотке крови и тканях не удалось.
По мнению В. М. Жданова, П. Н. Косякова, 3. И. Ровновой и др., муко- и липопротеиновые И. в., выявляемые в различных тканях, секретах и экскретах организма, а также некоторые виды термостабильных сывороточных ингибиторов следует считать рецепторами клеток или веществами, тождественными по своему составу этим рецепторам.
Механизм действия
Несмотря на то, что антивирусная активность И. в. порой бывает достаточно высокой (показано, напр., что сыворотки крови морских свинок могут нейтрализовать до 10 млн. DL50 для мышей некоторых штаммов вируса гриппа), судьба их в процессе заболеваний, обусловленных вирусами, изучена крайне недостаточно. Тем не менее установлено, что развитие вируса гриппа в эмбрионах кур, в мозге и легких мышей приводит к падению титров ингибиторов. Подобное понижение ингибирующей активности смывов из верхних дыхательных путей человека, наблюдавшееся в остром периоде гриппозной инфекции, было предложено использовать в качестве метода ранней диагностики гриппа. В процессе выздоровления от вирусной инфекции (в частности, от гриппа) количество ингибиторов вновь увеличивается. При этом титры сывороточных ингибиторов начинают нарастать примерно в те же сроки, когда появляются и антитела к вирусам. Повышение содержания И. в. и антител обычно идет параллельно. В последующем увеличение неспецифических И. в. сменяется снижением их количества, к-рое наступает раньше, чем начинает снижаться титр антител.
Наблюдавшаяся порой высокая антивирусная активность И. в. дала основание для попыток использовать их в качестве профилактического и леч. средства при некоторых экспериментальных вирусных инфекциях. Однако несмотря на полученные положительные результаты в ряде таких экспериментов И. в. не нашли практического применения в терапии вирусных инфекций.
Библиография: Косяков П. Н. и Ровно в а 3. И. Противовирусный иммунитет, М., 1972; Л у з я н и н а Т. Я. Особенности взаимодействия термолабильных сывороточных ингибиторов с различными вирусами, Acta virologica, т. 6, № 6, с. 498, 1962; Проблемы патогенеза и иммунологии респираторных вирусных инфекций, под ред. А. А. Смо-родинцева и др., т. 1, с. 35, Л., 1969.
Интерференция вирусов (лат. приставка inter- между; гибель, уничтожение + ferens, ferentis несущий, переносящий; вирусы) — антагонистическое, или ингибиторное, действие одного вируса или его компонентов на репродукцию другого вируса и течение инфекционного процесса, вызываемого последним. Первый вирус, обусловливающий феномен, называют интерферирующим, а второй — претендующим или интерферируемым. При одновременном введении вирусов возможна двусторонняя интерференция. Явление Интерференции вирусов используется при лабораторной диагностике и вакцинной профилактике некоторых вирусных инфекций. Интерференция может влиять на течение заболевания, способствуя выздоровлению или, наоборот, возникновению хронических патологических состояний (в случае неполной интерференции), а также изменять сроки появления и распространения эпидемий.
Феномен интерференции используется и в мед. практике. Так, вирусологические лаборатории применяют методы, основанные на интерференции, для обнаружения, выделения и титрования нецитопатогенных вирусов, а также антител к ним (напр., при выделении и изучении вируса краснухи). В практике иммунизации обнаружено положительное, обусловленное интерференцией, действие живых вирусных вакцин на заболеваемость, вызываемую как гомологичными, так и гетерологичными агентами. Однако феномен интерференции может играть и отрицательную роль при иммунизации, напр, наличие энтеровирусов в кишечнике человека уменьшает приживляемость вакцинных штаммов полиовируса и, следовательно, эффективность вакцинации. Кроме того, возможность проявления интерференции должна учитываться при составлении поливалентных вакцин, а также схем вакцинации.
Интерференция может возникнуть между штаммами одного и того же вируса (гомологичная интерференция), а также между вирусами, различными в иммунологическом отношении (гетерологичная интерференция); могут интерферировать вирусы, сходные по морфологической и биохимической структуре, механизму и месту репродукции и биол, свойствам, а также вирусы, отличающиеся друг от друга по всем этим признакам. Интерферирующей активностью, а также чувствительностью к интерферирующему действию обладают практически все инфекционные вирусы. Кроме того, инфекционные вирусы могут интерферировать с онковирусами и с нек-рыми внутриклеточными микроорганизмами (напр., с возбудителями трахомы, с нек-рыми риккетсиями), причем эта интерференция может быть взаимной. Онковирусы также способны интерферировать между собой, и эта интерференция выражается не только в ингибиции вирусной репродукции, но также в уменьшении трансформации и онкогенности.
Интерферирующую активность проявляют также частично или полностью инактивированные вирусы, дефектные неинфекционные вирусные частицы и инфекционные вирусные РНК. Однако у некоторых вирусов (напр., у энтеровирусов) инактивация снижает или полностью подавляет интерферирующую активность. Дефектные вирусные частицы играют важную роль в гомологичной интерференции, а также в аутоинтерференции, к-рая представляет собой особый вид интерференции, выражающийся в уменьшении репродукции вируса при использовании для заражения животных или тканевых культур больших концентраций его (напр., вирусы гриппа и везикулярного стоматита).
Интерференция, как правило, является непродолжительным феноменом. Исключение составляют случаи длительного присутствия интерферирующего вируса в организме или культурах клеток. Напр., латентно инфицированные клеточные культуры в течение многих пассажей более устойчивы к заражению гетеро- или гомологичными вирусами. В некоторых случаях (энтеро- и онковирусы) эта устойчивость более выражена к суперинфекции гомологичным вирусом. Излечение культур от латентной инфекции возвращает им прежнюю чувствительность к заражению вирусами.
Интенсивность интерференции зависит от ряда условий: 1) биол, свойств вирусов (вирусы и даже штаммы одного вируса отличаются но интерферирующей активности и по чувствительности к интерферирующему действию); 2) множественности инфицирования (оптимальным является применение интерферирующего вируса в большой, а интерферируемого — в малой дозе); 3) интервала времени между введением вирусов и порядка введения (более эффективно введение интерферирующего вируса до интерферируемого); 4) метода введения вирусов (в большинстве случаев интерференция более выражена при использовании одного и того же пути введения обоих вирусов); 5) объекта, на к-ром производятся исследования (клеточные культуры или животные должны обладать определенной чувствительностью к обоим взаимодействующим вирусам, напр, энтеровирусы не интерферируют в нечувствительных клеточных культурах). В зависимости от этих условий наблюдается полная интерференция (полная ингибиция репродукции интерферируемого вируса) или неполная (снижение репродукции интерферируемого вируса). Эти условия также определяют интенсивность и продолжительность феномена — какой из взаимодействующих вирусов исполняет роль интерферирующего, а какой — интерферируемого.
Интерферирующая активность вирусов в опытах на животных снижается или полностью ингибируется действием некоторых гормонов (кортизон, эстроны), колхицина и иммунодепрессивных факторов (иммунодепроссанты, спленэктомия, рентгеновские лучи), а также понижением температуры (см. Ингибиторы вирусов). Некоторые из этих воздействий (пониженная температура, колхицин, кортизон) влияют также на интерференцию в культуре тканей.
Интерференция может быть определена по снижению репродукции интерферируемого вируса и синтеза его компонентов (напр., РНК, гемагглютинина, нейраминидазы), а также по уменьшению тяжести поражений, вызываемых данным вирусом в клетках и в организме животных.
Библиография: Вирус и клетка, под ред. Р. А. Кукайна, с. 111, Рига, 1966, библиогр.; Вирусные и риккетсиозные инфекции человека, под ред. Т. Риверса, пер. с англ., с. 117, М., 1955, библиогр.; 3ильбер Л. А. Учение о вирусах, с. 130, М., 1956; Лабораторная диагностика вирусных и риккетсиозных заболеваний, под ред. Э. Леннета и Н. Шмидт, пер. с англ., с. 293, М., 1974; Методы вирусологии и молекулярной биологии, пер. с англ., под ред. Л. Г. Тер-Саркисяна и М. Б. Николаева, с. 128, М., 1972, библиогр.; Doyle М. а. Hоllan d J. J. Virus-induced interference in heterologous-ly infected He La cells, J. Virol., v. 9, p. 22, 1972; Fenner F. a. White D. O. Medical virology, N. Y., 1976; Henle W. Interference phenomena between animal viruses, J. Immunol., v. 64, p. 203, 1950; Solovyov V. D. a. Mentkeviсh L. М. The effect of colchicine on viral interference and interferon formation, Acta virol., v. 9, p. 308, 1965, bibliogr.
Читайте также:

